СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОЛОГИЯ, 2008, № 2, с. 92-97
УДК 636.2:619:582.28
ИДЕНТИФИКАЦИЯ МИКРОСКОПИЧЕСКИХ ГРИБОВ, ПОРАЖАЮЩИХ КОПЫТЦЕВЫЙ РОГ, И ИХ РОЛЬ ПРИ ПОДОДЕРМАТИТЕ У КОРОВ
С.Н. КУЛИНИЧ
Проведены микологические исследования образцов копытцевого рога и биохимический анализ проб крови коров с гнойно-воспалительными процессами в дистальном отделе конечностей. Выявлены виды грибов, обладающие кератолитической активностью, провоцирующие патологические изменения.
Ключевые слова: коровы, микроскопические грибы, гнойные процессы.
Key words: cows, microscopic mushrooms, pussy inflammation processes.
Известно, что прочность копытцевого рога зависит от содержания кальция и неорганического фосфора (1). При патологических процессах в копытцевом роге оно может изменяться, вследствие чего рог крошится и деформируется (2). Нормальное его состояние зависит также от условий содержания животных, предоставления им моциона, вида полов в коровнике и т.д.
К малоисследованным факторам, влияющим на состояние копытцевого рога, можно отнести микроскопические грибы, которые выделяют кератиназы. Разрушая внешний роговой слой, паразитические грибы провоцируют патологические процессы (3, 4). Так, при размножении кератолитических грибов даже незначительная травма конечности может привести к развитию пододерматитов (5).
Одной из микозных инфекций, которая плохо поддается лечению антибактериальными препаратами, считается унгуломикоз — многокомпонентная патология копытец. Заболевание сопровождается прогрессирующим распадом роговой подошвы. У коров в большей степени повреждаются тазовые конечности в период стойлового содержания (6, 7). Распад рога при этом обусловлен патогенным действием ассоциаций кератомицетов, преимущественно трихофитов, кандид и плесеней (8). Провоцируют микозное поражение неудовлетворительные зоогигиенические условия, несбалансированность рационов по белку и минеральным веществам, высококонцентратный тип кормления. При продолжительном действии кератолитические грибы постепенно расслаивают рог подошвы, что приводит к образованию кратероподобных язв, иногда проникающих в основу кожи (9). Расширению инвазии способствуют механическое повреждение тканей и наличие омертвевших клеток. При этом сами паразиты, а также продукты их жизнедеятельности проникают в кровь и лимфу. Как следствие, у животных развивается местный гнойно-воспалительный процесс с характерной для клинической картины общей и локальной интоксикацией.
Целью наших исследований была идентификация микроскопических грибов, выделенных из поверхностных и глубоких слоев копытцевого рога коров с гнойно-воспалительными процессами в области пальцев, а также оценка клинического состояния пораженных животных.
Методика. В разных хозяйствах Полтавской области у коров с патологическими изменениями копытцевого рога отбирали фрагменты поверхности подошвы. Микробиологические исследования образцов (всего 212 проб) и микроскопию грибов (бинокулярный микроскоп Studar E, Польша) выполняли на базе сектора жидкостной хроматографии микологического отдела Полтавской областной государственной лаборатории ветеринарной медицины. Для идентификации возбудителя материал высевали на питательное сусло, среды Сабуро, Григораки, Плаута. Посев материала, отобранного из области глубокого поражения, осуществляли согласно разработанной нами методике (10) с использованием специальной среды для диагностики микроскопических грибов, обладающих кератолитическими свойствами (11). Биохимический анализ крови проводили в научно-исследовательской лаборатории Полтавской государственной аграрной академии, активность щелочной фосфатазы, аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), g-глютамилтрансферазы (ГГТ), лактатдегидрогеназы (ЛДГ) определяли с помощью наборов фирмы «ECO-MED-POLL HGes. m.b.H.» (Австрия) на анализаторе Super Z 818 («Hitachi», Япония); ревматоидный фактор выявляли методом преципитации (12). Число обследованных животных — 10 гол. (по 5 больных и здоровых). Кровь для биохимических исследований отбирали из яремной вены утром перед кормлением.
Статистическую обработку данных выполняли методами вариационной статистики с использованием программы MS Excel и таблиц Стьюдента (13).
Результаты. Отобранный копытцевый рог легко крошился. При микроскопическом исследовании 212 образцов нативного материала в 86 выявили фрагменты тонкого, прозрачного, короткого мицелия различного диаметра. Мицелий был фрагментирован, некоторые нити разветвлялись. Наблюдалось значительное число спор округлой и полигональной формы, частицы мицелия в виде колец, дуг и овалов, а также спорулирующий мицелий и споры.
1. Видовая идентификация микроскопических грибов, выделенных из копытцевого рога коров с гнойным пододерматитом на разных питательных средах
|
Вид грибов |
Питательная среда |
Сабуро |
cусло |
Григораки |
Плаута |
МСКР |
Aspergillus flavus |
+ |
+ |
+ |
– |
– |
A. fumigatus |
+ |
+ |
+ |
– |
– |
Mucor sp. |
+ |
+ |
+ |
+ |
– |
Penicillium urtice |
+ |
– |
– |
– |
– |
P. expaansum |
+ |
– |
– |
– |
– |
P. chrisogenum |
+ |
– |
– |
– |
– |
P. commune |
+ |
– |
– |
– |
– |
Fusarium sporotrichitlla |
+ |
+ |
– |
– |
– |
Acremoniella atra |
+ |
– |
– |
– |
+ |
Cladosporium chrysanthemi |
– |
– |
– |
– |
+ |
Candida albicans |
– |
– |
+ |
– |
– |
Trichoderma viridae |
– |
– |
– |
– |
+ |
П р и м е ч а н и е. МСКР — модифицированная среда с копытцевым рогом; «+» и «–» — соответственно рост и его отсутствие. |
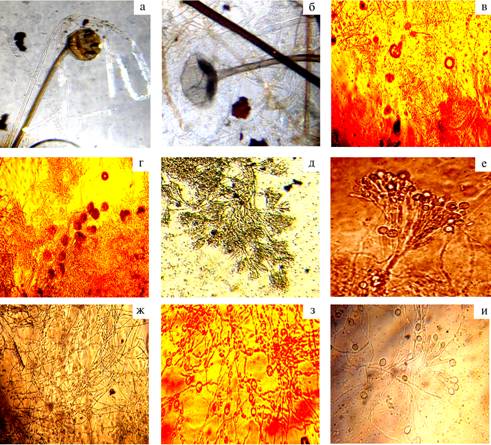
В пробах из поверхностных слоев пораженных участков рога были выделены следующие виды грибов: Mucor sp., M. globosus, Aspergillus flavus, A. fumigatus, Penicillium urtice, P. еxpansum, Р. сhrysogenum, P. еxpansum, P. furtice, P. citreoviride, P. digitatum, Р. viridicatum (рис., табл. 1). Прорастание мукоровых грибов на средах регистрировали на 5-6-е сут. При этом появлялись бледно-коричневые, быстрорастущие пушистые колонии со множеством спор. Спорангиеносцы были спутанными (по типу войлока), моноподиально разветвленными, споры — гладкими, слабо окрашенными, различной формы.
А. flavus формировал быстро- и медленнорастущие (соответственно 6-7 и 3-4 см в диаметре) колонии с тонким, скрученным мицелием, конидиальные головки ярко-желтого, желто-зеленоватого или желто-зеленого оттенка.
Колонии A. fumigatus были бархатистые, с глубокими складками, в начале роста белого, позже — зеленого цвета, с обратной стороны чашки Петри желтые, зеленые, иногда красно-коричневые. Конидиальные головки колонообразные, компактные, конидиеносцы округлые, короткие, гладкие, стеригмы одноярусные, густо размещенные, конидии в массе зеленые, шарообразные.
У грибов рода Penicillium колонии были радиальные с утолщением ближе к центру, пушистые, серовато-зеленые, иногда бледно-серые, с обратной стороны чашки Петри — оранжево-коричневые, конидиеносцы одиночные, «кисточки» разветвленные, конидии веерообразные эллиптической формы, с тонкой гладкой оболочкой, собраны в цепочки.
|
Виды грибов, выявленные в образцах из поверхностных (а-е) и глубоких (ж-и) слоев копытцевого рога коров с гнойным пододерматитом: а, б — Mucor sp., в — Aspergillus flavus,г— A. fumigatus,д — Penicillium urtice,е — P. chrisogenum,ж — Trichoderma viridae,з — Acre-moniella atra, и — Cladosporium chrysanthemi(½100).
|
При анализе материала из глубоких слоев пораженного копытцевого рога выделили следующие виды грибов: Trichodermaviridаe, Aсre-moniellaatra, Cladosporiumchrysanthemi (см. рис., табл. 1). В связи с низким содержанием глюкозы в разработанной для этих целей среде рост грибов, выявляемых на стандартных средах, не регистрировали.
У T. viridаe сначала формировался налет мицелия на поверхности агара в виде ваты, со временем его цвет изменялся на зелено-коричневый, колонии приобретали форму небольших подушечек. Конидиеносцы были разделены в виде веток, споры имели размер 3-5½3-4 мкм.
Колонии Сl. chrysanthemi по мере роста становились коричнево-бурыми с бурым, ползучим, поверхностно расположенным мицелием, конидиеносцы простые, с перегородками, конидии округлой формы, собраны в короткие цепочки.
При биохимических исследованиях крови у животных с гнойным пододерматитом, вызванным действием кератолитических грибов (табл. 2.), наиболее достоверные изменения отмечали по активности щелочной фосфатазы: при развитии гнойного воспаления она повышалась на 42,7 %.
2. Биохимические показатели сыворотки крови у коров, больных гнойным пододерматитом
|
Показатель |
Группа животных |
здоровые (n = 5) |
больные (n = 5) |
Активность, ед/мл: |
щелочная фосфатаза |
43,20±0,28 |
75,30±0,31 |
АЛТ |
29,40±0,17 |
24,90±0,22 |
АСТ |
43,30±0,16 |
41,30±0,92 |
ГГТ |
29,20±0,13 |
32,90±0,07 |
ЛДГ |
1717,60±0,87 |
1520,20±1,20 |
Содержание серомукоида, ед/л |
0,18±0,02 |
0,15±0,04 |
Ревматоидный фактор |
− |
− |
П р и м е ч а н и е. АЛТ, АСТ, ГГТ и ЛДС — соответственно аланинаминотрасфераза, аспартатаминотрансфераза, g-глутамилтрансфераза и лактатдегидрогеназа; «–» — отрицательный результат в реакции преципитации. |
У больных животных отмечали снижение активности АЛТ и АСТ (соответственно на 15,3 и 4,7 %), возможная причина которого — развитие общей интоксикации, особенно при недостатке витамина В6. Увеличение активности АЛТ и АСТ обычно связывают с патологией печени, хотя в других органах и тканях (почки, эритроциты) содержание этих ферментов также достаточно велико.
Активность ГГТ, наоборот, возрастала на 12,6 %, что, вероятно, обусловлено частичным поражением интрагепатических желчных ходов, содержащих большое количество фермента. В литературе также имеются данные о том, что увеличение активности ГГТ может вызывать использование ветранквила в качестве седативного средства.
Накопление токсических продуктов в очаге патологии сопровождалось уменьшением активности изофермента ЛДГ в сыворотке крови (на 11,43 %), что связано с эндотоксикозом и угнетением эритропоэза. Известно, что наиболее высокую активность ЛДГ регистрируют в эритроцитах, почках и сердечной мышце. По данным литературы, именно этот фермент играет решающую роль в развитии воспалительных процессов.
Дополнительным фактом, подтверждающим снижение резистентности у больных животных, послужило выявленное уменьшение содержания серомукоидов в сыворотке крови (на 16,7 % относительно показателя у здоровых коров). Кроме того, у всех больных животных не был обнаружен ревматоидный фактор. Известно, что он способен вызывать ревматическое поражение копыта, сопровождающееся развитием хронического воспаления. Однако не следует забывать, что отрицательный результат при выявлении ревматоидного фактора в реакции преципитации полностью не исключает его наличия: у 5 % животных, по данным литературы, имеются соответствующие серонегативные формы, которые не фиксируются при постановке этой реакции.
Активность щелочной фосфатазы у больных животных повышалась, что может быть обусловлено накоплением в очаге воспаления молодых форм нейтрофилов, содержащих значительное количество фермента. Такое состояние является компенсаторной реакцией макроорганизма, поскольку в очаге патологии под воздействием миелопероксидазной системы нейтрофилов происходит массовая гибель микроорганизмов, в утилизации и гидролизе продуктов распада которых участвует щелочная фосфатаза.
Таким образом, у коров с признаками разрушения роговой капсулы копытец было выделено значительное количество микроскопических грибов. Их роль в патологическом процессе разнообразна. Патогенность мукоровых грибов прежде всего обусловлена способностью к быстрому инвазивному росту. Они также способны прорастать в стенки сосудов, образуя тромбы, эмболы и ишемические некрозы окружающих тканей. Мы считаем, что роль грибов этого рода в формировании патологического процесса в копыте вторична. Они проявляют деструктивные свойства в отношении тканей (кожная основа копыта) в том случае, когда поврежден защитный барьер (роговой чехол).
Грибы рода Aspergillus продуцируют опасные для макроорганизма токсины, в частности значительное количество папулина (микотоксина), который относится к ядовитым веществам первого класса. Кроме того, грибы видов A. fumigatus и A. flavus продуцируют афлотоксин В1 — один из наиболее сильных гепатотропных ядов, обладающих также выраженным канцерогенным эффектом. Как известно, действие веществ, выделяемых A. fumigatus и A. flavus, во многом сходно с действием токсина, продуцируемого Stachybotrys alternans. Так, афлотоксин, выделяемый A. flavus, не разрушается даже при 160 °С.
Мы полагаем, что грибы названных видов проникают в копытцевый рог, разрушенный и разрыхленный под воздействием кератиназ других грибов. Достигая живых мягких тканей, они вызывают в них цитолиз, продуцируя афлотоксины (аспергилловая кислота, флавицин). В литературе, однако, имеются и другие данные. Так, Paldrok и Halson (1952) выделили из ногтевого ложа человека культуру Aspergillus, которая способна самостоятельно разрушать твердые кератины (9). Процесс сопровождался деформацией ногтя, потерей плотности и окрашиванием в темно-желтый цвет. В то же время авторы отмечали, что кератинофилия у аспергиллов наблюдается редко. Более поздние исследования свидетельствуют, что в подавляющем большинстве аспергиллы выделяют кератиназы (14, 15).
Выявленные в исследуемых образцах грибы рода Penicillium, скорее всего, попадают в копытный рог из-за постоянного загрязнения некачественной подстилкой (гниющая солома).
На предложенной нами среде, содержащей копытный рог, были выделены грибы T. viridаe, Cl. chrysanthemi и A. atra, которые, как известно, относятся к группе наиболее активно разрушающих целлюлозу. Мы считаем, что, попадая в деформированное копыто и адаптируясь к субстрату, они начинают расщеплять роговое вещество. Это длительный процесс, наиболее интенсивно происходящий в зимне-стойловый период, когда животные содержатся в условиях гиподинамии. У некоторых животных при разрушении копытцевого рога оголялись живые ткани, и вследствие их механического травмирования развивался гнойный пододерматит.
Итак, проведенные исследования свидетельствуют, что длительное стойловое содержание коров в условиях гиподинамии без плановой ортопедической расчистки копытец способствует накоплению гнойных масс. В них содержится значительное количество микроскопических грибов (Mucor sp., Aspergillus flavus, A. fumigatus, Penicillium urtice, P. сhrisogenum), в том числе тех, которые, проявляя кератолитические свойства (Trichodermaviridae, Acremoniellaatra, Cladosporiumchrysanthemi), расщепляют роговую пластинку подошвы копытец, провоцируя развитие гнойно-воспали-тельных процессов в области пальцев и общей интоксикации, что, как известно, негативно влияет на продуктивность коров.
Л И Т Е Р А Т У Р А
- М о л о к а н о в В.А. Этиопатогенез, профилактика и лечение заболеваний копытец у крупного скота в некоторых биогеохимических провинциях Южного Урала (клинико-экспериментальные исследования). Автореф. док. дис. СПб, 1992.
- Б а х т у р и н А.Я., У р ю п и н а Н.В., К о л о м и й ц е в С.М. Состояние опорно-двигательного аппарата у быков в условиях животноводческих комплексов. В сб.: Мат. Международ. науч.-практ. конф. Харьков, 1994: 41.
- П и д о п л и ч к о Н. М. Грибная флора грубых кормов. Киев, 1953.
- И з д е п с к и й В.И., К у л и н и ч С.Н. Состояние некоторых биохимических показателей крови у коров с признаками гнойно-некротического распада копытного рога. В сб.: Актуальные проблемы диагностики, терапии и профилактики болезней домашних животных. Мат. Междунар. науч.-практ. конф., посвященной 80-летию факультета ветеринарной медицины ФГОУ ВПО Воронежский государственный аграрный университет им. К.Д. Глинки. Воронеж, 2006: 174-178.
- I з д е п с ь к и й В.Й., К у л и н и ч С.М. Поширенiсть грибкових уражень копитець у зимово-стiйловий перiод, причини появи та особливостi клiнiчного перебiгу. Вiсн. Сумського нац. аграр. унiвер., 2006, 1-2(15-16): 89-92.
- П а н ь к о I.С., В л а с е н к о В.М., Г а м о т а А.А. Спецiальна ветеринарна хiрургiя. Бiла Церква, 2003.
- Б о р и с е в и ч В.Б., П а н ь к о I.С., Т е р е с М. О. и др. Спецiальна ветеринарна хiрургiя. Ки¿в, 1993.
- С а р к и с о в А.Х., К о р о л е в а В.П., К в а ш и н а Е.С. и др. Диагностика грибковых болезней животных. М., 1971.
- Л е щ е н к о В.М. Аспергиллез. М., 1973.
- И з д е п с к и й В.И., К у л и н и ч С.Н., Г л у щ е н к о С.Г. Способ диагностики дерматомикозов дистального отдела конечностей у коров. Пат. 18803 Украина, МПК А61Д 99/00, ¹ u 200606281. Заявл. 05.06.2006. Опубл. 15.11.2006, Киев, Бюл. ¹ 11.
- И з д е п с к и й В.И., К у л и н и ч С.Н., Г л у щ е н к о С.Г. Среда для диагностики кератолитических микроскопических грибов. Пат. 19340 Украина, МПК С 12 N 1/20 C 12 Q 1/04, ¹ u 200606280. Заявл. 05.06.2006. Опубл. 15.12.2006, Киев, Бюл. ¹ 12.
- Н и к и т и н В.Н. Справочник методов иммунологии. Кишенев, 1982.
- Л а к и н Г.Ф. Биометрия. М., 1980.
- К о ж и ч к и н а Н.В. Клинические особенности, критерии диагностики и лечение плесневого онихомикоза. Вест. дерматол. и венерол., 2005, 3: 74-75.
- С е р г е е в А.Ю. Руководство по лабораторной диагностике онихомикозов. М., 2000.
Полтавская государственная аграрная академия,
36003 Украина, г. Полтава, ул. Сковороды, 1/3,
Кафедра хирургии и акушерства,
e-mail: kulinich@pdaa.com.ua |
Поступила в редакцию
29 марта 2007 года |
IDENTIFICATION OF FUNGI SPECIES WHICH
DESTROY THE HOOF’S HORN AND THEIR ROLE UNDER
PODODERMATITIS IN COWS
S.N. Kulinich
S u m m a r y
The results of mycological investigations of hoof’s horn samples and biological analysis of blood in cows with pyoinflammatory processes in distal segment of extremities are presented. The fungi species with keratolytic activity were revealed, which provokes the pathological changes.
