СЕЛЬСКОХОЗЯЙСТВЕННАЯ БИОЛОГИЯ, 2008, № 2, с. 12-19
УДК 636.2/.3:591.132:579.6
О МОРФОФУНКЦИОНАЛЬНЫХ ОСОБЕННОСТЯХ МИКРОБИОТЫ РУБЦА ЖВАЧНЫХ ЖИВОТНЫХ И РОЛИ ЦЕЛЛЮЛОЗОЛИТИЧЕСКИХ БАКТЕРИЙ В РУБЦОВОМ ПИЩЕВАРЕНИИ
А.Г. ГРУШКИН, Н.С. ШЕВЕЛЕВ
Рассмотрена роль и участие слизистых слоев гликокаликса и целлюлосом микроорганизмов рубца в микробиальной ферментации растительных кормов в преджелудках жвачных животных, а также механизм образования и транспорта целлюлаз. Представлены оригинальные результаты электронно-микроскопических исследований процессов микробиальной ферментации и гистохимической визуализации целлюлаз в рубцовом содержимом.
Ключевые слова: рубцовое пищеварение, микробиальная ферментация, целлюлазы, целлюлосомы, гликокаликс, адгезия, электронная гистохимия.
Key words: rumen digestion, enzymic hydrolysis, cellulasa, cellulosomesa, glycocalyx, adhesion, histochemistry.
Известно, что в преджелудках жвачных животных под действием микроорганизмов на растительные корма образуются короткоцепочечные летучие жирные кислоты (ЛЖК), аминокислоты, аммиак и другие метаболиты, которые вовлекаются в обменные процессы организма-хозяина (1). В постнатальный период в рубце складывается благоприятная среда (анаэробные условия, рН) для развития бактерий, простейших и грибов, представляющих рубцовую микробиоту (микрофлору и микрофауну). Ее морфологический состав изменяется с возрастом: максимальная численность достигается к 7-, совокупность групп полностью гомеостазируется к 10-недельному сроку (2, 3). У взрослого животного микроорганизмы не всегда относятся к эндемической форме, имея кормовое или рубцовое происхождение.
Бактерии — наиболее распространенная, но не всегда преобладающая количественно часть микробиоты (4). К основной их группе — целлюлозолитическим микроорганизмам относятся Ruminococcusalbus, Ruminococcusflavefasciens и Bacteroidessuccinogenes, сыгравшие решающую роль в эволюции жвачных животных благодаря формированию рубцового пищеварения. Прикрепляясь к пищевым субстратам, эти бактерии выделяют ферменты, которые деструктурируют фрагменты растений, разрушая молекулу целлюлозы, отделяя боковые цепи и далее гидролизуя оставшиеся олигосахариды (5). Целлюлозолитические бактерии чувствительны к изменению рН (поэтому при повышении содержания крахмала и сахаров, которое приводит к снижению рН до 5,8, ферментация клетчатки ингибируется) и исключительно анаэробны. Амилолитические бактерии гидролизуют крахмал, не расщепляют целлюлозу, ферментируют декстрины и мальтозу, но не в состоянии использовать в качестве субстрата большинство моно- и дисахаридов. Они менее чувствительны к величине рН, хотя она в значительной степени влияет на соотношение ЛЖК. Скорость расщепления крахмала в рубце зависит от вида корма и его обработки. Сахаролитические бактерии также ферментируют простые растворимые сахара (в отличие от гидролиза зерен крахмала и волокон клетчатки механизм адгезии при этом не задействован). Ферментация растворимых сахаров может происходить независимо от роста бактерий.
Некоторые виды рубцовых бактерий являются протеолитическими и расщепляют растворимые белки, аминокислоты и пептиды с образованием аммиака.
Липолитические бактерии рубца (липазы в основном являются эндоферментами) гидрогенизируют ненасыщенные жирные кислоты, некоторые преобразовывают глицерол, выделяемый при гидролизе жиров (6).
Число простейших в рубце меньше по сравнению с числом бактерий. Если в эксперименте из рубца удаляются простейшие, то их функцию берут на себя бактерии (7). В рубце жвачных обычно встречаются две большие группы простейших — энтодиниоморфы и голотрихии, утилизирующие крахмал и растворимые сахара. Простейшие обладают ферментативной активностью и способствуют стабилизации рубцовой среды. Они прикрепляются к крупным частицам корма, что препятствует их выходу из рубца с жидкой фазой. Средняя продолжительность пребывания инфузорий в рубце — 10 ч. Степень адгезии является благоприятным фактором для их жизнедеятельности (4). Некоторые представители рода Epidinium выделяют ферменты, лизирующие межклеточное вещество, вследствие чего растительные ткани распадаются и пищевой субстрат фрагментируется. После этого они, как и энтодиниоморфы, заглатывают и внутриклеточно утилизируют крупные частицы субстрата (5). Большое количество голотрихий может также скапливаться на слизистой оболочке преджелудков.
Анаэробные грибы используют в качестве источников энергии моно-, олиго- и полисахариды растительных тканей. Они обладают целлюлозолитической, протеазной и гидролазной активностью, позволяющей мицелию проникать внутрь растительных тканей и быстро их расщеплять (8).
В рубце крупного рогатого скота присутствует значительное количество бактериофагов, вследствие размножения которых при освобождении фагового потомства происходит лизис клетки микроорганизма (9).
Мы изучали морфологический состав и активность микробиоты разных участков рубца методами электронной микроскопии. Опыты проводили на интактных лактирующих коровах черно-пестрой породы с живой массой 400-450 кг. Подопытных животных содержали в условиях вивария Российского государственного аграрного университета — МСХА им. К.А. Тимирязева на сено-концентратном рационе, сбалансированном по общей питательности, сахаро-протеиновому отношению и минеральным веществам согласно детализированным нормам кормления, поили вволю (10). Образцы содержимого рубца отбирали пищевым зондом до и через 3 ч после утреннего кормления (пик рубцового пищеварения). Пробы разделяли на рубцовую жидкость и отжимки, полученные через четыре слоя марли (соответственно фракции свободных и связанных с пищевыми частицами организмов). Рубцовую жидкость центрифугировали 15 мин при 3000 об/мин; в полученной надосадочной жидкости содержались бактерии, в осадке — простейшие. Пробы без добавления химических консервантов помещали на холод (11, 12). Определяли физико-химические свойства, активность бактериальных ферментов, состав микрофлоры. Для этого использовали сканирующую электронную микроскопию (СЭМ) с последующим ионным напылением золота (микроскоп Tesla BS-300, прибор IB-3, Япония). Криогенные методы, как известно, позволяют сохранять прижизненное распределение компонентов биологических систем и нативное состояние мукополисахаридов, липидов и белков, поскольку не происходит денатурация органических веществ (даже водорастворимых) химическими фиксаторами, применяемыми в обычных методиках. Полученные таким способом образцы пригодны также для просвечивающей электронной микроскопии (ПЭМ), с помощью которой можно выполнять более точный количественный и качественный анализ клеточных элементов, макромолекул, активных ферментных групп. Для электронно-гистохимического выявления гликокаликсных образований препараты фиксировали и окрашивали рутениевым красным по Лафту, а также проводили визуализацию целлюлаз (13). Субстратом служила растворимая свободная форма целлюлозы — карбоксиметилцеллюлоза, гидролизуемая целлюлозолитическими ферментами до сахаров, которые, связываясь с ионами меди, содержащимися в растворе Бенедикта, образуют электронно-плотный продукт, указывающий на локализацию целлюлаз в микробиальной клетке и вне ее (14, 15).
Как оказалось, для различных участков рубца характерны неодинаковые биоценозы, в которых доминируют определенные группы микроорганизмов. Известно, что микробиота рубца представлена тремя группами — бактериями рубцовой жидкости, микроорганизмами, адгезированными на кормовых субстратах, и бактериями, адгезированными на слизистой оболочке рубца (16, 17). Первые эвакуируются из рубца быстро, вторые медленнее, третьи можно считать обитающими в рубце постоянно, так как они попадают в его содержимое только при десквамации — с отмершими клетками рогового слоя слизистой оболочки. Основная масса бактерий адгезирована на кормовых субстратах, с которыми связано более 75 % обменной энергии АТФ (18).
М и к р о о р г а н и з м ы р у б ц о в о й ж и д к о с т и. Эта популяция неспецифична и содержит организмы, освободившиеся от субстратов, к которым ранее были присоединены. Для их выживания существенным условием является превышение скорости размножения по сравнению со скоростью разбавления рубцовой жидкости и эвакуации содержимого из рубца в следующие отделы желудочно-кишечного тракта.
Экспериментальная часть выполнена при поддержке РФФИ, грант ¹ 06-04-48408-а.
|
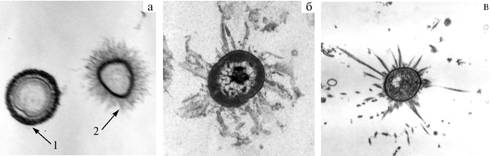
Рис. 1. Различная степень адгезии целлюлозолитических микроорганизмов в рубце: а — адгезия крупных бактерий на растительных волокнах с примесью слизистых образований; б — адгезия мелких бактерий на растительных волокнах с примесью рубцовых слизистых образований (сканирующая электронная микроскопия, ½10 000); в — полная адгезия микроорганизма на пищевом растительном субстрате при помощи гликокаликса (просвечивающая электронная микроскопия, ½10 000). |
М и к р о о р г а н и з м ы, н а х о д я щ и е с я в к о н т а к т е с п и щ е в ы м и с у б с т р а т а м и. Основная часть рубцовой ферментации грубых кормов осуществляется микроорганизмами в контакте с пищевыми частицами. Феномен адгезии рубцовых микроорганизмов на пищевых субстратах и слизистой оболочке (рис. 1) позволяет рассматривать преджелудки как непрерывную иммобилизованную ферментативную систему. В утилизации растительных кормов физиологически наиболее важное значение играют целлюлозолитические микроорганизмы, лизирующие клетчатку и сбраживающие крахмал и олигосахариды. Мы наблюдали, что целлюлозолитические бактерии в процессе пищеварения прочно прикрепляются к пищевым субстратам, выделяют ферменты, деструктирующие растительные фрагменты вплоть до гидролиза олигосахаридов. Отметим, что метаболические процессы в пищеварительной системе в целом изучены хорошо, однако микробиальный этап рубцового пищеварения исследован недостаточно.
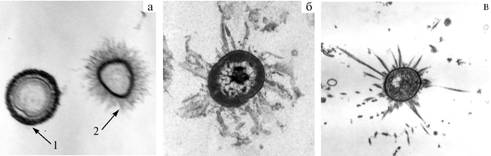
Основную часть микробиоты рубца, как уже отмечалось, составляют целлюлозолитические бактерии (с которыми связано более 75 % обменной энергии АТФ), адгезированные на кормовых субстратах. В наших опытах через 3 ч после утреннего кормления в рубце у коров общее число бактерий составило 11,06-12,47 млрд/мл, простейших — 373-440 тыс/мл; целюллозолитическая активность равнялась 18,3-22,5 %, амилолитическая — 28,8-29,3 мг% (19). Все виды бактерий в рубцовой популяции усиленно делились с образованием цепочек. Бактерии были окружены рубцовой слизью и внеклеточными, в большинстве случаев грамотрицательными слизистыми слоями (гликокаликсами) толщиной 10-100 нм, которые состоят из мукополисахаридов (подкласс — гликопротеины) с волокнистой структурой и имеют разное строение (рис. 2). С помощью этого волокнистого слизистого компонента осуществляется фиксация (адгезия) целлюлозолитических бактерий на растительных клеточных стенках.
|
Рис. 2. Различная форма гликокаликса у целлюлозолитических микроорганизмов рубца: а — овальные кокковидные микроорганизмы с уплотненным (1) и волокнистым (2) строением гликокаликса; б — овальный кокковидный микроорганизм с «протуберанцевидным» строением гликокаликса; в — кокковидный микроорганизм с удлиненными игольчатыми структурами, покрытыми слизью (просвечивающая электронная микроскопия, ½5000). |
Мукополисахариды представляют собой неклеточный вязкий, упругий биополимер, продуцируемый микроорганизмами, с характерными свойствами (жидкости — текучесть, твердых тел — способность выдерживать определенные физические нагрузки) и функциями (транспортная, пищеварительная, протекторная) (18). Гликокаликс предохраняет бактерии от бактериофагов, бактериоцинов и воздействия антибиотиков, то есть биологических агентов. Кроме того, анионы углеводного слоя гликокаликса образуют своеобразную ионообменную «колонку», защищающую бактериальную клетку от несанкционированного проникновения химических агентов — молекул и ионов.
В образовании адгезивного контакта участвуют трансмембранные рецепторы — интегрины, объединяющие внеклеточные и внутриклеточные структуры микроорганизмов и растительных субстратов в единый пищеварительный комплекс. С помощью гликокаликсов бактерии фиксируются не только на пищевых субстратах, но и на эпителиальных клетках слизистой оболочки рубца.
Бактерии рубца переваривают растительные субстраты в разной степени. В отличие от анаэробных грибов они не могут расщеплять ксилему и разлагают только периферию склеренхимы. Нелигнифицированные ткани мезофилла и флоэмы лизируются первыми при относительно невысокой бактериальной активности. Умеренно лигнифицированные наружные оболочки пучка и эпидермальные ткани перевариваются менее интенсивно и только при обильной обсемененности бактериями. Сильно лигнифицированные ткани остаются, как правило, интактными. Локализация прикрепленных бактерий и характер адгезии зависят от физических свойств корма. Плотное прилипание наблюдается на жестких клеточных стенках; с участками субстрата, которые ферментируются легко, бактерии связываются слабо. От вида корма в значительной степени зависит распределение бактерий внутри рубца, но не их численность. Основная часть бактерий адгезирована на кормовых субстратах при помощи гликокаликса, в котором наблюдается ферментативная активность (рис. 3).
|
|
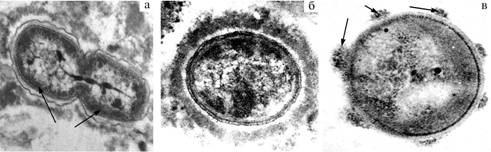
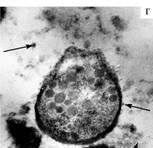
Рис. 3. Локализация целлюлозолитических ферментов в клетках микроорганизмов рубца: а — распределение целлюлозолитических ферментов между дочерними клетками, б — экзоклеточная иммобилизация целлюлозолитических ферментов в зоне гликокаликса, в — формирование целлюлосом с ферментами в зоне гликокаликса, г — целлюлозолитические ферменты, «выстреливаемые» в сторону растительного субстрата. Гистохимическая визуализация целлюлазы (стрелки указывают на участки локализации целлюлазы; просвечивающая микроскопия, ½10 000). |
По нашим данным, на экзоклеточных структурах (целлюлосомах) гликокаликса целлюлозолитических бактерий рубца иммобилизованы целлюлозолитические ферменты, которые таким способом доставляются на растительные субстраты, где происходит лизис клетчатки (рис. 4).
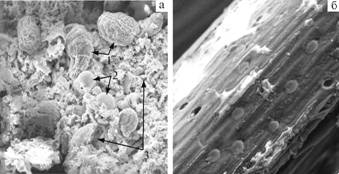
|
Рис. 4. Разнообразие микробиоты рубца и результат ее действия на растительный субстрат: а — крупные простейшие (1) и бактерии (2) со слизями (3), выявляемые в центрифугате рубцовой жидкости; б — пустые и заполненные бактериальными клетка-ми полости капсульного комплекса, образовавшиеся в процессе лизиса |
растительных субстратов (сканирующая электронная микроскопия, ½500). |
Б а к т е р и и, а д г е з и р о в а н н ы е н а с л и з и с т о й о б о л о ч к е р у б ц а. Эта микробиальная популяция весьма специфична и почти не зависит от анаэробного ферментирующегося субстрата. Указанная группа, по-видимому, регулирует отношения между анаэробной средой рубца и богатой кислородом стенкой преджелудков. Микроорганизмы обладают высокой протеолитической и уреолитической активностью (4). Бактерии с уреазной активностью сосредоточены в вентральных областях рубца с наиболее интенсивным всасыванием и регулируют транспорт мочевины через слизистую оболочку. Кроме того, эти микроорганизмы, вероятно, участвуют в транспорте ЛЖК и соединений серы через слизистую оболочку, а также регулируют регенерацию рубцового эпителия (9).
По физиологической классификации в зависимости от источников энергии микроорганизмы делят на следующие группы: сбраживающие клетчатку, переваривающие крахмал и олигосахариды, сбраживающие молочную и янтарную кислоту (промежуточные продукты обмена), расщепляющие липиды и вызывающие гидрирование и изомеризацию жирных кислот, расщепляющие белки и небелковые азотистые вещества.
Целлюлозолитические микроорганизмы, обладая значительной активностью (5), не выделяют целлюлазы в среду (6). Свободные целлюлазы, которые могут адсорбироваться на поверхности целлюлозы, выделяют протозойные микроорганизмы. Простейшие и бактерии рубца, действуя, как синергисты, могут переварить до 60 % целлюлозы корма. Поступившие в рубец сложные углеводы подвергаются ферментативному гидролизу целлюлозолитическими ферментами — целлюлазой, целлобиазой, мальтазой, сахаразой, инвертазой до ди- и моносахаридов, которые затем в разных метаболических циклах сбраживаются микроорганизмами до ЛЖК — уксусной, пропионовой, масляной, молочной, янтарной, а также некоторых других низкомолекулярных соединений (20). При этом количественно преобладают ЛЖК (вследствие низкого содержания кислорода в преджелудках жвачных и небольшой глубины окисления моносахаридов и других субстратов брожения).
В рубце жвачных животных растительные субстраты, бактерии, слизистые образования и гликокаликс формируют пищеварительные симбиозы, работа которых, по-видимому, регулируется посредством специальных клеточных белков — цитокинов. Цитокины (в настоящее время открыто и изучено более сотни) могут стимулировать или ингибировать различные клеточные функции. Наиболее известные по направленности действия группы цитокинов — интерфероны, интерлейкины, ростовые факторы, факторы некроза опухоли и некоторые другие. При пищеварении, по-видимому, действуют факторы лизиса. Цитокиновый комплекс принимает участие в регуляции гомеостаза. Цитокиновые белки можно рассматривать как физиологически активные вещества, которые функционируют по принципу «ключ—замок», регулируя как общий обмен, так и процессы пищеварения (21).
П р е в р а щ е н и е л и п и д о в в р у б ц е. Активное превращение липидов корма происходит при непосредственном участии липолитических микроорганизмов. На большую часть рубцовой микробиоты ненасыщенные жирные кислоты растительных кормов оказывают подавляющее токсическое действие, так как являются веществами с поверхностно активными свойствами и активными акцепторами водорода. Поэтому некоторые рубцовые бактерии и простейшие (энтодиниоморфы и голотрихии) в процессе эволюции приобрели способность превращать ненасыщенные жирные кислоты в насыщенные (22). Основная роль принадлежит простейшим, которые, гидролизуя липиды (до 75 %), используют продукты распада в первую очередь для синтеза структур собственного тела. В то же время в содержимом преджелудков липиды накапливаются во всех других фракциях рубцовой экосистемы (8).
П р е в р а щ е н и е а з о т и с т ы х в е щ е с т в в р у б ц е. Протеазы, локализированные на поверхности клеток микроорганизмов, свободно контактируют с субстратом. Ферменты уреаза и дезаминаза осуществляют гидрогенизацию липидов (6). Кроме того, протеолитические микроорганизмы рубца продуцируют витамины и другие биологически активные вещества. Используя аммиак, они синтезируют аминокислоты и полноценные белки, содержащие заменимые и незаменимые аминокислоты. В результате распада гликопротеидов, белков, липидов и нуклеиновых кислот, которые также присутствуют в рубце жвачных животных, при разных типах брожения образуются ЛЖК (23). Белок простейших составляет значительную часть белка содержимого рубца жвачных: на бактерии приходится 12, инфузории — 20,3 % от общего количества содержимого. Следует отметить, что по содержанию незаменимых аминокислот белок инфузорий значительно превосходит бактериальный (7). В клетках микроорганизмов также депонируются полисахариды (24).
Образовавшаяся в рубце биомасса микробиоты эвакуируется из преджелудков и под действием ферментов сычуга и кишечника утилизируется, освобождая белки, аминокислоты, жирные кислоты, углеводы и другие вещества, доступные для дальнейшего использования животным-хозяином (25).
Итак, ежесуточно в процессе рубцового пищеварения (на микробиальном этапе лизиса клетчатки) у крупного рогатого скота при участии микробиоты метаболизируется и усваивается до 10 кг органических веществ (из них ЛЖК — 4,5 кг, микробиального белка — 1,5 кг), в то время как в кишечнике — только 5 кг, то есть в 2 раза меньше. Не только растительный корм, но и сама масса микробиоты, образующаяся в рубце, представляет собой один из важнейших источников питательных веществ для жвачных животных. Только за счет микробиального рубцового этапа пищеварения удовлетворяется более половины потребности жвачного животного в обменной энергии. Эндоцеллюлярные везикулы с целлюлазами накапливаются в цитоплазме бактерий и посредством экзоцитоза мигрируют в зону гликокаликса с образованием экзоклеточных структур — целлюлосом. Электронно-цитохимический анализ наглядно показывает важную роль гликокаликса в транспорте целлюлозолитических ферментов от микроорганизмов к растительным субстратам в процессе рубцового пищеварения.
Л И Т Е Р А Т У Р А
- Ш е в е л е в Н.С., Г р у ш к и н А.Г. Морфофункциональные особенности слизистой оболочки рубца жвачных животных. С.-х. биол. 2003, 6: 15-22.
- Z i t n a n R., B o m b a A., K o l o d z i e y s k i L. e.a. Scanning electron microscopical studies into the development of rumen epithelium and adherent bacteria in suckling lambs. Folia Veter., 1994, 38(1/2): 51-56.
- J o u a n y J.P. Role de lecoysteme du rumen dans la digestion des aliments chez le ruminant. C.R. Acad. Agr. Fr., 1998, 84(1): 121-134.
- О р с к о в Э.Р. Протеиновое питание жвачных животных. М., 1985: 31-53.
- О р с к о в Э.Р., Р и л М. Энергетическое питание жвачных животных. Боровск, 2003: 17-35.
- П и в н я к И.Г., Т а р а к а н о в Б.В. Микробиология пищеварения жвачных. М., 1982: 40-122.
- Д о л г о в И.А., Д о л г о в а С.И. Микрофауна рубца и ее роль в питании жвачных. В кн.: Сельскохозяйственные животные: физиологические и биохимические параметры организма. Cправ. пос. /Под ред. В.Б. Решетова. Боровск, 2002: 335-347.
- Л ы с о в А.В. Транспорт метаболитов с кровью и лимфой и параметры липидного и углеводного обмена у животных. В кн.: Сельскохозяйственные животные: физиологические и биохимические параметры организма. Справ. пос. /Под ред. В.Б. Решетова. Боровск, 2002: 50-71.
- Т а р а к а н о в Б.В. Нормальная микрофлора преджелудков жвачных. В кн.: Сельскохозяйственные животные: физиологические и биохимические параметры организма. Справ. пос. /Под ред. В.Б. Решетова. Боровск, 2002: 259-334.
- К а л а ш н и к о в А.П. Кормление сельскохозяйственных животных. М., 1988: 37-39.
- Т а р а к а н о в Б.В., Д о л г о в И.А., Н и к о л и ч е в а Т.А. Изучение микрофлоры преджелудков у жвачных. Боровск, 1977: 83-84.
- К у р и л о в Н.В., С е в а с т ь я н о в а Н.А., К о р ш у н о в В.Н. и др. Изучение пищеварения жвачных. Боровск, 1987: 5-9.
- Г а й е р Г. Электронная гистохимия. М., 1974: 257-285.
- М и р о н о в А.А., К о м и с с а р ч и к Я.Ю., М и р о н о в В.А. Методы электронной микроскопии в биологии и медицине. СПб, 1994: 137-146.
- В е й с м а н И.Ш. Возможности, некоторые проблемы и перспективы применения криогенных методов в исследованиях тонкой структуры микроорганизмов. Тез. докл. конф. «Криогенные методы в электронной микроскопии». Пущино, 1985: 48-49.
- M c C o w a n R.P., C h e n g K.-J., C o s t e r t o n J.W. Adherent bacterial populations on the bovine rumen wall: distribution patterns of adherent bacteria. Appl. Environm. Microbiol., 1980, 1: 233-241.
- D e h o r i t y B.A., G r u b b J. Bacterial population adherent to the epithelium of the roof of the dorsal rumen in sheep. Environm. Microbiol., 1981, 41(6): 1424-1427.
- C h e n g K.-J., C o s t e r t o n J.W. Adherent rumen bacteria — their role in the digestion of plant material, urea and epithelial cells. In: Digestive physiology and metabolism in ruminants. Wesport. Conn., 1980: 227-250.
- Ш е в е л е в Н.С., Г р у ш к и н А.Г. Физиологическая роль микробиоты в рубцовом пищеварении. С.-х. биол., 2005, 6: 9-13.
- О т а в а А.М., С к о р о х и д В.И. Биологическая роль короткоцепочечных жирных кислот в организме жвачных животных. С.-х. биол., 1992, 2: 122-129.
- Е р ш о в Ф.И. Эра цитокинов, или язык клеток. Вест. РАЕН, 2002, 2(3): 24-26.
- W i l l i a m s J. Progres resent de la rechereche sur les acides gras essentials. Oleagineusc, 1980, 35(10): 457-459.
- Ш е в е л е в Н.С., М а р т ю ш о в В.М., Г р у ш к и н А.Г. Роль летучих жирных кислот в обмене веществ и энергии у жвачных животных. Изв. ТСХА, 2001, 2: 160-177.
- С а в ч е н к о Ю.И., М у с и е н к о Н.В. Рубцовый метаболизм и углеводно-жировой обмен у коров при скармливании различных углеводистых кормов. Вест. аграрн. науки, 1994, 4: 65-74.
- Г а л о ч к и н В.А., Г а з д а р о в В.М. Методы анализа пищеварительных ферментов. Боровск, 1987: 25-36.
ФГОУ ВПО Российский государственный аграрный
университет (РГАУ) — Московская сельскохозяйственная академия им. К.А. Тимирязева (МСХА),
127550 г. Москва, ул. Тимирязевская, 49;
Калужский филиал РГАУ-МСХА,
248007 г. Калуга, ул. Вишневского, 27,
e-mail: kfmsxa@kaluga.ru |
Поступила в редакцию 6 июня 2007 года
|
ABOUT MORPHOFUNCTIONAL FEATURES OF RUMEN MICROBIOTA IN RUMINANT ANIMALS AND THE ROLE OF CELLULOSELYTIC BACTERIA IN RUMINAL DIGESTION
A.G. Grushkin, N.S. Shevelev
S u m m a r y
The authors considered the role and the influence of mucous layers of glycocalyx and cellulosomes of rumen microorganisms in microbial fermentation of fodder of vegetative origin in proventriculus of ruminant animals and also the mechanism of formation and transport of cellulases. The original results of electron microscopy investigations of microbial fermentation and histochemical visualization of cellulases in ruminal content were presented.




