УДК 582.951.4:581.2:577.2
О ВИДОВОЙ ИДЕНТИФИКАЦИИ ВОЗБУДИТЕЛЕЙ
ФИТОПЛАЗМОЗОВ ПАСЛЕНОВЫХ КУЛЬТУР
Д.З. БОГОУТДИНОВ, Д. ВАЛЮНАС, М. НАВАЛИНСКЕНЕ, М. САМУЙТЕНЕ
С использованием полимеразной цепной реакции (PCR) и метода полиморфизма по длинам рестрикционных фрагментов (RFLP) проводили идентификацию возбудителей фитоплазмозов пасленовых культур и насекомых — возможных переносчиков заболеваний. В образцах зараженных растений-индикаторов (табак, перец, картофель) и тканях цикад (MacrosteleslaevisRib., EmpoascapteridisDhlb.), собранных в Ростовской области, а также растений картофеля с признаками круглолистности, кудряша, нитевидности ростков из Самарской и Ленинградской областей выявлены фитоплазмы, принадлежащие к группе возбудителей желтух астр (подгруппа B).
Ключевые слова: фитоплазмозы томатов и картофеля, столбур, желтуха астр, кустистость, нитевидность ростков, круглолистность, цикадки-переносчики, полимеразная цепная реакция, PCR, метод полиморфизма по длинам рестрикционных фрагментов, RFLP.
Key words: phytoplasma deseases of tomato and potato, stolbur, aster yellow, bunching, spindly sprouting, rounding of leafs, insect vector (Cicadellidae), PCR, RFLP.
В России в отдельные годы на пасленовых культурах отмечается высокая вредоносность фитоплазмозов типа желтух. Среди основных заболеваний этой группы индикаторным методом выделяют столбур, парастолбур, «ведьмину метлу», желтуху астр и пурпурность верхушки (1-4).
Столбур пасленовых относится к наиболее распространенным и вредоносным фитоплазмозам. У томата поражение растений вызывает различные деформации цветка: израстание чашелистиков в виде сросшегося колокольчика (или паруса) с редукцией венчика либо его полным отсутствием; превращение пестика в вегетативный побег, вследствие чего цветок оказывается стерильным. При проявлении заболевания после формирования завязи плоды становятся ребристыми, недоразвитыми, плотной консистенции, с немногочисленными щуплыми семенами, которые могут прорастать внутри плода. На растениях баклажана, перца и картофеля израстание чашелистиков наблюдается редко, цветки, как правило, остаются в фазе бутона и часто опадают. Отмечаются изменения вегетативных органов (измельчение, хлоротичность, антоцианирование, скручивание верхних листьев; образование в пазухах листьев многочисленных придаточных побегов), а также карликовость. При интенсивном развитии заболевания у растений картофеля, баклажана и перца может происходить увядание. Все многообразие симптомов разными авторами разделено на 2-7 типов (5-7).
На растениях картофеля, кроме столбура, распространены и другие фитоплазмозы: круглолистность, «ведьмина метла», кудряш, пурпурное закручивание верхушки. Следует отметить, что в потомстве пораженного фитоплазмой картофеля в зависимости от стадии и степени развития заболевания (вредоносности), особенностей сорта, климатических условий проявления заболевания могут быть нетипичными: от явного вырождения (карликовость), хлороза и скручивания листьев до слабо выраженных симптомов.
Анализ симптомов столбура на растениях томата, по нашему мнению, дает основание предположить, что это заболевание носит комплексный характер, который определяется, в том числе, наличием комплекса патогенов. С использованием молекулярно-генетических методов на растениях томата и других пасленовых культур с разными формами поражения зарубежными учеными выявлены фитоплазмы из групп возбудителей желтухи астр и столбура (8, 9); в России подобные исследования ранее не проводили.
В связи с этим целью нашей работы было определение видовой принадлежности ряда возбудителей фитоплазмозов пасленовых культур и некоторых цикад — возможных переносчиков этих заболеваний.
Методика. Объектами исследования служилицикады(MacrosteleslaevisRib.,EmpoascapteridisDhlb.), отловленные в посадках пасленовых культур (Ростовская обл.), а также замороженные ткани растений-индика-торов (Nicotianatabacum, Capsicumannuum, Solanumtuberosum после заражения изолятами возбудителя столбура томата из Ростовской обл.) и проростков клубней картофеля (отобранные в Самарской обл. образцы растений сортов Памир с признаками нитевидности ростков, Волжский — кустистости и нитевидности ростков, Кинельская роза — круглолистности, Волжанин — кустистости и нитевидности ростков, Рубин — кустистости и нитевидности ростков и в Ленинградской обл. — сорта Чародей с признаками кудряша).
ДНК для полимеразной цепной реакции (ПЦР) выделяли с помощью набора реактивов для очистки геномной ДНК в соответствии с регламентом (Kit MBI «Fermentas», Литва). Фитоплазменную рДНК амплифицировали методом «гнездовой» ПЦР (10) с использованием двух пар универсальных фитоплазменных праймеров: сначала проводили амплификацию с праймерами P1-P7 (11), затем продукты амплификации растворяли в стерильной воде (1:50) и применяли в качестве матрицы во второй реакции ПЦР с праймерами R16F2n-R16R2 (10). Каждую ПЦР выполняли в следующем режиме (35 циклов): денатурация — 1 мин при 94 °С (3 мин для первого цикла), отжиг — 2 мин при 55 °С, синтез ДНК — 3 мин при 72 °С (10 мин для последнего цикла).
Праймеры, использованные в работе:
Р1 |
5'-AAG AGT TTG ATC CTG GCT CAG GAT T-3' |
(11) |
P7 |
5'-CGT CCT TCA TCA TCG GCT CTT-3' |
(11) |
R16F2n |
5'-GAA ACG ACT GCT GCT AAG ACT GG-3' |
(8, 10) |
R16R2 |
5'-TGA CGG GCG GTG TGT ACA AAC CCC G-3' |
(8, 10) |
Реакционная смесь (объем 50 мл) содержала: PCR-буфер («Perkin Elmer», США) (8), 0,25 мМ dNTP, 0,4 мM каждого праймера и 1 ед. рекомбинантной Tag-полимеразы. Продукты амплификации анализировали электрофорезом в 1 % агарозном геле с окрашиванием бромистым этидием, фрагменты ДНК выявляли с помощью УФ-трансиллюминатора. Маркерами молекулярной массы служили ДНК-фрагменты 3000, 2000, 1500, 1200, 1031, 900, 800, 700, 600, 500, 400, 300, 200 и 100 п.н. (стандартный набор «GIBCO-BRL», США) (8).
При RFLP-анализе продукты ПЦР-амплификации, полученные при использовании праймеров R16F2n-R16R2, обрабатывали 9 эндонуклеазами — AluI, MseI, KpnI, HhaI, HpaII, HaeIII, RsaI, HinfI, TagI в соответствии с инструкцией производителя (Kit MBI «Fermentas», Литва) (8). Профили рестрикции ДНК анализировали электрофорезом в 5 % полиакриламидном геле (окрашивание бромистым этидием, визуализация с помощью УФ-трансиллюминатора). В качестве маркеров молекулярной массы применяли набор фрагментов рестрикции PhiX174 DNA Bsu/R1HaeIII («GIBCO-BRL», США) (1353, 1078, 872, 603, 310, 281, 271, 234, 194, 118, 72 п.н.). Полученные RFLP-профили сравнивали с приведенными ранее другими авторами (8, 9).
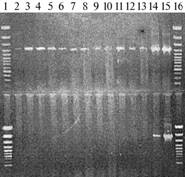
Результаты. При ПЦР-анализе общей ДНК, выделенной из насекомых-переносчиков и образцов тканей пасленовых растений, с использованием специфичных для фитоплазм пар праймеров (Р1-Р7и R16F2n-R16R2) оказалось, что продукты, характерные для ДНК фитоплазм (16SрДНК,размер фрагментов 1200 п.н.) были амплифицированы во всех изученных образцах (рис. 1). При сравнении RFLP-профилей, полученных после рестрикции амплифицированных фрагментов рДНК разными эндонуклеазами по методу I.-M. Lee с соавт. (8) (рис. 2, 3), с данными по идентификации фитоплазм, приведенными в ранее опубликованных работах (8, 9), подтвердилось, что все изученные нами образцы были инфицированы фитоплазмами, принадлежащими к группе 16SrI (возбудители желтухи астр) (подгруппа 16SrI-B) (8, 9).
|
Рис. 1. Электрофоретическое разделение в 1 % агарозном геле продуктов ПЦР-амплификации ДНК, выделенной из образцов тканей насекомых-переносчиков и тестируемых растений. Вверху и внизу — соответственно использование пар праймеров R16F2n-R16R2 и Р1-Р7; 1, 16 — стандарт Gene Ruler 311 (1000 п.н.), 2 и 3 — соответственно цикады Empoasca pteridis и Macrosteles laevis, 4, 5 и 6 — соответственно картофель сорта Луговской, перец сорта Гогошар и табак сорта Самсун (привиты изолятом возбудителя столбура томата из Ростовской обл.), 7 — картофель сорта Волжский (растения с симптомами куcтистости, Самарская обл.), 8 — картофель сорта Памир (нитевидность ростков), 9 — картофель сорта Волжанин (кустистость, Самарская обл.), 10 — картофель сорта Волжанин (нитевидность ростков, Самарская обл.), 11 — картофель сорта Кинельская роза (круглолистность, Самарская обл.), 12 — картофель сорта Чародей (кустистость, Ленинградская обл.), 13 — картофель сорта Рубин (кудряш и нитевидность ростков, Самарская обл.), 14, 15 — положительный контроль. |
|
Рис. 2. Фрагменты рестрикции 16S рДНК фитоплазм, выделенной из цикад Empoasca pteridis (2-10) и Macrosteleslaevis (13-22): 1, 11, 12, 23 — стандарт PhiX174 DNA Bsu/R1HaeIII; 2, 14 — AluI; 3, 15 — MseI; 4, 16 — KpnI; 5, 17 — HhaI; 6, 18 — HaeIII; 7, 19 — HpaII; 8, 20 — RsaI; 9, 21 — HinfI; 10, 22 — TagI. |
|
Таким образом, в европейской части России на пасленовых культурах циркулируют достаточно однородные популяции фитоплазм, принадлежащих к группе возбудителей желтух астр. Использование методов молекулярно-генетической идентификации фитоплазм позволило уточнить видовую принадлежность возбудителей фитоплазмозов пасленовых, а также выявить нового переносчика столбура пасленовых — цикаду Empoascapteridis и подтвердить векторную роль цикады Macrosteleslaevis, ранее считавшейся возможным переносчиком этого заболевания в России. Следует отметить, что мы анализировали единичные образцы и в последующих работах при увеличении объема выборки могут быть обнаружены фитоплазмы других групп. Полученные результаты углубляют и расширяют представления о возможной специализации возбудителей фитоплазменных заболеваний растений семейства пасленовых, что в значительной мере упрощает выбор мероприятий по их контролю.
ГНУ Всероссийский НИИ защиты растений, |
Поступила в редакцию |
ABOUT SPECIFIC IDENTIFICATION OF PATHOGENS OF PHYTOPLASMOSIS IN Solanaceae CROPS
D.Z. Bogoutdinov, D. Valyunas, M. Navalinskene, M. Samuitene
S u m m a r y
The authors have made the identification of the pathogens of phytoplasmosis in Solanaceae crops and insects — possible carrier of disease — by PCR and RFLP techniques. In samples of infected plants-indicators (tomato, pepper, potato) and cicada’s tissues (Macrosteles laevis Rib., Empoasca pteridis Dhlb.) discovered in Rostovskaya oblast’, and also potato plants with signs of round-leaves, curliness from Samarskaya and Leningradskaya oblast’ the phytoplasmas were revealed which belong to group pathogens of aster jau