doi: 10.15389/agrobiology.2019.6.1135rus
УДК 636.52/.58:636.018
Работа проведена по теме государственного задания АААА-А18-118021590129-9.
СРАВНИТЕЛЬНАЯ ОЦЕНКА СТРЕСС-РЕАКТИВНОСТИ ОРГАНИЗМА КУР ПОРОД РУССКАЯ БЕЛАЯ С МУТАЦИЕЙ SW+ И АМРОКС НА ГИПОТЕРМИЮ В ЭМБРИОНАЛЬНОМ И РАННЕМ ПОСТНАТАЛЬНОМ ПЕРИОДАХ ОНТОГЕНЕЗА
О.И. СТАНИШЕВСКАЯ, Е.С. ФЕДОРОВА
Способность птицы адаптироваться и сохранять продуктивность в широком диапазоне температур — важный экономически значимый признак, поскольку поддержание температурного оптимума для реализации генетического потенциала продуктивности требует увеличения энергозатратности технологий содержания. Во Всероссийском НИИ генетики и разведения сельскохозяйственных животных (ВНИИГРЖ) посредством отбора на устойчивость к пониженным температурам в первые дни жизни и содержанию взрослых кур зимой при температуре ниже 0 °С создана популяция кур русской белой породы, в которой в результате селекции появились генотипы с терморезистентностью, повышенной устойчивостью к болезням лейкозно-саркомного комплекса и белым эмбриональным пухом («белоснежки»). В настоящей работе впервые показаны межпородные различия в процессах эпигенетической адаптации у кур в раннем онтогенезе. Целью работы была оценка степени адаптивной реакции эмбрионов и неонатальных цыплят русской белой породы на пониженную температуру окружающей среды в сравнении с породой амрокс. Исследования проводили в 2018 году на эмбрионах (n = 35) и неонатальных цыплятах (n = 30) русской белой породы кур (Gallus gallus domesticus), гомозиготных по гену sw+, и породы амрокс (соответственноn = 35 и n = 30). Яйца получали от кур в возрасте 49 нед и инкубировали в лабораторных условиях. В опыте яйца с 5,5-суточными эмбрионами охлаждали до 20 °С в течение 6 ч, в контроле — инкубировали при общепринятом режиме на протяжении всего срока. Объем экстраэмбриональной жидкости (аллантоисной и амниотической) в возрасте 12,5 сут оценивали с помощью мерного цилиндра. У неонатальных цыплят из контрольной группы измеряли наружную и ректальную температуру тела сразу при выемке из инкубатора. Затем цыплят размещали в индивидуальные ячейки выводных лотков. Опытная I группа (n = 10) находилась 2 ч при 24 °С, опытная II группа (n = 10) — 1 ч при 16 °С. У молодняка обеих групп измеряли наружную и ректальную температуру тела, а затем помещали в общий лоток и оценивали поведенческие реакции в условиях комнатной температуры 24 °С. Контрольную группу (n = 10) содержали при оптимальной для цыплят этого возраста температуре 30-32 °С. Были выявлены межпородные различия в реакции на пониженные температуры у эмбрионов и 1-суточных цыплят. Охлаждение инкубируемых яиц вызвало незначительное ожидаемое снижение массы эмбрионов в обеих породах, но привело к увеличению объема аллантоисно-амниотической жидкости у «белоснежек» на 8,2 %, у амроксов — на 6,7 %. Установлено, что неонатальные цыплята «белоснежки», которых выдерживали в течение 2 ч при 16 °С, менее интенсивно теряли тепло тела (32,4-17,0 °С), чем амроксы (28,2-14,5 °С). Ректальная температура у «белоснежек» сохранялась без критического изменения: у амроксов она снижалась по сравнению с той, что была при выемке из инкубатора, на 5,1 °С (p < 0,001), у «белоснежек» — на 1,4 °С. Цыплята «белоснежки» были подвижны, тогда как амроксы впадали в оцепенение. Таким образом, цыплята русской белой породы, гомозиготные по гену sw+, наряду с белоснежной окраской пуха в 1-суточном возрасте, обладают более совершенными механизмами терморегуляции (преимущественно физическими, а не химическими) и лучше адаптированы к условиям пониженных температур в эмбриональный и ранний постнатальный периоды.
Ключевые слова: Gallus gallus domesticus, куры, терморегуляция, эмбрионы, экстраэмбриональная жидкость, ген sw+, неонатальные цыплята, гипотермический стресс.
Современные программы сохранения генетических ресурсов сельскохозяйственной птицы предполагают изучение специфических признаков пород для дальнейшего использования в селекционных целях. Способность адаптироваться и сохранять продуктивность в широком диапазоне температур — важный экономически значимый признак, поскольку поддержание температурного оптимума для реализации генетического потенциала продуктивности требует значительных энергетических затрат. При решении проблемы терморезистентности птицы рассматривают два подхода — основанный на изучении эпигенетической адаптации (в том числе за счет дозированного температурного воздействия в чувствительные периоды эмбриогенеза) (1-3) и селекционно-генетический. Доказана возможность селекции на устойчивость к экстремальным температурам содержания (4-6). Гены-кандидаты, ассоциированные с терморезистентностью, идентифицируют у птицы как генофондных пород, так и промышленных линий (7, 8).
Вопросам терморезистентности кур во всем мире посвящено большое число исследований. Однако их подавляющее число касается устойчивости птицы к условиям тропического и субтропического климата (2, 6), тогда как для значительной части России более актуальна проблема адаптации к пониженным температурам.
В этой связи представляет интерес уникальный многолетний эксперимент на популяции кур русской белой породы, начатый А.Н. Соколовой в 1954 году (Всероссийский НИИ генетики и разведения сельскохозяйственных животных — ВНИИГРЖ). Русская белая порода кур выведена в СССР на основе скрещивания породы белый леггорн с местными беспородными курами и утверждена в 1953 году. Популяция русских белых кур, разводимая в Генетической коллекции редких и исчезающих пород кур ВНИИГРЖ, создана посредством отбора на устойчивость к пониженным температурам в первые дни жизни (15-22 °С в первые 5 сут с постепенным снижением до 14-11 °С к 21-30-суточному возрасту) с содержанием взрослых особей зимой при температуре ниже 0 °С (4, 5). А.Н. Соколова (4, 5) обнаружила неодинаковую реакцию 1-суточных цыплят русской белой породы на снижение температуры среды. При 30 °С температура тела всех неонатальных цыплят равнялась 39,6-40,0 °С. В условиях снижения температуры до 21 °С у одних особей наступало состояние гипотермии, что приводило к переохлаждению и гибели, у других температура оставалась прежней или снижалась незначительно (до 37-38 °С), и они сохраняли нормальную жизнеспособность. Также было установлено, что повышенная терморезистентность наследуется по доминантному типу, а термоустойчивость имеет моногенное наследование. В поколениях селекции на терморезистентность снижалась роль химической терморегуляции, но возрастала роль физической, направленной на уменьшение теплоотдачи, в частности за счет уменьшения относительной массы легких. Как результат селекции в условиях гипотермического стресса, появились генотипы, которые отличались от исходной птицы не только терморезистентностью молодняка, но и повышенной устойчивостью к болезни Марека, лейкозу (подтверждено при экспериментальном заражении), а также белым эмбриональным пухом (так называемые «белоснежки»), доля которых составляла примерно 25 % от общего числа цыплят на выводе (4, 5). Остальные цыплята имели преимущественно обычный желтый пух, за исключением небольшого количества особей с промежуточным типом окраски. Вероятно, отбор неонатальных цыплят по степени реактивности на такой стрессирующий фактор, как сублетальная пониженная температура, повлиял на механизм нейроэндокринной регуляции меланогенеза, который контролируется гормонами гипофиза, щитовидной железы, стероидными и половыми (9), в результате чего возникла мутация в окраске пуха цыплят.
Наше предположение о влиянии нейроэндокринного статуса на окраску оперения у кур подтверждается исследованиями В.Б. Дмитриева (10, 11). Так, при оценке 10-недельных цыплят из популяции русская белая, имевших белоснежную окраску пуха в 1-суточном возрасте, по степени функциональных резервов надпочечников (ФРН), выявляемых с помощью введения адренокортикотропного гормона (АКТГ), было установлено, что средняя концентрация кортикостерона в крови «белоснежек» в ответ на введение АКТГ составила 82,6 нг/мл. В том же эксперименте оценивали 10-недельных цыплят из популяции аврора голубая, полученной отбором черно-пестрых австралорпов с высоким показателем ФРН (такой отбор привел к появлению особей с голубой окраской оперения). Средняя концентрация кортикостерона в крови у цыплят популяции аврора голубая составила 84,8 нг/мл. У других пород коллекции она была значительно ниже (24,0-52,3 нг/мл). Известно, что усиление окислительных процессов, связанное с повышенной функцией щитовидной железы, вызывает разложение меланина (в частности, в результате этого возникает белая окраска арктических животных) (12).
В настоящее время селекция на устойчивость к пониженным температурам не проводится, но в результате отбора по белоснежной окраске пуха создана популяция русских белых кур, гомозиготная по гену sw+ (snow white down). С нашей точки зрения, эта экспериментальная популяция представляет значительный интерес как модель для изучения генетических и физиологических механизмов, обусловливающих процессы терморегуляции у кур в эмбриональном и раннем постнатальном периодах онтогенеза. Влияние холодового стресса на морфофизиологические параметры эмбрионов во второй половине периода инкубации, в том числе с точки зрения эпигенетической адаптации, изучалось еще в 1950-1960-х годах (13, 14), но без учета породных особенностей эмбрионов.
В представленной работе впервые показаны межпородные различия в процессах эпигенетической адаптации у кур в раннем онтогенезе.
Нашей целью было изучение степени адаптивной реакции на пониженную температуру окружающей среды у эмбрионов и неонатальных цыплят русской белой породы, гомозиготных по гену sw+, в сравнении с породой амрокс.
Методика. Исследования проводили в 2018 году на эмбрионах (n = 35) и неонатальных цыплятах (n = 30) русской белой породы кур (Gallus gallus domesticus), гомозиготных по гену sw+, и породы амрокс (соответственноn = 35 и n = 30), разводимых в Генетической коллекции редких и исчезающих пород кур (ВНИИГРЖ). Куры обеих пород содержались в индивидуальных клетках с индивидуальным учетом яйценоскости.
Яйца получали от кур в возрасте 49 нед. Яйца, а также эмбрионы и цыплят взвешивали на электронных весах HL-400 EX («A&D Company Ltd.», Япония). Диаметр желтка определяли без нарушения целостности скорлупы с помощью ультразвукового переносного сканера Раскан (НПП «Ратекс», Россия) (15). Яйца инкубировали в лабораторных условиях при принятом температурном режиме для кур генофондного стада (1-2-е сут — 38,0 °С, 3-10-е сут — 37,8 °С, 17-21-е сут — 37,2 °С) в инкубаторе и выводном шкафу Рэмил-Ц (НПП «Рэмил», Россия).
В опыте яйца с 5,5-суточными эмбрионами охлаждали до 20 °С в течение 6 ч, в контроле — продолжали инкубировать при общепринятом режиме. Объем экстраэмбриональной жидкости (аллантоисной и амниотической) определяли в возрасте 12,5 сут, когда он достигал максимального значения (15), используя мерный цилиндр; результат учитывали в абсолютных значениях и как выход относительно массы яйца (объем/масса).
У неонатальных цыплят из контрольной группы измеряли наружную и ректальную температуру тела сразу при выемке из инкубатора. Температуру тела в области головы и лап определяли с помощью тепловизора Thermal Expert FL 13mm f/1.0 («Thermal Expert», Южная Корея), ректальную — электронным термометром Microlife MT 3001 («Microlife», Китай).
Во избежание нежелательных поведенческих реакций в ответ на понижение температуры воздуха (скучивание), 1-суточных цыплят размещали в индивидуальные ячейки выводных лотков. Опытная I группа (n = 10) находилась 2 ч при 24 °С, опытная II группа (n = 10) — 1 ч при 16 °С. У молодняка обеих групп измеряли наружную и ректальную температуру тела, а затем помещали в общий лоток и оценивали поведенческие реакции в условиях комнатной температуры (24 °С). Контрольную птицу (n = 10) содержали при оптимальной для цыплят этого возраста температуре 30-32 °С.
Статистическую обработку результатов осуществляли в программе Microsoft Excel. Определяли средние значения по группам (М) и стандартную ошибку средних (±SEM). Достоверность различий оценивали по t-критерию Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Кур породы амрокс использовали для сравнения с учетом того, что их продуктивность наиболее близкая к таковой у русских белых кур — 17,0±0,7 яйца за месяц, предшествующий проведению опыта, с массой 60,0±0,5 г (у русской белой соответственно 21,0±0,5 яйца за месяц и 59,6±0,3 г). Кроме того, амроксы не подвергались селекции на резистентность к пониженным температурам окружающей среды. Возраст 5,5 сут был выбран для охлаждения, поскольку мы установили, что именно в этот период (до начала функционирования нейроэндокринной системы) резистентность эмбрионов к холодовому стрессу особенно высока (данные не представлены).
Были выявлены межпородные различия в степени реакции эмбрионов на холодовой стресс по сравнению с общепринятым режимом инкубации (табл. 1). Поскольку объем экстраэмбриональной жидкости в значительной степени зависит от массы яйца, представлены его абсолютные и относительные значения.
Охлаждение вызвало незначительное снижение массы эмбрионов обеих пород, но привело к увеличению объема аллантоисно-амниотиче-ской жидкости: у «белоснежек» — на 8,2 %, у амроксов — на 6,7 %. Само по себе повышение объема жидкости согласуется с результатами исследований А.L. Romаnoff (14), который установил, что понижение температуры инкубации вызывает увеличение размера амниона. Вероятно, так реализуется его защитная функция.
Межпородные различия представляют, с нашей точки зрения, больший интерес, поскольку на этой стадии развития выявлены впервые и свидетельствуют об особенностях реакции эмбрионов «белоснежки» на температурный стресс. Этот феномен может быть объяснен, с одной стороны, результатом многолетней селекции популяции на адаптацию к условиям холодового стресса, с другой — известными различиями в термотолерантности взрослых кур разных пород. По данным литературы, леггорны лучше адаптируются к тепловому стрессу по сравнению с другими породами, а русская белая создана с использованием леггорнов (14).
Теоретическими предпосылками для проведения исследований на неонатальных цыплятах послужили данные о том, что они считаются пойкилотермными и лишь в старшем возрасте в ответ на воздействие пониженных температур реагируют повышением содержания кортикостероидов в крови (16-18). Цыплята в возрасте 1 сут на это не способны по причине несовершенного механизма терморегуляции (19-21).
Известно, что в условиях пониженных температур у неонатальных цыплят включаются компенсаторные реакции организма, в первую очередь поведенческие: молодняк нахохливается, скучивается, пытаясь согреться. Появляется мышечная дрожь, при мышечном сокращении выделяется дополнительное тепло для обогрева организма (22-24). Если действие пониженных температур сохраняется, температура тела снижается на 3-4 °С и более, цыплята падают на бок, у них развивается коматозное состояние, а затем наступает гибель. В наших исследованиях были обнаружены межпородные различия в реакции цыплят на гипотермический стресс.
При выемке из инкубатора статистически достоверных межпородных различий по живой массе и температуре тела у цыплят почти не наблюдалось (табл. 2). Молодняк «белоснежек» в сравнении с цыплятами амрокс имел более низкую ректальную температуру (на 2,4 °С) и более высокую — в области головы (на 0,9 °С). При выдержке неонатальных цыплят в течение 2 ч при температуре 24 °С терморегуляционные различия становились заметны: у «белоснежек» происходило лишь незначительное снижение температуры конечностей при сохранении значений остальных показателей, в то время как цыплята амрокс более интенсивно теряли тепло через лапы, их ректальная температура также снижалась на 1,6 °С (p < 0,05). В попытках поддержать температуру тела цыплята скучивались в углу лотка, в то время как молодняк русской белой породы был активен и чувствовал себя комфортно.
После 1 ч при 16 °С различия оказались еще более значимыми (рис. 1). Потери тепла у амроксов становились критическими: ректальная температура снижалась на 12,7 % (или на 5,1 °С) (p < 0,001) по сравнению с измеренной на моментом выемки из инкубатора, в то время как у «белоснежек» — лишь на 3,7 % (на 1,4 °С); теплопотери в области головы и ног у амроксов также были значительно выше.
После 2 ч при 16 °С у цыплят амрокс наблюдались мышечная дрожь и сонливость, к концу периода молодняк впадал в состояние оцепенения. Цыплята русской белой породы реагировали на охлаждение мышечной дрожью, но в целом были подвижны и активны (рис. 2).
Амроксы при низкой температуре более интенсивно теряли тепло всей поверхностью тела (диапазон температур 28,2-14,5 °С) в сравнении с «белоснежками», у которых наблюдалась более низкая теплоотдача (32,4-17,0 °С), а участки интенсивного теплообмена имели ограниченную локализацию (рис. 3). Вероятно, это тоже является адаптационной особенностью цыплят русской белой породы.
Согласно данным литературы, при пониженных температурах (20 °С в течение 12 ч) повышается абсорбция желточного мешка и в крови у неонатальных цыплят увеличивается количество жирных кислот (25). Неонатальные цыплята считаются пойкилотермными, способность поддерживать температуру тела появляется лишь в 4-суточном возрасте (например, 6-суточные цыплята способны перенести воздействие температуры 4 °С в течение 24 ч), полностью гомойотермными они становятся к 10-суточному возрасту (26). У цыплят с 4-суточного возраста повышается содержание кортикостероидов в плазме крови в ответ на воздействие пониженных температур. У 1-суточных цыплят этого не происходит (26). В 1-суточном возрасте реакцией на пониженную температуру также становится усиление процессов липолиза, что сопровождается повышением содержания свободных жирных кислот в крови (27-29).
Аналогичные результаты были получены в наших исследованиях на плимутроках линии Б2 отечественного кросса Барос 123 при выращивании опытной группы цыплят до 6-суточного возраста при 24 °С. В сравнении с контролем у цыплят из опытной группы наблюдалось статистически достоверное снижение содержания триглицеридов в крови (на 38 %) и протеина в сухом веществе грудной мышцы (на 5 %) при одинаковом количестве сухого вещества (30, 31). Однако очевидно, что цыплятам амрокс, имевшим стартовое преимущество в виде более крупного желтка в яйце (см. табл. 1), не удалось компенсировать теплопотери за счет этого механизма.
Таким образом, цыплята русской белой породы, гомозиготные по гену sw+, наряду с белоснежной окраской пуха в 1-суточном возрасте, обладают более совершенными механизмами терморегуляции (преимущественно физическими, а не химическими) и лучше адаптированы к условиям пониженных температур в эмбриональный и ранний постнатальный периоды. Эта особенность может быть использована при дальнейшей селекционной работе с линией, а также при создании гибридной птицы с повышенными адаптационными способностями в условиях гипотермического стресса.
1. Масса, усушка яиц, развитие эмбрионов и выход экстраэмбриональной жидкости у кур (Gallus gallus domesticus) пород русская белая «белоснежка», гомозиготных по гену sw+, и амрокс в зависимости от режима инкубации (M±SEM) |
|||||
Порода |
Масса яйца, г |
Усушка, % |
Эмбрион, г |
Жидкость |
|
мл |
мл/г |
||||
Русская белая «белоснежка» (n = 35): |
|
|
|
|
|
контроль |
58,9±0,70 |
6,9±0,10 |
8,9±0,10 |
12,2±0,20 |
0,207±0,0030a |
опыт (охлаждение) |
58,9±0,60 |
6,6±0,20 |
8,1±0,10 |
13,2±0,40 |
0,224±0,0040с |
Амрокс (n = 35): |
|
|
|
|
|
контроль |
60,6±0,70 |
6,1±0,20 |
8,8±0,10 |
11,8±0,20 |
0,194±0,0020b |
опыт (охлаждение) |
60,7±0,70 |
6,0±0,20 |
8,4±0,10 |
12,6±0,30 |
0,207±0,0030d |
Примечание. Описание групп (контроль и опыт) см. в разделе «Методика». Выход экстраэмбриональной жидкости и развитие оценивали у 12,5-суточных эмбрионов. |
|||||
2. Реакция на температурный стресс у неонатальных цыплят (Gallus gallus domesticus) пород русская белая «белоснежка», гомозиготных по гену sw+, и амрокс с учетом породных различий по качеству яиц (M±SEM) |
||
Показатель |
Порода |
|
русская белая «белоснежка» (n = 10) |
амрокс (n = 10) |
|
Живая масса, г |
37,8±1,2 |
39,4±1,0 |
При выемке из инкубатора, 37,2 °С |
||
Температура, °С: |
|
|
головы |
39,2±0,05a |
38,3±0,06d |
ног |
38,5±0,12 |
38,4±0,17 |
ректальная |
37,7±1,2 |
40,1±0,69 |
1-суточные цыплята через 2 ч при 24 °С (I группа) |
||
Температура, °С: |
|
|
головы |
38,7±0,36 |
38,9±0,25 |
ног |
34,2±0,38a |
32,5±0,31с |
ректальная |
37,3±0,42a |
38,5±0,13b |
Поведенческие реакции |
Активно перемещаются, ищут корм |
Скучиваются в углу лотка, прижимаясь друг к другу |
1-суточные цыплята через 1 ч при 16 °С (II группа) |
||
Температура, °С |
|
|
головы |
33,1±0,32a |
30,7±0,50d |
ног |
21,9±0,24a |
19,1±0,83с |
ректальная |
36,3±0,42a |
35,0±0,39b |
Поведенческие реакции |
Активны, несмотря на мышечную дрожь, глаза открыты, бегают, ищут корм, пытаются вылезти из лотка |
Оцепенение, мышечная дрожь, глаза закрыты, цыплята заваливаются на бок |
Качественные характеристики яиц (по 30 шт. от каждой породы) |
||
Масса яйца, г |
54,7±0,80 |
57,6±0,50 |
Диаметр желтка, см |
2,88±0,010a |
2,95±0,020с |
ab, ac, ad Различия статистически значимы соответственно при p < 0,05; p < 0,01; p < 0,001. |
||
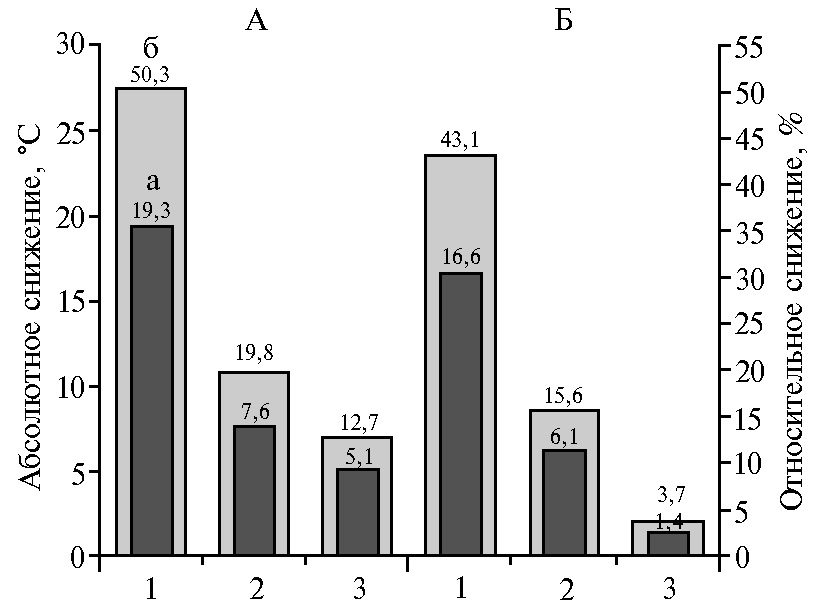
Рис. 1. Абсолютное (а) и относительное (б) снижение температуры у неонатальных цыплят (Gallus gallus domesticus) пород амрокс (А) и русская белая «белоснежка», гомозиготных по гену sw+ (Б), при их выдержке в течение 1 ч при 16 °С: 1 — ноги, 2 — голова, 3 — ректальная температура.

Рис. 2. Поведенческие реакции неонатальных цыплят (Gallus gallus domesticus) пород русская белая «белоснежка», гомозиготных по гену sw+ (слева), и амрокс (справа) после выдержки в течение 2 ч при 16 °С.
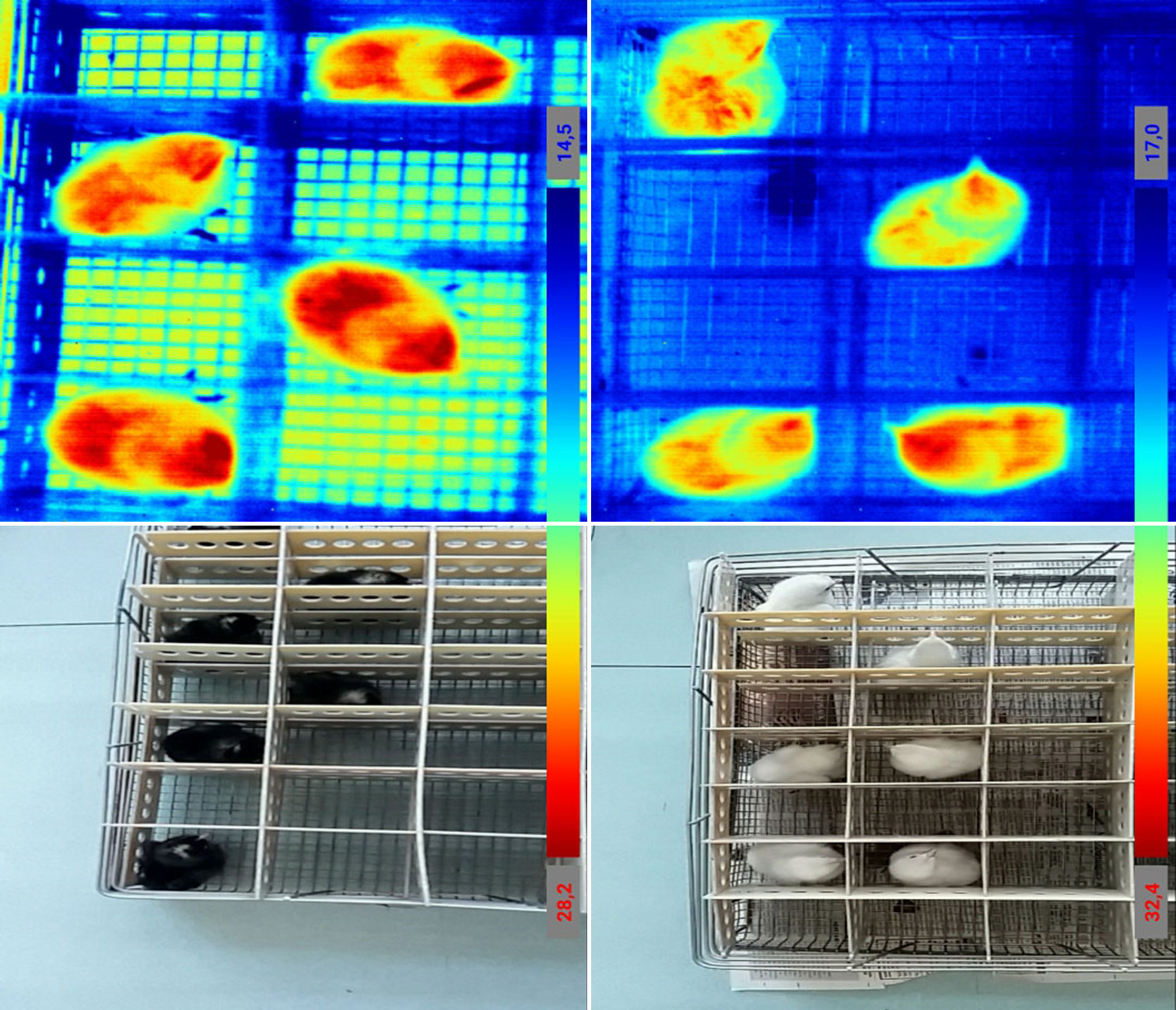
Рис. 3. Интенсивность теплоотдачи у неонатальных цыплят (Gallus gallus domesticus) пород русская белая «белоснежка», гомозиготных по гену sw+ (справа; диапазон температур тела 32,4-17,0 °С), и амрокс (слева; 28,2-14,5 °С) после 1 ч при 16 °С.
ЛИТЕРАТУРА
- Mortola J.P. Metabolic response to cooling temperatures in chicken embryos and hatchlings after cold incubation. Comparative Biochemistry and Physiology, Part A, Molecular & Integrative Physiology, 2006, 145(4): 441-448 (doi: 10.1016/j.cbpa.2006.07.020).
- Забудский Ю.И., Голикова А.П., Федосеева Н.А. Повышение термотолерантности сельскохозяйственной птицы с помощью теплового тренинга в пренатальный период онтогенеза (обзор). Сельскохозяйственная биология, 2012, 4: 14-21.
- Black J.L., Burggren W.W. Acclimation to hypothermic incubation in developing chicken embryos (Gallus domesticus). Journal of Experimental Biology, 2004, 207: 1543-1552 (doi: 10.1242jeb.00909).
- Соколова А.Н. Генетико-селекционные методы создания популяции кур с повышенной устойчивостью к неоплазмам. Автореф. канд. дис. СПб, 1999.
- Соколова А.Н. Селекция кур по функции терморегуляции и продуктивности. Мат. XIII Всемирного конгресса по птицеводству. Киев, 1966: 151-155.
- Фисинин В.И., Кавтарашвили А.Ш. Тепловой стресс у птицы. Сообщение II. Методы и способы профилактики и смягчения (обзор). Сельскохозяйственная биология, 2015, 50(4): 37-49 (doi: 10.15389/agrobiology.2015.4.431rus).
- Nadaf J., Pitel F., Gilbert H., Duclos M.J, Vignoles F., Beaumont C., Vignal A., Porter T.E., Cogburn L.A., Aggrey S.E., Simon J., Le Bihan-Duval E. QTL for several metabolic traits map to loci controlling growth and body composition in an F2 intercross between high- and low-growth chicken lines. Physiological Genomics, 2009, 38(3): 241-249 (doi: 10.1152/physiolgenomics.90384.2008).
- Pinard-van der Laan M.H., Bed’hom B., Coville J.L., Pitel F., Feve K., Leroux S., Legros H., Thomas A., Gourichon D., Repérant J.M., Rault P. Microsatellite mapping of QTLs affecting resistance to coccidiosis (Eimeria tenella) in a Fayoumi ´ White Leghorn cross. BMC Genomics, 2009, 10: 31 (doi: 10.1186/1471-2164-10-31).
- Косимов Р.Б. Биохимические особенности ингибирования меланогенеза шерсти у овец. Докт. дис. Душанбе, 2009.
- Lu L., Dmitriev V.B., Stanishevskaya O.I., Dementyeva N.V., Turlova Yu.G., Lapa M.A. Destabilizing effect of selection in chicken: factors of variability. Proc. XXV World Poultry Conference. Beijing, 2016: 345.
- Дмитриев В.Б. Функциональные эндокринные резервы в селекции сельскохозяйственных животных. СПб, 2009.
- Дементьев Г.П. Исследования по окраске позвоночных животных. Зоологический журнал, 1948, 23(5): 189-197.
- Рольник В.В. Биология эмбрионального развития птиц. Л., 1968.
- Romanoff A.L. Membrane growth and function. Annals of the New York Academy of Science, 1952, 55: 2-288.
- Лапа М.А. Критерии оценки и отбора птицы с целью повышения пищевых и биотехнологических качеств яиц. Канд. дис. СПб, 2015.
- Freake H.C., Oppenheimer J.H. Thermogenesis and thyroid function. Annual Review of Nutrition, 1995, 15: 263-291 (doi: 10.1146/annurev.nu.15.070195.001403).
- Tachibana T., Takahashi H., Oikawa D., Denbow D.M., Furuse M. Thyrotropin-releasing hormone increased heat production without the involvement of corticotropin-releasing factor in neonatal chicks. Pharmacology Biochemistry and Behavior, 2006, 83(4): 528-532 (doi: 10.1016/j.pbb.2006.03.012).
- Decuypere E., Iqbal A., Michels H., Kühn E.R., Schneider R., Abd el Azeem A. Thyroid hormone response to thyrotropin releasing hormone after cold treatment during pre- and postnatal development in the domestic fowl. Hormone and Metabolic Research, 1988, 20: 484-489.
- Arancibia S., Rage F., Astier H., Tapia-Arancibia L. Neuroendocrine and autonomous mechanisms underlying thermoregulation in cold environment. Neuroendocrinology, 1996, 64(4): 257-267 (doi: 10.1159/000127126).
- Debonne M., Baarendse P.J.J., Van Den Brand H., Kemp B., Bruggeman V., Decuypere E. Involvement of the hypothalamic pituitary-thyroid axis and its interaction with the hypothalamic-pituitary-adrenal axis in the ontogeny of avian thermoregulation: a review. World's Poultry Science Journal, 2008, 64(3): 309-321 (doi: 10.1017/S0043933908000056).
- Laurberg P., Andersen S., Karmisholt J. Cold adaptation and thyroid hormone metabolism. Hormone and Metabolic Research, 2005, 37(9): 545-549 (doi: 10.1055/s-2005-870420).
- DiMicco J.A., Zaretsky D.V. Physiology and Pharmacology of Temperature Regulation. The dorsomedial hypothalamus: a new player in thermoregulation. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, 2007, 292(1): 47-63 (doi: 10.1152/ajpregu.00498.2006).
- Mujahid A., Furuse M. Behavioral responses of neonatal chicks exposed to low environmental temperature. Poultry Science, 2009, 88(5): 917-922 (doi: 10.3382/ps.2008-00472).
- Wentworth B., Cigan J., Schaaf T. Tolerance of Japanese quail embryos and young chicks to hypothermia. Poultry Science, 2009, 88(5): 1040-1043 (doi: 10.3382/ps.2008-00195).
- Mujahid A., Furuse M. Oxidative damage in different tissues of neonatal chicks exposed to low environmental temperature. Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2009, 152(4): 604-608 (doi: 10.1016/j.cbpa.2009.01.011).
- Mujahid A. Acute cold-induced thermogenesis in neonatal chicks (Gallus gallus). Comparative Biochemistry and Physiology Part A: Molecular and Integrative Physiology, 2010, 156(1): 34-41 (doi: 10.1016/j.cbpa.2009.12.004).
- Mujahid A., Furuse M. Homeothermy in neonatal chicks exposed to low environmental temperature with or without intracerebroventricular administration of corticotropin-releasing factor. FEBS Letters, 2008, 582(20): 3052-3060 (doi: 10.1016/j.febslet.2008.07.050).
- Takahashi H., Iigo M., Ando K., Tachibana T., Denbow D.M., Furuse M. Regulation of body temperature by thyrotropin-releasing hormone in neonatal chicks. Developmental Brain Research, 2005, 157(1): 58-64 (doi: 10.1016/j.devbrainres.2005.03.004).
- Hirabayashi M., Ijiri D., Kamei Y., Tajima A., Kanai Y. Transformation of skeletal muscle from fast- to slow-twitch during acquisition of cold tolerance in the chick. Endocrinology, 2005, 146(1): 399-405 (doi: 10.1210/en.2004-0723).
- Станишевская О.И., Торицина Е.С. Своевременный доступ неонатальных цыплят к корму и воде. Птицеводство, 2005, 1: 15-17.
- Торицина Е.С. Биологическая роль желтка яиц в повышении генетического потенциала кур по хозяйственно-полезным признакам. Автореф. канд. дис. СПб, 2005.