doi: 10.15389/agrobiology.2019.6.1206rus
УДК 636.2:591.39
Работа выполнена при финансовой поддержке РФФИ (проект 17-29-08035) и Министерства науки и высшего образования РФ.
ДОЗРЕВАНИЕ ООЦИТОВ КОРОВ В СРЕДЕ FERT-TALP ПОВЫШАЕТ ИХ КАЧЕСТВО И КОМПЕТЕНТНОСТЬ К РАЗВИТИЮ in vitro
Г.Н. СИНГИНА, Е.Н. ШЕДОВА
Экстракорпоральное созревание (in vitro maturation, IVM) — важный этап получения эмбрионов in vitro (in vitro embryo production, IVP). Условия среды, окружающей ооциты вне организма, критически влияют на качество яйцеклеток, что делает эти условия объектом направленного воздействия. Чаще всего для IVM ооцитов коров используется однофазное культивирование в среде ТС-199, дополненной фетальной бычьей сывороткой (ФБС) и гонадотропными гормонами. Дифференцированное созревание, учитывающее асинхронность между ядерными и цитоплазматическими преобразованиями в ооцитах, следует рассматривать в качестве альтернативного и более естественного подхода к получению IVP эмбрионов. В настоящем исследовании впервые проведено сравнение двухфазных IVM протоколов, предполагающих созревание ооцитов коров на начальном этапе в стандартной среде и на завершающем этапе — в одной из двух сред без гормонов (ТС-199 и Fert-TALP — среды, традиционно используемой на последующем этапе оплодотворения). Цель представленной работы заключалась в изучении влияния тестируемых условий на состояние хромосом и степень апоптотической дегенерации в созревающих ооцитах, а также на развитие и качество IVP эмбрионов. Ооцит-кумулюсные комплексы (ОКК) созревали в течение 16 ч в среде ТС-199, дополненной 10 % ФБС, 10 мкг/мл фолликулостимулирующего (ФСГ) и 10 мкг/мл лютеинизирующего (ЛГ) гормонов. Затем ОКК переносили в среду ТС-199, содержащую только сыворотку (1-я система), либо в среду Fert-TALP (2-я система) и культивировали еще в течение 8 ч. Часть созревших ооцитов использовали для анализа состояния ядерного материала (окрашивание DAPI) и степени апоптоза (метод TUNEL). Другую часть подвергали оплодотворению для оценки компетенции к эмбриональному развитию. Цитологический анализ не выявил влияния системы культивирования на завершение ядерного созревания. Доля МII ооцитов через 24 ч созревания была сходной в обеих группах и составляла в 1-й и 2-й системе соответственно 83,3 и 84,7 %. В то же время процент ооцитов с признаками апоптоза при их дозревания во 2-й системе был ниже (11,7±0,7 %), чем в 1-й системе (19,4±1,1) (p < 0,05). Также обнаружено влияние условий созревания ооцитов на их развитие до стадии бластоцисты после оплодотворения in vitro. В случае переноса ОКК спустя 16 ч культивирования в среду ТС-199 выход бластоцист составлял 17,4±0,4 %. Использование в соответствующий период культивирования среды Fert-TALP повышало этот показатель до 30,0±2,9 % (p < 0,05). При этом не было обнаружено различий между сравниваемыми вариантами по доле (%) начавших дробление, общему числу ядер и степени апоптоза в бластоцистах. Полученные данные свидетельствуют о том, что при двухфазном IVM культивирование ооцитов во вторую фазу созревания (8 ч) в среде Fert-TALP более предпочтительно, чем в среде ТС-199, содержащей ФБС. Использование указанных условий понижает апоптоз в зрелых ооцитах и повышает их способность к эмбриональному развитию после оплодотворения in vitro.
Ключевые слова: ооциты коров, культивирование in vitro, среды созревания, апоптоз, эмбриональное развитие.
У крупного рогатого скота репродуктивные клеточные технологии, в том числе получение эмбрионов in vitro (in vitro embryo production, IVP), имеют широкие перспективы применения в научных исследованиях, а также для поддержания воспроизводства, сохранения генетического разнообразия и создания животных с заданными свойствами (1-3). К настоящему времени достигнут существенный прогресс в разработке IVP технологии, однако полноценность эмбрионов, развившихся in vitro, по-прежнему значительно ниже, чем in vivo. Кроме того, многие проблемы, связанные с жизнеспособностью рожденного потомства, до сих пор не решены (4, 5).
Стандартная IVP технология состоит из нескольких этапов, первый из которых — экстракорпоральное созревание яйцеклеток. В незрелых ооцитах в ответ на выделение из фолликула и помещение в соответствующую среду культивирования возобновляется мейоз и запускаются ядерные преобразования от стадии диплотены до стадии метафазы II (МII). Также в ооцитах происходят различные структурные и молекулярные трансформации на уровне цитоплазмы (цитоплазматическое созревание), которые необходимы для подготовки ооцита к оплодотворению и последующему эмбриональному развитию (6). Как известно, когда ооциты возобновляют мейоз in vitro, в них происходят те же процессы созревания ядра, что и в ооцитах in vivo, однако степень созревания цитоплазмы оказывается недостаточной, что влияет на качество яйцеклеток, а после их оплодотворения — на полноценность IVP эмбрионов. Попытки решить эту проблему, несмотря на многолетние усилия исследователей, пока не приводят к желаемому результату. Условия, в которых созревают ооциты, остаются субоптимальными и требуют дальнейшего моделирования (4, 7, 8).
Чаще всего для созревания ооцитов коров in vitro используется однофазное культивирование в среде ТС-199, дополненной фетальной бычьей сывороткой (ФБС) и гонадотропными гормонами. Показано, что в таких условиях в среднем 80 % незрелых ооцитов достигают метафазы II второго деления мейоза (9), но лишь 15-40 % развивается до стадии бластоцисты (10, 11). Низкий выход эмбрионов может объясняться совокупностью факторов. Во-первых, однофазное культивирование не учитывает временнýю несогласованность (асинхронность) между ядерными и цитоплазматическими преобразованиями. Во-вторых, TC-199 представляет собой комплексную среду, разработанную для культивирования соматических клеток, а содержащаяся в ней сыворотка, хотя и служит источником факторов роста, аминокислот и эндотоксинов (12) (что важно для степени созревания), представляет собой вариабельный компонент и может быть причиной снижения качества IVP эмбрионов (13).
Ранее мы впервые показали, что двухфазное культивирование ооцитов коров, когда сначала используется стандартная система, а затем ооциты переносят в новую среду, не содержащую гонадотропные гормоны, позволяет повышать число ядер в эмбрионах на стадии бластоцисты (14). Такое улучшение могло обусловливаться соответствующими цитоплазматическими преобразованиями, происходящими на завершающем этапе созревания, от которых в конечном итоге зависит способность ооцитов к эмбриональному развитию. Мы предположили, что двухфазное культивирование в разных по составу средах на начальном и завершающем этапе созревания ооцитов может быть альтернативным (дифференцированным) подходом к получению эмбрионов in vitro, и для повышения его эффективности необходимы дальнейшие исследования (14)
В настоящей работе впервые оценена целесообразность использования во вторую фазу созревания среды Fert-TALP (15), которая в отличие от TC-199 представляет собой раствор менее сложного состава и не содержит сыворотки. Кроме того, в среде Fert-TALP затем происходит оплодотворение созревших яйцеклеток, следовательно, ее использование в период дозревания может снижать стресс, возникающий в ооцитах при вынужденной смене одних условий культивирования на другие при переходе от этапа созревания к оплодотворению in vitro.
Цель представленной работы заключалась в изучении состояния хромосом и степени апоптотической дегенерации в ооцитах, созревающих в двух различных системах двухфазного культивирования, а также в оценке влияния исследуемых условий на развитие и качество IVP эмбрионов.
Методика. Во всех экспериментах, кроме специально указанных случаев, были использованы реагенты фирмы «Sigma-Aldrich» (США).
Яичники коров (Bos taurus taurus), отобранные после убоя, доставляли в лабораторию в течение 3-5 ч при 30-35 °С, освобождали от прилегающих тканей и многократно отмывали в стерильном физиологическом растворе с антибиотиками (пенициллин — 100 МЕ/мл, стрептомицин — 50 мкг/мл). Ооцит-кумулюсные комплексы (ОКК) выделяли из яичников, рассекая стенки фолликулов лезвием, промывали 3 раза в среде ТС-199, содержащей 5 % фетальной бычьей сыворотки (ФБС), гепарин (10 мкг/мл), пируват натрия (0,2 мМ) и гентамицин (50 мкг/мл) и проводили морфологическую оценку извлеченных ОКК. Для дальнейшего культивирования отбирали ооциты округлой формы, с гомогенной цитоплазмой, равномерной по ширине зоной пеллюцида, окруженные многослойным компактным кумулюсом. Все манипуляции с ооцитами осуществляли под стереомикроскопом SMZ («Nikon», Япония) при 37 °С.
После селекции ОКК культивировали группами по 20-30 шт. в 500 мкл среды при температуре 38,5 °С в атмосфере с 5 % СО2 при 90 % влажности. Для получения созревших ооцитов применяли двухфазную систему культивирования. ОКК инкубировали первые 16 ч в среде ТС-199, содержащей 10 % ФБС, пируват натрия (1 мМ), гентамицин (50 мкг/мл), ФСГ (10 мкг/мл) и ЛГ (10 мкг/мл) (стандартная среда созревания), после чего их переносили в свежую среду и культивировали еще в течение 8 ч. На втором этапе созревания применяли среду ТС-199 с 10 % ФБС, пируватом натрия (1 мМ) и гентамицином (50 мкг/мл) или среду для последующего оплодотворения — Fert-TALP (15), в состав которой входили 114 мМ NaCl, 3,2 мМ KCl, 0,4 мМ NaH2PO4, 2 мМ CaCl2, 0,5 мМ MgCl2, 25 мМ NaHCO3, 10 мМ HEPES, лактат натрия (10 мМ), пируват натрия (0,25 мМ), бычий сывороточный альбумин (БСА, 6 мг/мл) и гентамицин (50 мкг/мл).
Через 24 ч созревания часть ооцитов освобождали от клеток кумулюса, фиксировали и использовали для цитологического анализа степени созревания и апоптоза по ранее описанному протоколу (16). Другую часть переносили в среду Fert-TALP, дополненную БСА (6 мг/мл), гепарином (10 мкг/мл), пенициламином (20 мкМ), гипотаурином (10 мкМ) и эпинефрином (1 мкМ) для in vitro оплодотворения и оценки компетентности к последующему эмбриональному развитию.
За 1,5 ч до оплодотворения ооцитов соломинки с замороженной спермой размораживали, активные сперматозоиды получали методом «swim-up» с использованием среды Sperm-TALP (17), содержащей пируват натрия (1 мМ) и БСА (6 мг/мл). Для этого содержимое соломинок подслаивали по 220 мкл в пробирки объемом 1,8 мл («Nunc», Дания), содержащие 1 мл среды Sperm-TALP, и помещали в инкубатор (MCO-18AIC, «Sanyo», Япония) на 50 мин. В конце инкубации из пробирок отбирали 750 мкл верхнего слоя, разбавляли свежей средой и центрифугировали при 300 g в течение 10 мин. Полученный осадок, содержащий подвижные спермии, вносили в среду оплодотворения с предварительно перенесенными туда ОКК (конечная концентрация сперматозоидов 1,5×106/мл).
Половые клетки совместно инкубировали 18-20 ч, затем предполагаемые зиготы переносили в среду для развития эмбрионов (14) и культивировали в течение 7 сут. На 2-е сут после оплодотворения ооцитов проводили морфологическую оценку раздробившихся зигот, в конце культивирования определяли число эмбрионов, развившихся до стадии бластоцисты.
Полученные бластоцисты фиксировали 4 % раствором параформальдегиде и подвергали процедуре пермеабилизации в растворе Triton Х-100. Степень апоптотических изменений ядерного материала в эмбрионах определяли методом TUNEL с использованием набора In Situ Cell Death Detection Kit, fluorescein («Roche Diagnostics», Швейцария) согласно инструкции компании-производителя. Затем эмбрионы окрашивали раствором DAPI (1 мкг/мл) для локализации ядер и переносили на стекло для анализа. Микрофотографирование и оценку препаратов выполняли под флуоресцентным микроскопом Axio Imager.M2, оснащенным фильтром 65 HE (для TUNEL, возбуждение при λ = 445-470 нм) и 49 (для DAPI, возбуждение при λ = 365 нм), с использованием цифровой камеры Axiocam 506 и программы ZEN 2 pro («Carl Zeiss», Германия). Степень апоптоза в эмбрионах оценивали по доле TUNEL-позитивных ядер от общего числа ядер.
При статистической обработке данных применяли однофакторный дисперсионный анализ (программы SigmaStat, «Systat Software, Inc.», США). Результаты представлены в виде средних значений (М) и стандартных ошибок средних (±SEM). Для оценки достоверности различий между сравниваемыми средними значениями использовали критерий Тьюки.
Результаты. Условия среды, окружающей ооциты in vitro, критически влияют на качество яйцеклеток, что делает эти условия объектом направленного воздействия. В представленной работе для созревания ооцитов коров вместо стандартного однофазного протокола IVM мы использовали двухфазное культивирование ооцитов, которое предполагало их созревание в течение первых 16 ч в среде ТС-199, содержащей 10 % ФБС и гонадотропные гормоны, и последующих 8 ч — или в ТС-199, но без гормонов (1-я система), или в среде Fert-TALP (15) (2-я система). Время смены среды 16 ч было выбрано на основании полученных ранее данных о первых признаках ухудшения качества ооцитов, происходящих к этому периоду их созревания in vitrо (18).
Цитологический анализ не выявил влияния системы культивирования на завершение ядерного созревания. Доля ооцитов, находящихся на стадии MII мейоза (рис. 1, Б-Д), через 24 ч созревания (16 + 8 ч) была сходной в обеих группах и составляла 83,3 и 84,7 % (табл. 1). В то же время доля ооцитов с признаками апоптоза (см. рис. 1, Е) была ниже (11,7±0,7 %) при дозревании в среде Fert-TALP, тогда как при культивировании в ТС-199, содержащей ФБС, показатель увеличивался на 7,7 % (p < 0,05) (табл. 1).
Компетентность зрелых ооцитов к развитию после оплодотворения in vitro, которая служит критерием степени цитоплазматического созревания, оценивали по способности ооци-тов вступать в первое деление дробления (рис. 2, А) и достигать стадии бластоцисты (см. рис. 2, Б) (табл. 2).
Доля раздробившихся ооцитов, определяемая на 2-е сут культивирования, не различалась между экспериментальными группами и составляла соответственно 65,4±1,1 и 71,7±1,7 % для 1-й и 2-й системы. Тем не менее обнаружено влияние условий на втором этапе созревания ооцитов (8 ч) на их развитие до стадии бластоцисты. В случае переноса ОКК через 16 ч культивирования в среду ТС-199 выход бластоцист составлял 17,4±0,4 %. Использование в соответствующий период культивирования среды Fert-TALP повышало этот показатель до 30,0±2,9 % (p < 0,05) (см. табл. 2).
Использование двух сравниваемых протоколов двухфазного культивирования ооцитов существенно не изменяло качества IVP эмбрионов, которое оценивали по числу ядер на 7-е сут после оплодотворения (рис. 3, Б), однако в случае культивирования во второй период созревания в среде Fert-TALP наблюдалась тенденция к увеличению этого показателя (табл. 3). Доля ядер в эмбрионах с признаками апоптоза (см. рис. 3, В) также не различалась между экспериментальными группами и составляла для 1-й и 2-й системы соответственно 5,1±0,9 и 4,6±0,4 % (см. табл. 3).
Целесообразность применения двухфазного протокола IVM коров активно изучается в последние несколько лет. Для решения проблемы асинхронности между ядерным и цитоплазматическим созреванием выделенные из фолликулов ОКК некоторое время культивируют в среде созревания с добавлением ингибиторов мейоза, а затем без них (19). Однако цитоплазматические преобразования, от которых в конечном итоге зависит компетенция ооцитов к развитию, происходит не на начальном, а на завершающем этапе IVM, что указывает на необходимость изучать специфические потребности женских гамет именно в этот период (4).
С этой целью в настоящей работе впервые проведено сравнение двухфазных IVM протоколов, предполагающих созревание ооцитов коров на начальном этапе — в стандартной среде и на завершающем этапе — в одной из двух сред без гормонов (ТС-199 и Fert-TALP). Хотя среда ТС-199, содержащая ФБС, традиционно используется в большинстве однофазных протоколов IVM и способна поддерживать высокую компетентность яйцеклеток к дальнейшему развитию (15), в нашей двухфазной системе на завершающем этапе созревания она оказалась менее эффективной с точки зрения выхода эмбрионов, чем среда Fert-TALP. Также ее использование в аналогичных условиях негативно повлияло на апоптотическую дегенерацию в яйцеклетках. Причиной такого ухудшения, возможно, стало не только то, что среда ТС-199 в отличие от Fert-TALP представляет собой комплексный раствор, но и то, что в качестве источника белка в ней используется сыворотка крови, а не БСА. Считается, что добавление сыворотки приводит к неопределенным и изменчивым условиям культивирования клеток (11, 13, 20, 21). Кроме того, показано, что добавление сыворотки в среду культивирования эмбрионов негативно влияет на их развитие на ранних стадиях дробления, а также изменяет ультраструктуру и характер экспрессии генов на последующих этапах эмбрионального развития in vitro (22-24).
Таким образом, при двухфазном экстракорпоральном созревании (in vitro maturation, IVM) культивирование ооцитов во вторую фазу созревания (8 ч) в среде Fert-TALP более предпочтительно, чем в среде ТС-199, содержащей фетальную бычью сыворотку. Использование этих условий повышает качество зрелых ооцитов и их способность к эмбриональному развитию после оплодотворения in vitro.
1. Состояние хромосом и частота апоптотической дегенерации в ооцитах коров (Bos taurus taurus) после дозревания в течение 8 ч в различных системах культивирования (M±SEM) |
||||
Экспериментальная |
Число |
Доля, % |
||
экспериментов |
ооцитов всего |
ооцитов |
MII ооцитов |
|
1-я система |
4 |
85 |
83,3±5,6 |
19,4±1,1 |
2-я система |
4 |
83 |
84,7±2,4 |
11,7±0,7* |
Примечание. MII — метафаза II; 1-я система: созревание ооцитов в течение первых 16 ч в среде ТС-199, содержащей 10 % фетальной бычьей сыворотки (ФБС), а также фолликулостимулирующий и лютеинизирующий гормоны (ФСГ и ЛГ), и последующие 8 ч — в ТС-199, но без гормонов; 2-я система: созревание ооцитов в течение 16 ч в условиях, аналогичных таковым в 1-й системе, и последующие 8 ч — в среде оплодотворения Fert-TALP, не содержащей гепарин, гипотаурин и эпинефрин. |
||||
2. Способность ооцитов коров (Bos taurus taurus) к эмбриональному развитию в разных системах дозревания in vitro (M±SEM) |
|||||
Экспериментальная |
Число |
Доля дробления |
Развитие до стадии бластоцисты, % |
||
экспериментов |
ооцитов |
от числа ооцитов |
от числа эмбрионов |
||
1-я система |
5 |
150 |
65,4±1,1 |
17,4±0,4 |
26,6±0,9 |
2-я система |
5 |
123 |
71,7±1,7 |
30,0±2,9* |
42,1±4,9** |
Примечание. Описание сред и систем см. в таблице 1. |
|||||
3. Качество эмбрионов IVP (in vitro embryo production), полученных после 8-часового дозревания ооцитов коров (Bos taurus taurus) в различных системах культивирования с последующим in vitro оплодотворением (M±SEM) |
||||
Среда дозревания |
Число экспериментов |
Общее число |
Число ядер в бластоцисте |
|
всего |
апоптотических, % |
|||
TCM + 10 % ФБС (1-я) |
5 |
26 |
62.9±5,2 |
5,1±0,9 |
Fert-TALP (2-я) |
5 |
37 |
72,2±5,1 |
4,6±0,4 |
Примечание. Описание сред и систем см. в таблице 1. |
||||
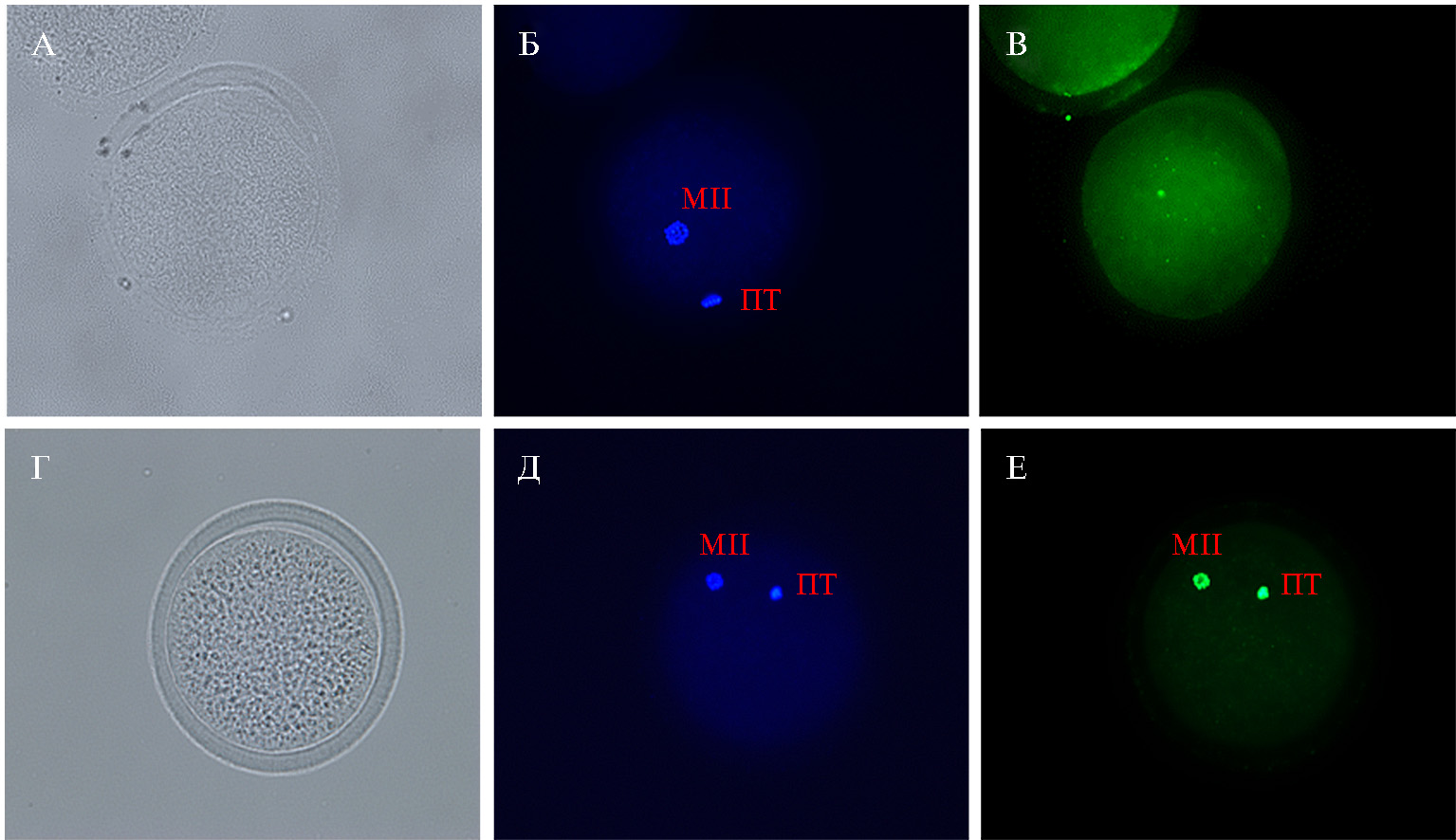
Рис. 1. Микрофотографии цитологических препаратов зрелых ооцитов коров (Bos taurus taurus) через 24 ч созревания in vitro: А, Г — морфология ооцита; Б, Д — окрашивание ядерного материала с помощью DAPI (синий цвет), MII — хромосомы на стадии метафазы второго деления мейоза, ПТ — полярное тельце; В, Е — окрашивание ядерного материала методом TUNEL, вверху (В) — ооциты без признаков апоптоза, внизу (Е) — с признаками апоптоза (TUNEL-позитивные МII хромосомы и ПТ окрашены в зеленый цвет). Увеличение ×400, флуоресцентный микроскоп Axio Imager.M2, оснащенный фильтром 65 HE (для TUNEL, возбуждение при λ = 445-470 нм) и 49 (для DAPI, возбуждение при λ = 365 нм) с цветной цифровой камерой Axiocam 506 («Carl Zeiss», Германия).
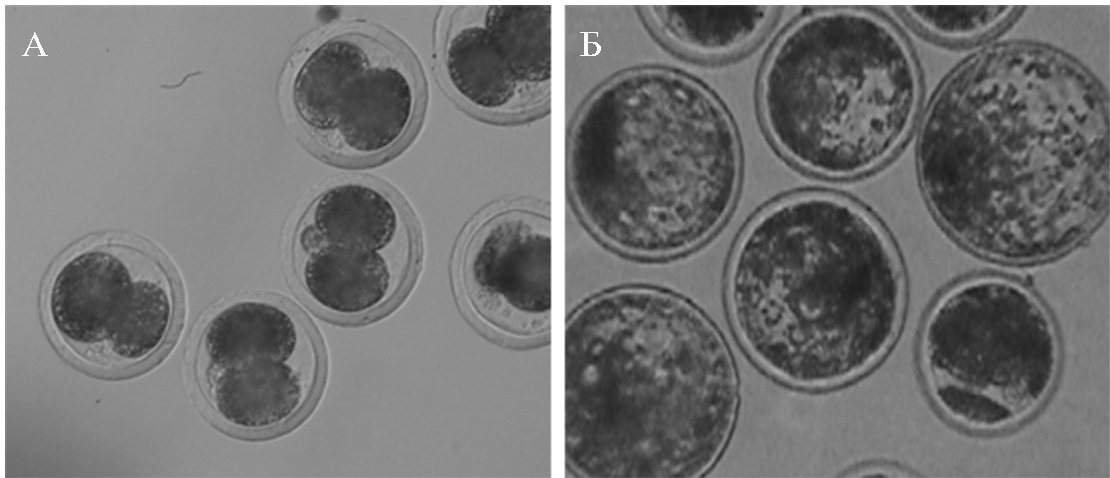
Рис. 2. Микрофотографии раздробившихся после оплодотворения in vitro ооцитов коров (Bos taurus taurus) (А) и эмбрионов, развившихся до стадии бластоцисты (Б) (увеличение ×200, микроскоп Eclipse Ti-U, «Nikon», Япония).
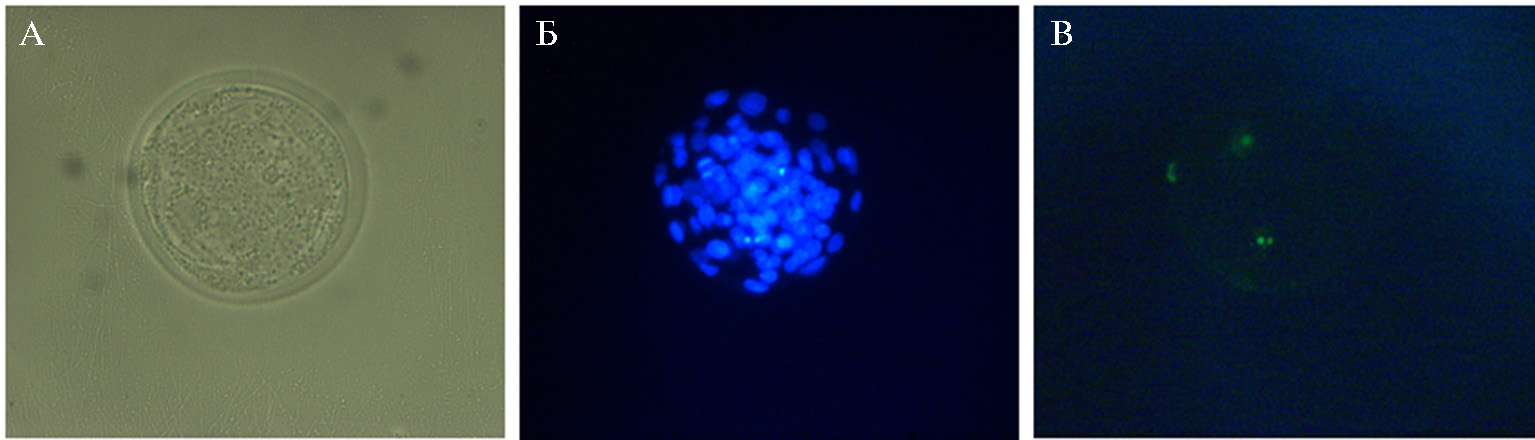
Рис. 3. Микрофотографии цитологических препаратов эмбрионов крупного рогатого скота (Bos taurus taurus) на 7-е сут культивирования: А — морфология бластоцисты; Б — окрашивание ядер в бластоцисте с помощью DAPI (синий цвет); В — окрашивание апоптотических ядер в бластоцисте методом TUNEL (TUNEL-позитивные ядра окрашены в зеленый цвет). Увеличение ×200, флуоресцентный микроскоп Axio Imager.M2, «Carl Zeiss», Германия.
ЛИТЕРАТУРА
- Lonergan P., Fair T. In vitro-produced bovine embryos: dealing with the warts. Theriogenology, 2008, 69: 17-22 (doi: 10.1016/j.theriogenology.2007.09.007).
- Galli C., Duchi R., Crotti G., Turini P., Ponderato N., Colleoni S., Lagutina I., Lazzari G. Bovine embryo technologies. Theriogenology, 2003, 59(2): 599-616 (doi: 10.1016/S0093-691X(02)01243-8).
- Ponsart С., Le Bourhis D., Knijn H., Fritz S., Guyader-Joly C., Ottern T., Lacaze S., Charreaux F., Schibler L., Dupassieux D., Mullaart E. Reproductive technologies and genomic selection in dairy cattle. Reproduction, Fertility and Development, 2013, 26(1): 12-21 (doi: 10.1071/RD13328).
- Blanco M.R., Demyda Peyrás S., Moreno M.M., Genero E. Developmental competence of in vivo and in vitro matured oocytes: a review. Biotechnology and Molecular Biology Review, 2011, 6: 155-165.
- Nagano M. Acquisition of developmental competence and in vitro growth culture of bovine oocytes. Journal of Reproduction and Development, 2019, 65(3): 195-201 (doi: 10.1262/jrd.2019-022).
- Hyttel P., Xu K.P., Smith S., Greve T. Ultrastructure of in-vitro oocyte maturation in cattle. J. Reprod. Fertil., 1986, 78: 615-625 (doi: 10.1530/jrf.0.0780615).
- Abd El-Aziz A.H., Mahrous U.E., Kamel S.Z., Sabek A.A. Factors influencing in vitro production of bovine embryos: a review. Asian Journal of Animal and Veterinary Advances, 2016, 11: 737-756 (doi: 10.3923/ajava.2016.737.756).
- Niemann H., Wrenzycki C. Alterations of expression of developmentally important genes in preimplantation bovine embryos by in vitro culture conditions: implications for subsequent development. Theriogenology, 2000, 53: 21-34 (doi: 10.1016/s0093-691x(99)00237-x).
- Dominko T., First N.L. Timing of meiotic progression in bovine oocytes and its effect on early embryo development. Molecular Reproduction and Development, 1997, 47: 456-467 (doi: 10.1002/(SICI)1098-2795(199708)47:4<456::AID-MRD13>3.0.CO;2-U).
- Ward F., Enright B., Rizos D., Boland M., Lonergan P. Optimization of in vitro bovine embryo production: effect of duration of maturation, length of gamete co-incubation, sperm concentration and sire. Theriogenology, 2002, 57(8): 2105-2117 (doi: 10.1016/s0093-691x(02)00696-9).
- Russell D.F., Baqir S., Bordignon J., Betts D.H. The impact of oocyte maturation media on early bovine embryonic development. Molecular Reproduction and Development, 2006, 73(10): 1255-1270 (doi: 10.1002/mrd.20553).
- McKiernan S.H., Bavister B.D. Different lots of bovine serum albumin inhibit or stimulate in vitro development of hamster embryos. In Vitro Cell Dev. Biol. — Animal, 1992, 28A: 154-156 (doi: 10.1007/bf02631084).
- Sagirkaya H., Misirlioglu M., Kaya A., First N.L., Parrish J.J., Memili E. Developmental potential of bovine oocytes cultured in different maturation and culture conditions. Animal Reproduction Science, 2007, 101: 225-240 (doi: 10.1016/j.anireprosci.2006.09.016).
- Singina G.N., Lebedeva I.Yu., Shedova E.N., Taradajnic T.E., Mityashova O.S., Tsyndrina E.V., Danch S.S. Bovine oocyte ability to embryonic development when maturing in different two-phase culture systems. Agricultural Biology, 2017, 52(4): 776-784 (doi: 10.15389/agrobiology.2017.4.776eng).
- Parrish J.J. Bovine in vitro fertilization: in vitro oocyte maturation and sperm capacitation with heparin. Theriogenology, 2014, 81(1): 67-73 (doi: 10.1016/j.theriogenology.2013.08.005).
- Lebedeva I.Yu., Singina G.N., Shedova E.N., Lopukhov A.V., Mityashova O.S. Resistence of bovine oocytes to age-realated changes after exposure to luteotropic factors during the second phase of culture till the metaphase II stage. Agricultural Biology, 2018, 53(6): 1202-1211 (doi: 10.15389/agrobiology.2018.6.1202eng).
- Singina G.N., Bagirov V.A., Danch S.S., Taradainik T.E., Dotsev A.V., Zinovieva N.A. In vitro production of interspecies hybrid embryos of cattle (Bos taurus) and wisent (Bison bonasus). Agricultural Biology, 2016, 51(6): 824-829 (doi: 10.15389/agrobiology.2016.6.824eng).
- Lebedeva I.Yu., Singina G.N., Lopukhov A.V., Zinovieva N.A. Dynamics of morphofunctional changes in aging bovine ova during prolonged culture in vitro. Cell and Tissue Biology, 2014, 8(3): 258-266 (doi: 10.1134/S1990519X14030080).
- Guemra S., da Silva Santo E., Zanin R., Monzani P.S., Sovernigo T.C., Ohashi O.M., Verde Leal C.L., Adona P.R. Effect of temporary meiosis block during prematuration of bovine cumulus-oocyte complexes on pregnancy rates in a commercial setting for in vitro embryo production. Theriogenology, 2014, 81(7): 982-987 (doi: 10.1016/j.theriogenology.2014.01.026).
- Salhab M., Tosca L., Cabau C., Papillier P., Perreau C., Dupont J, Mermillod P., Uzbekova S. Kinetics of gene expression and signaling in bovine cumulus cells throughout IVM in different mediums in relation to oocyte developmental competence, cumulus apoptosis and progesterone secretion. Theriogenology, 2011, 75(1): 90-104 (doi: 10.1016/j.theriogenology.2010.07.014).
- Mastromonaco G.F., Semple E., Robert C., Rho G.J., Betts D.H., King W.A. Different culture media requirements of IVF and nuclear transfer bovine embryos. Reproduction in Domestic Animals, 2004, 39: 462-467 (doi: 10.1111/j.1439-0531.2004.00548.x).
- Lonergan P., Kearney-Flynn M.O., Boland M.P. Effect of protein supplementation and presence of an antioxidant on the development of bovine zygotes in synthetic oviduct fluid medium under high or low oxygen tension. Theriogenology, 1999, 51: 1565-1576 (doi: 10.1016/s0093-691x(99)00099-0).
- Abe H., Yamashita S., Itoh T., Satoh T., Hoshi H. Ultrastructure of bovine embryos developed from in vitro-matured and fertilized oocytes: comparative morphological evaluation of embryos cultured either in serum-free medium or in serum-supplemented medium. Molecular Reproduction and Development, 1999, 53: 325-335 (doi: 10.1002/(SICI)1098-2795(199907)53:3<325::AID-MRD8>3.0.CO;2-T).
- Wrenzycki C., Herrmann D., Carnwath J.W., Niemann H. Alterations in the relative abundance of gene transcripts in preimplantation bovine embryos cultured in medium supplemented with either serum or PVA. Molecular Reproduction and Development, 1999, 53: 8-18 (doi: 10.1002/(SICI)1098-2795(199905)53:1<8::AID-MRD2>3.0.CO;2-K).