УДК 591.05:577.161.3
СБРАЖИВАНИЕ ГЛЮКОЗЫ ДРОЖЖАМИ Saccharomyces cerevisiae ПРИ ВВЕДЕНИИ В СРЕДУ ЭКЗОГЕННОГО НАД+ И α-ТОКОФЕРИЛХИНОНА
В.И. ДУДИН
Изучали влияние α-токоферилхинона на процесс сбраживания глюкозы сухими пекарскими дрожжами Saccharomyces cerevisiae при включении в инкубационную среду НАД+ или НАДН. Добавление НАД+ приводило к уменьшению скорости вовлечения гексозы в последовательность гликолитических реакций в первые 7 ч инкубирования, а также к существенному увеличению концентрации уксусного альдегида в среде. Под действием α-токоферилхинона происходило ускорение гликолиза, сопровождавшееся уменьшением содержания уксусного альдегида. Введение в среду НАДН повышало скорость использования пирувата.
Ключевые слова: сухие пекарские дрожжи Saccharomyces cerevisiae, глюкоза, уксусный альдегид, α-токоферилхинон, образование пировиноградной кислоты и уксусного альдегида, брожение.
На свойстве α-токоферилхинона как продукта свободнорадикального окисления витамина Е основано антиоксидантное действие этого витамина. Многие исследователи считают α-токоферилхинон конечным метаболитом витамина Е (1), его рассматривали также в качестве активного метаболита указанного витамина (2). Кроме того, в литературе имеются сведения о специфической роли a-токоферилхинона в деятельности рубцовой микрофлоры как донора электронов на второй стадии биогидрогенизации линолевой кислоты (3, 4).
У большинства микроорганизмов, в том числе у дрожжей, внутреннее осмотическое давление невелико и составляет 3-6 атм. (5), что определяет высокую проницаемость их клеточной мембраны, осмотический тип питания и интенсивное протекание метаболических процессов. Ранее в опытах с инкубированием коммерческих сухих свежеприготовленных или подвергшихся продолжительному хранению пекарских дрожжей Saccharomyces cerevisiaeв упрощенной среде с D-глюкозой или пируватом натрия мы установили, что D,L-α-токоферилхинон ускоряет брожение на второй стадии гликолиза (6). Различия между контролем и опытом по концентрации гексоз в среде при использовании сухих свежеприготовленных дрожжей были несущественными. Результаты, полученные при инкубировании длительно хранившихся дрожжей, свидетельствовали о меньшей интенсивности вовлечения глюкозы в брожение под влиянием α-токоферилхинона в течение 3,5; 7 и 14 ч. Уменьшение концентрации уксусного альдегида могло быть обусловлено повышением активности алкогольдегидрогеназы в связи с добавлением в среду α-токоферилхинона.
Целью настоящей работы было изучение влияния a-токоферилхи-нона на процесс сбраживания глюкозы при включении в инкубационную среду НАД+ или НАДН.
Методика. В работе использовали штамм S11M (FXV) сухих коммерческих пекарских дрожжей Saccharomyces cerevisiae («Lesaffre», Франция); субстратом служила D-глюкоза.
В I опыте испытывали три варианта: без биологически активных добавок (1-й контроль), с внесением в среду НАД+ («Sigma-Aldrich», Германия) (2-й контроль), с добавлением в среду НАД+ и D,L-α-токоферил-хинона (эксперимент). D,L-α-токоферилхинон получали из D,L-α-токоферола посредством его окисления азотной кислотой (7) с последующей очисткой на колонке из силикагеля под контролем высокоэффективной жидкостной хроматографии (ВЭЖХ) (1). В 300 мл воды добавляли 6 г глюкозы, полученный раствор разливали по 100 мл в три колбы объемом 200 мл. В экспериментальный образец вводили 0,6 ммоль НАД+ (концентрация 5,48 мкмоль/см3) и 0,0227 ммоль α-токоферилхинона (концентрация 0,2 мкмоль/см3), солюбилизированного в 10 см3 воды с помощью 150 мг Твин 20 («Merck», Германия). В оба контрольных образца добавляли такое же количество Твин 20 и воды, во 2-й контрольный образец — 0,6 ммоль НАД+ . В каждую колбу вносили по 0,75 г дрожжей. Эксперимент проводили в 3 повторностях на пробах из различных упаковок. Исследовали также варианты с введением в среду НАД+ в количестве 0,45 ммоль (концентрация 4,11 мкмоль/см3) или 0,15 ммоль (концентрация 1,37 мкмоль/см3). В связи с отсутствием принципиальных различий при использовании дрожжей из разных упаковок эти опыты проводили без повторностей.
Смеси инкубировали на водяной бане с шейкером при 30 °С, через 12 мин отбирали образцы, которые считались исходными; далее пробы (по 5 мл) отбирали через 3,5; 7; 14; 24; 36; 48; 58 и 84 ч. В качестве осадителя белка использовали 1,25 мл 10 % раствора HPO3. Пробы центрифугировали в рефрижераторной центрифуге К 24 («Janetzki», Германия) при 10 000 g и +4 °С.
Во II опыте в инкубационную среду вводили 0,56 ммоль (концентрация 5,13 мкмоль/см3) НАДН («Applichem», Германия), в III опыте в качестве субстрата для дрожжей вместо глюкозы использовали 5 % раствор этанола в воде. Варианты были те же, что и в I опыте.
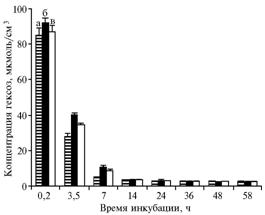 |
| Рис. 1. Концентрация гексоз в среде с глюкозой при инкубации дрожжей Saccharomyces cerevisiae: а — без добавок (1-й контроль); б — с добавлением в среду 5,48 мкмоль/см3 НАД+ (2-й контроль); в — с добавлением в среду 5,48 мкмоль/см3 НАД+ и 0,2 мкмоль/см3 α-токоферилхинона. |
Количество пировиноградной кислоты устанавливали по ее способности образовывать 2,4-динитрофенилгидразоны, которые очищали обратной экстракцией из толуольного раствора в водный раствор соды (Na2CO3) и переводили в аци-форму добавлением раствора едкого натра (8). Концентрацию гексоз определяли методом, основанным на их дегидратации с образованием формальдегида, содержание которого измеряли по реакции с хромотроповой кислотой (9). Уксусный альдегид выделяли в виде 2,4-динитрофенилгидразона из толуольного раствора, оставшегося после удаления из него кислых 2,4-динитрофенилгидразонов пировиноградной кислоты. Толуол упаривали, 2,4-динитрофенилгидразоны уксусного альдегида выделяли с помощью двукратной хроматографии со свидетелем в тонком закрепленном слое силикагеля L («Lachema», Чешская Республика), используя бензол в качестве носителя. Гидразоны с силикагеля экстрагировали метанолом. Количество альдегида определяли при l = 340 нм с помощью спектрального колориметра Specol-11 («Carl Zeiss», Германия).
Статистическую обработку проводили на основе общепринятых принципов вариационной статистики (10) с использованием программы Microcoft Exсel.
Результаты. Добавление в среду инкубации 5,48 мкмоль/см3 НАД+ привело к уменьшению скорости вовлечения глюкозы в гликолиз (рис. 1). Так, для второго и третьего вариантов I опыта достоверность различий по сравнению с 1-м контролем при 3,5-часовой инкубации (40,38±0,80 против 28,35±0,70 и 34,82±1,14 против 28,35±0,70 мкмоль/см3) составила соответственно P < 0,0003 и P < 0,008. Под влиянием a-токоферилхинона статистически достоверное усиление использования глюкозы отмечалось при 3,5-часовой инкубации (34,82±1,14 против 40,38±0,80 мкмоль/см3; Р < 0,02). Через 7 ч различия между всеми вариантами нивелировались, и концентрация гексоз до конца опыта оставалась в пределах 2-3,5 мкмоль/см3.
|
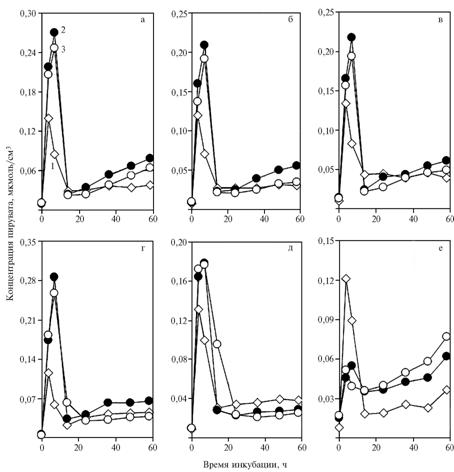
| Рис. 2. Концентрация пирувата в среде с глюкозой при инкубации дрожжей Saccharomyces cerevisiae: 1 — без добавок; 2 — с добавлением в среду НАД+ в количестве 5,48 (а-в), 4,11 (г) и 1,37 мкмоль/см3 (д) или НАДН в количестве 5,13 мкмоль/см3 (е); 3 — с добавлением в среду НАД+ (а-д) или НАДН (е) и 0,2 мкмоль/см3 a-токоферилхинона. |
Сходную временную динамику отмечали для содержания пирувата при введении в среду 5,48 или 4,11 мкмоль/см3 НАД+ (рис. 2, а-г). Максимум концентрации пирувата по сравнению с контролем сдвигался с 3,5 ч к 7 ч инкубации. Добавление 1,37 мкмоль/см3 НАД+ привело к менее заметному сдвигу максимума. Эти изменения могли быть связаны с повышением потребности в восстановительных эквивалентах в связи с пополнением фонда окисленного НАД за счет экзогенного препарата. α-Токоферилхинон тормозил образование пирувата, что выражалось в уменьшении концентрации уксусного альдегида между 7 и 14 ч инкубации.
Во II опыте при введении в среду 5,13 мкмоль/см3 НАДН использование пирувата резко усиливалось (см. рис. 2, е).
|
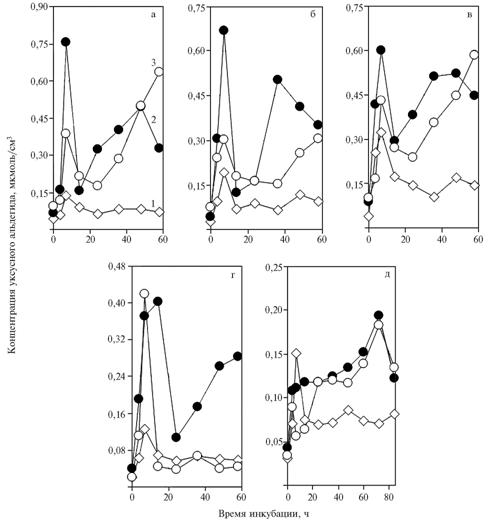
Рис. 3. Концентрация уксусного альдегида в среде с глюкозой при инкубации дрожжей Saccharomycescerevisiae: 1 — без добавок; 2 — с добавлением в среду НАД+ в количестве 5,48 (а-в), 4,11 (г) и 1,37 мкмоль/см3 (д); 3 — с добавлением в среду НАД+ и a-токоферилхинона. |
Концентрация уксусного альдегида при добавлении в среду 5,48 мкмоль/см3 НАД+, a-токоферилхинона и 7-часовой инкубации статистически достоверно уменьшалась (0,372±0,038 против 0,678±0,043 мкмоль/см3 во 2-м контроле; P < 0,007) (см. рис. 2, а-в). Аналогичные различия (0,768±0,050 против 1,129±0,046 мкмоль/см3 во 2-м контроле; P < 0,007) наблюдались по сумме трех периодов (3,5 + 7 + 14 ч). Таким образом, ускорение гликолиза под влиянием α-токоферилхинона сочетается с усилением утилизации уксусного альдегида в конце последовательности реакций или, скорее всего, им обусловлено.
Причиной описанных изменений может служить прямое воздействие a-токоферилхинона (в качестве аллостерического эффектора) на активность алкогольдегидрогеназы (АДГ). Снижение дозы НАД+ до 4,11 мкмоль/см3 не влияло на общую закономерность (рис. 3, а-г). Уменьшение количества НАД+ до 1,37 мкмоль/см3 приводило к элиминированию пика в начале инкубирования и появлению глубокого минимума на кривой при добавлении a-токоферилхинона (см. рис. 3, д). Возникновение второго максимума на графике, вероятно, было связано с замедлением декарбоксилирования пирувата (см. рис. 2, д).
Алкогольдегидрогеназа дрожжей (алкоголь:НАД+-оксидоредуктаза, КФ 1.1.1.1) представляет собой тетрамер с молекулярной массой 150 кДа, содержащий 8 ионов цинка. В активный центр каждой субъединицы входит 2 иона цинка, один из которых необходим для выполнения каталитической функции, другой — для поддержания конформации АДГ. После удаления ионов цинка фермент теряет способность к кооперативному разворачиванию (11). В присутствии НАД+ связь между мономерами упрочняется, в то время как НАДН ослабляет прочность структуры (12). Система водородных связей, образуемых Zn2+, молекулой воды, серином-48 и гистидином-51 алкогольдегидрогеназы печени, при присоединении НАД+ освобождает протон.
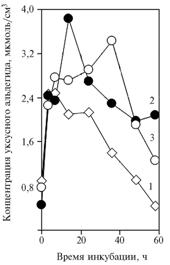 |
Рис. 4. Концентрация уксусного альдегида в среде с глюкозой при инкубации дрожжей Saccharomycescerevisiae: 1 — без добавок; 2 — с добавлением в среду НАД+ (2,74 мкмоль/см3); 3 — с добавлением в среду НАД+ и a-токо-ферилхинона. |
В дрожжевых клетках существует три изофермента АДГ, которые содержат одинаковое количество цинка (13). АДГ I принимает участие в образовании этанола при брожении и не подвержена катаболитной репрессии. АДГ II (цитозоль) и АДГ III (митохондрии) участвуют в окислительном метаболизме этанола при брожении. Если в среде присутствует глюкоза, они не синтезируются (14).
В состав лактатдегидрогеназы, малатдегидрогеназы, алкогольдегидрогеназы и глицероальдегид-3-фосфатдегидрогеназы входит по-хожий белковый фрагмент, состоящий из шести параллельных b-цепей и нескольких a-спираль-ных участков, который связывает кофермент и называется НАД+-связывающим доменом (15). АДГ из дрожжей имеет четыре центра связывания НАД+.
Повторное повышение концентрации уксусного альдегида при добавлении в среду НАД+ объясняется усилением утилизации этанола (см. рис. 3), скорее всего, за счет АДГ II. Введение α-токоферилхинона модифицирует этот эффект, поскольку второй максимум концентрации уксусного альдегида проявляется позднее отраженного на графике периода инкубации, однако по занимаемой площади этот пик мог быть заметно больше контрольного. В этой связи уменьшение по сравнению с контролем первого пика концентрации можно интерпретировать как усиление утилизации пирувата под влиянием a-токоферилхинона.
В III опыте в вариантах с введением 2,74 мкмоль/см3 НАД+ наблюдалось усиление образования уксусного альдегида по сравнению с контролем (рис. 4). Добавление a-токоферилхинона приводило к сдвигу максимума концентрации уксусного альдегида в сторону большего времени инкубации. При увеличении продолжительности инкубации количество образуемого и окисляемого при добавке НАД+ этанола могло быть больше.
Итак, воздействие α-токоферилхинона на брожение связано с коферментной функцией НАД+, но не НАДН. Введение в среду НАД+ приводило к уменьшению скорости вовлечения гексозы в последовательность гликолитических реакций в первые 7 ч инкубирования и существенному увеличению концентрации уксусного альдегида в среде. Под действием α-токоферилхинона происходило ускорение гликолиза, поэтому содержание уксусного альдегида уменьшалось. Введение в среду НАДН повышало скорость использования пирувата.
Л И Т Е Р А Т У Р А
1. Д у д и н В.И. Биохимия витамина Е и связанных с ним биологически активных веществ. М., 2004.
2. Д о н ч е н к о Г.В. Биохимия убихинона. Киев, 1988.
3. H u g h e s P.E., T o v e S.B. Identification of an endogenous electron donor for biohydrogenation as α-tocopherolquinol. J. Biol. Chem., 1980, 255(10): 4447-4452.
4. H u g h e s P.E., H u n t e r W.J., T o v e S.B. Biohydrogenationof unsaturated fatty acids. J. Biol. Chem., 1982, 257(7): 3643-3649.
5. К о н о в а л о в С.А. Биохимия дрожжей. М., 1962.
6. Д у д и н В.И. Об участии α-токоферилхинона в процессах сбраживания глюкозы дрожжами Saccharomyces cerevisiae. С.-х. биол., 2010, 2: 34-39.
7. R a o G.H.R., K e i c h T.P., W h i t e J.G. Preparation, separation and characterisation of vitamin E quinone. J. Chromat., 1980, 196(3): 506-511.
8. П е т р у н ь к и н а А.М. Практическая биохимия. Л., 1961: 384-390.
9. К о р е н м а н И.М. Методы определения органических соединений. М., 1970: 65-66.
10. М е р к у р ь е в а Е.К. Биометрия в животноводстве. М., 1964.
11. Я н г И., Ж о у Х.-М. Влияние ионов цинка на конформационную стабильность дрожжевой алкогольдегидрогеназы. Биохимия, 2001, 66(1): 61-70.
12. У а й т А., Х е н д л е р Ф., С м и т Э., Х и л л Р., Л е м а н И. Основы биохимии. Т. 1. М., 1981.
13. Э й х г о р н Г. Неорганическая биохимия. М., 1978.
14. Б е р р и Д. Биология дрожжей. М., 1985.
15. А н и с и м о в А.А. Основы биохимии. М., 1986.
V.I. Dudin
The author studied the effect of α-tocopherylquinone on glucose fermentation by dry baker's yeast Saccharomyces cerevisiae at the addition of NAD+ or NADH to incubation medium. The addition of NAD+ results in the reduction of speed of glucose involvement into glycolysis in the first 7 hours of incubation, and also the essential increase of acetaldehyde concentration in the medium. Under the action of α-tocopherylquinone the glycolysis is accelerating, and the content of acetaldehyde reduces, simultaneously. The addition of NADH to the medium raises the speed of pyruvate use.
Key words: dried baker's yeast Saccharomyces cerevisiae, glucose, acetic aldehyde, α-toco-pherolquinone, pyruvic acid and acetic aldehyde formation, fermentation.
ГНУ Всероссийский НИИ физиологии, |
Поступила в редакцию |