УДК 636.93:636.084:636.087.72
ОСОБЕННОСТИ ФУНКЦИОНИРОВАНИЯ АНТИОКСИДАНТНОЙ СИСТЕМЫ ХИЩНЫХ МЛЕКОПИТАЮЩИХ ПОД ВЛИЯНИЕМ СЕЛЕНИТА НАТРИЯ
С.Н. CЕРГИНА1, Т.Н. ИЛЬИНА1, В.А. ИЛЮХА1, М.В. ФАТЫШЕВА2, Л.Г. ПОДЛЕПИНА2
Изучали влияние селенита натрия на состояние антиоксидантной системы (АОС) печени и почек у вуалевых песцов, серебристо-черных лисиц и американских норок породы пастель и темно-коричневого типа стандартной породы. Выявлена видоспецифичность реакции АОС на введение препарата в рацион животных. Показано, что селенит натрия в разной степени влияет на функционирование ферментативного и неферментативного компонентов АОС, причем последний подвержен более существенным изменениям.
Ключевые слова: антиоксидантная система, селенит натрия, пушные звери.
Пушные звери, разводимые в неволе, должны содержаться на сбалансированном рационе, включающем достаточное количество минеральных веществ. Селен — один из важнейших биологически активных микроэлементов. Он оказывает влияние на жизнедеятельность клетки как через изменение активности селеносодержащих белков, обладающих антиоксидантными свойствами и участвующих в метаболизме тиреоидных гормонов, так и через редокс-регуляцию множества метаболических функций клетки (1).
Значимость селена как необходимого микроэлемента впервые установили К. Schwarz и C.M. Foltz (2) на основе его взаимодействия с витамином Е — одним из мощнейших неферментативных антиоксидантов и факторов регуляции перекисного окисления липидов (ПОЛ). Селен влияет на метаболизм витамина Е посредством изменения активности селеноэнзимов, в частности глутатионпероксидазы (ГПО) и тиоредоксинредуктазы, восстанавливающей аскорбат, который в свою очередь регенерирует витамин Е из его радикальной формы (3).
При дефиците селена в рационе снижается устойчивость организма к окислительному повреждению, что может привести к развитию свободнорадикальной патологии, характеризующейся бесплодием, мышечной дистрофией, дегенерацией печени, повышением проницаемости и ломкости капилляров (4). Для профилактики селенодефицитных заболеваний у сельскохозяйственных животных в качестве кормовых добавок применяют соединения селена, преимущественно селенит натрия (5). В концентрации 0,1 мг/кг селенит действует как необходимый микроэлемент, но при содержании 8-10 мг/кг и выше становится токсичным (6).
Влияние селенита натрия на функционирование различных компонентов антиоксидантной системы (АОС) изучали в основном на лабораторных животных (4). Вместе с тем пушные звери представляют собой уникальный модельный объект, поскольку сохранили ряд физиологических черт, свойственных диким сородичам (строгую сезонность биологических циклов линьки, размножения, обмена веществ и связанную с этим динамику изменений в ряде физиологических систем, в том числе в АОС) (7, 8). Результаты, полученные в экспериментах на этих животных, можно экстраполировать на зверей, обитающих в природе.
Целью нашей работы было изучение влияния селенита натрия на состояние антиоксидантной системы печени и почек у вуалевых песцов, серебристо-черных лисиц и американских норок.
Методика. Исследования проводили с июля по октябрь 2006 года на звероводческой ферме ОАО «Пряжинское» (г. Пряжа, Республика Карелия) на американских норках (Mustela vison Schr.) породы пастель (мутантный тип коричневого окраса) и темно-коричневого типа стандартной породы (немутантный тип окраса), песцах (Alopex lagopus L.) вуалевой породы и лисицах (Vulpes vulpes L.) серебристо-черной породы. В контрольную и опытную группу каждого вида включали по 12 животных 2-месяч-ного возраста (на начало июля).
Условия содержания на ферме соответствовали стандартным. Животных кормили 2 раза в день, воду давали без ограничения. Состав рациона в контроле был следующим (г/418 кДж обменной энергии): мясные субпродукты — 5-10, мясокостные субпродукты — 6-10, рыбная мука — 15-20, рыбный фарш — 3-5, отварная крупа — 14,5-15,5, овощи — 8-10, сухие дрожжи — 2 и жир — 1-2. Особи из опытной группы дополнительно получали с кормом селенит натрия (Na2SeO3) в течение шести декад (1 июля—18 октября) с перерывами по 10 сут. Доза селенита составляла: для норок на протяжении всего периода исследований — 0,2 мг/гол., для лисиц и песцов с 1 по 30 июля — 0,2 мг/гол., с 10 августа по 8 сентября — 0,3 мг/гол. и с 19 сентября по 18 октября — 0,4 мг/гол. Взвешивание зверей проводили ежемесячно с 1 июля по 1 октября.
Образцы тканей печени и почек отбирали в период планового забоя животных (ноябрь). Для интегральной оценки состояния АОС использовали хемилюминесцентный анализ (ХМЛ) (9) с применением люминола и люцигенина в качестве люминофоров (для характеристики соответственно ферментативного и неферментативного звеньев системы) и перекиси водорода (для активации свечения). Индуцированное свечение регистрировали в течение 40 с.
Концентрацию a-токоферола (витамин Е) и ретинола (витамин А) определяли методом высокоэффективной жидкостной хроматографии (10). Активность антиоксидантных ферментов измеряли спектрофотометрически: супероксиддисмутазы (СОД) (К.Ф. 1.15.1.1) — по модифицированной адренохромной методике (11), каталазы (К.Ф. 1.11.1.6) — по количеству разложенной перекиси водорода (12); содержание белка — по Лоури (13) с использованием в качестве стандарта бычьего сывороточного альбумина.
Полученные результаты обрабатывали общепринятыми методами вариационной статистики (14). Для сравнения различий между группами использовали непараметрический критерий Вилкоксона-Манна-Уитни.
Результаты. Наиболее подверженной воздействию селенита натрия оказалась антиоксидантная система печени и почек норок обоих окрасов, в меньшей степени на введение препарата в рацион реагировала АОС лисиц. При этом существенные изменения неферментативного звена АОС наблюдали в почках, ферментативного — в печени (рис., табл. 1, 2). У песцов значительных изменений исследованных показателей АОС обнаружено не было. Селенит натрия не оказал заметного влияния на распределение и содержание витамина Е в органах изученных видов хищных млекопитающих. Изменение содержания витамина А отмечали в органах лисиц и пастелевых норок (см. табл. 2).
Влияние препарата на ферментативное звено АОС в гомогенатах печени темно-коричневых и пастелевых норок было разнонаправленным (см. рис., А). Число импульсов индуцированной перекисью водорода люминолзависимой ХМЛ в гомогенатах печени темно-коричневых норок из опытной
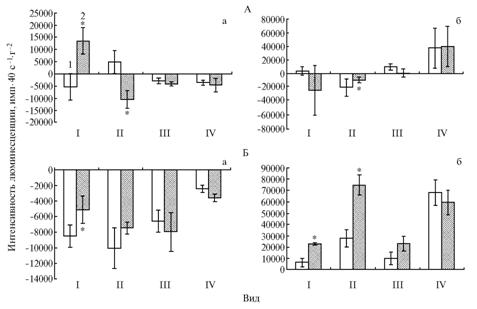 |
Влияние селенита натрия на люминолзависимую (а) и люцигенинзависимую (б) индуцированную перекисью водорода хемилюминесценцию в гомогенатах печени (А) и почек (Б) у разных видов хищных млекопитающих: I — норка темно-коричневого окраса, II — норка пастелевого окраса, III — лисица серебристо-черная, IV — песец вуалевый; 1 — контрольная группа, 2 — опытная группа (ОАО «Пряжинское», Республика Карелия, 2006 год). |
1. Удельные активности ферментов антиоксидантной защиты и содержание белка в гомогенатах печени и почек у американских норок, серебристо-черных лисиц и вуалевых песцов в зависимости от наличия в рационе селенита натрия (М±m, ОАО «Пряжинское», Республика Карелия, 2006 год) |
||||||
Вид |
Удельная активность |
Количество белка, мг/г |
||||
супероксиддисмутазы, |
каталазы, |
|||||
контроль |
опыт |
контроль |
опыт |
контроль |
опыт |
|
П е ч е н ь |
||||||
Норка темно-коричневая |
1,82± |
1,83± |
4,34± |
3,06± |
133,21± |
135,91± |
Норка пастелевая |
1,13± |
1,62± |
4,05± |
4,02± |
144,33± |
149,06± |
Лисица серебристо-черная |
1,03± |
3,26± |
5,18± |
6,15± |
109,13± |
115,19± |
Песец вуалевый |
7,19± |
4,12± |
9,61± |
7,12± |
66,40± |
117,79± |
П о ч к и |
||||||
Норка темно-коричневая |
0,98± |
1,21± |
0,62± |
0,45± |
140,99± |
137,56± |
Норка пастелевая |
1,19± |
1,53± |
0,31± |
0,36± |
123,19± |
113,49± |
Лисица серебристо-черная |
2,98± |
5,98± |
0,65± |
1,79± |
133,41± |
72,72± |
Песец вуалевый |
1,37± |
1,51± |
0,91± |
0,96± |
133,92± |
111,17± |
П р и м е ч а н и е. Описание групп в зависимости от наличия в рационе селенита натрия см. в разделе «Методика». |
||||||
группы увеличивалось по сравнению с контролем, что было связано с менее напряженной работой ферментативного звена АОС. В гомогенатах печени норок пастелевого окраса число импульсов люминолзависимой ХМЛ снижалось, а люцигенинзависимой ХМЛ — возрастало (см. рис., А), что свидетельствует о более интенсивном функционировании антиоксидантных ферментов и уменьшении количества неферментативных антиоксидантов под влиянием препарата. В печени пастелевых норок установлено однонаправленное стимулирующее действие селенита натрия на активность СОД, тогда как у норок темно-коричневого окраса отмечали снижение активности каталазы (см. табл. 1), которое может быть связано со способностью препарата активировать синтез селеносодержащего изофермента глутатионпероксидазы (ГПО), обладающего более высоким сродством к перекиси водорода (4). Так, активность ГПО печени крыс регулируется селеновым статусом организма и практически отсутствует при содержании животных на селенодефицитной диете (15).
| 2. Содержание витаминов Е и А (мкг/мл) в гомогенатах печени и почек у американских норок, серебристо-черных лисиц и вуалевых песцов в зависимости от наличия в рационе селенита натрия (М±m, ОАО «Пряжинское», Республика Карелия, 2006 год) | ||||
Вид |
Витамин Е |
Витамин А |
||
контроль |
опыт |
контроль |
опыт |
|
П е ч е н ь |
||||
Норка темно-коричневая |
1,56±0,29 |
1,52±0,19 |
0,17±0,03 |
0,17±0,03 |
Норка пастелевая |
0,22±0,02 |
0,35±0,04 |
0,04±0,02 |
0,08±0,01 |
Лисица серебристо-черная |
0,39±0,15 |
0,51±0,11 |
0,04±0,02 |
0* |
Песец вуалевый |
0,63±0,07 |
0,52±0,11 |
0,05±0,02 |
0,01±0,01 |
П о ч к и |
||||
Норка темно-коричневая |
0,68±0,16 |
0,65±0,11 |
7,25±0,96 |
8,90±1,22 |
Норка пастелевая |
4,43±0,29 |
4,04±0,09 |
3,69±0,98 |
7,47±1,30* |
Лисица серебристо-черная |
3,79±0,23 |
3,03±0,23 |
5,02±0,42 |
7,57±0,78* |
Песец вуалевый |
4,04±0,39 |
5,07±1,05 |
9,29±1,49 |
10,96±1,35 |
П р и м е ч а н и е. То же, что в таблице 1. |
||||
В печени лисиц под действием селенита наряду с возрастанием активности СОД происходило значительное уменьшение содержания ретинола, что может быть обусловлено взаимокомпенсаторными отношениями компонентов АОС (см. табл. 2). Как правило, снижение концентрации или активности одних антиоксидантов приводит к соответствующему изменению других, благодаря чему сохраняется общая активность радикальных процессов, жизненно важных для поддержания гомеостаза (4). Регулирующее влияние витамина А на метаболизм липидов и интенсивность ПОЛ в печени (16) также может служить объяснением усиленному расходованию ретинола в этом органе при введении препарата. В то же время пребывание животных на рационе с добавлением селенита натрия не повлияло ни на характер распределения, ни на содержание витамина Е в печени (см. табл. 2), что может свидетельствовать об отсутствии необходимости в дополнительной антиокислительной защите за счет a-токоферола (17).
Хемилюминесцентный анализ показал однонаправленное активирующее действие препарата на индуцированную перекисью водорода люминол- и люцигенинзависимую ХМЛ в гомогенатах почек у норок темно-коричневого окраса и люцигенинзависимую ХМЛ в гомогенатах почек у пастелевых норок (см. рис., Б). Эти изменения свидетельствуют о снижении интенсивности функционирования антиоксидантных ферментов в почках темно-коричневых норок и неферментативных антиоксидантов у животных обоих окрасов по сравнению с контролем. В связи с тем, что в почках синтез селеносодержащей ГПО происходит более интенсивно, чем в других органах (4), ослабление работы отдельных звеньев АОС, возможно, также объясняется активирующим влиянием селенита натрия на синтез ГПО.
В почках лисиц, получавших препарат, отмечали его однонаправленное стимулирующее воздействие на удельные активности обоих исследованных ферментов (см. табл. 1). Источниками субстрата для каталазы, помимо реакций дисмутации супероксидных анион-радикалов в перекись водорода, служат ферментативные реакции с различными оксидазами, объединенными под общим названием «перекисьпродуцирующие ферменты» (18). Наблюдаемые изменения активности каталазы, обладающей низким сродством к перекиси водорода и поэтому более эффективно обезвреживающей ее высокие концентрации, могут быть связаны с усилением работы этих ферментов и, как следствие, повышенной выработкой перекиси водорода (4).
Мы не выявили достоверных различий в содержании a-токоферола в гомогенатах почек животных контрольной и опытной групп. В то же время концентрация ретинола под влиянием препарата в почках пастелевых норок и лисиц значительно увеличилась (см. табл. 2). F.J Schweigert и I. Buchholz (19) предположили, что почки играют специфическую роль в метаболизме витамина А у представителей семейств Canidae и Mustelidae — высокое содержание витамина в этом органе связано с экскрецией больших его количеств (до 60 % ежедневного потребления) с мочой, что, по-видимому, служит защитой от интоксикации ретинолом. Можно предположить, что введение селенита натрия повлекло усиление экскреции витамина А почками.
Наиболее значительное снижение содержания белка под действием селенита было зафиксировано у лисиц (см. табл. 1). Известно, что в обеспечении положительного азотного баланса и усилении общего синтеза белка участвует гормон щитовидной железы Т3 (20). Селеноэнзимы играют немаловажную роль в модуляции и контроле множества аспектов метаболизма тиреоидных гормонов, в частности периферического синтеза более активного Т3 из Т4 и регуляции тиреоидальной активности гипофизарно-гипоталамическим путем (21). Вероятно, введение селенита натрия вызывало усиление катаболизма белков в почках собачьих, что может быть опосредовано действием тиреоидных гормонов.
Необходимо отметить отсутствие существенных различий в показателях хемилюминесценции (см. рис.), активности антиоксидантных ферментов (см. табл. 1), а также содержания изученных витаминов (см. табл. 2) как в печени, так и в почках песцов из опытной группы по сравнению с контрольными животными. Устойчивость АОС органов песцов к действию селенита натрия, по-видимому, связана с высокой гомеостатированностью систем этих животных, обеспечивающей адаптацию организма к условиям полярного климата.
Песцы по своей биологии (тип обмена веществ, характер питания и т.д.) близки к серебристо-черным лисицам, но характеризуются более поздними (на 2-4 нед) сроками размножения и обладают более интенсивным энергетическим обменом (22). Лисицы не имеют узкоспециализированных адаптаций (23). Вероятно, различия в реакции на введение препарата обусловлены большей пластичностью лисиц по сравнению с песцами.
Пушные звери характеризуются значительными сезонными колебаниями обмена веществ, которые проявляются в виде периодических изменений живой массы в основном за счет отложения жировых запасов осенью и их использования зимой (7).
В опытной группе у самцов пастелевых норок и лисиц в 3-месячном возрасте (август) отмечалось достоверное увеличение прироста живой массы по сравнению с контрольными животными, по-видимому, вследствие интенсификации синтеза белка под влиянием введения селенита натрия. В процессе роста организма ведущая роль принадлежит белковому обмену (22). Через месяц (сентябрь) самцы лисиц и песцов из опытной группы также показали большую прибавку массы по сравнению с контролем. Со второй половины сентября у животных происходит интенсификация углеводного обмена, обусловленная энергетическими тратами на формирование зимнего опушения и отложением подкожного жира, за счет которого, в основном, и обеспечивается прирост живой массы в осенний период (7). В октябре у самок норок пастелевого окраса в опытной группе масса была больше, чем у контрольных животных, тогда как у темно-коричневых норок не обнаружено значительных изменений этого показателя. Представители семейства Canidae (кроме самок лисиц) в возрасте 5 мес характеризовались меньшей, чем контрольные особи, живой массой. Вероятно, подобные изменения связаны с перестройкой энергетического обмена вследствие модуляции метаболизма тиреоидных гормонов селеном (20).
Наибольшие изменения живой массы под влиянием препарата отмечены у самцов, которые, согласно эволюционной теории пола, более чувствительны к воздействиям факторов среды по сравнению с самками, выполняющими в эволюции консервативную роль (24).
Таким образом, введение в рацион селенита натрия оказывает значительное влияние на антиоксидантную систему (АОС) хищных млекопитающих, затрагивая как комплекс ферментов, так и систему низкомолекулярных антиоксидантов, лимитирующих содержание активных форм кислорода в тканях. Реакция АОС на введение селенита видоспецифична. Кроме того, препарат в разной степени влияет на функционирование ферментативного и неферментативного компонентов АОС. При применении селенита натрия необходимо учитывать эколого-видовые и генотипические особенности животных, в соответствии с которыми следует подбирать дозировку, обеспечивающую наибольшее проявление ожидаемых результатов и их развитие в желательном направлении.
Л И Т Е Р А Т У Р А
1. A r t h u r J.R., M c K e n z i e R.C., B e c k e t t G.J. Selenium in the immune system. J. Nutr., 2003, 133: 1457S-1459S.
2. S c h w a r z K., F o l t z C.M. Selenium as an integral part of factor 3 against dietary necrotic liver degeneration. J. Am. Chem. Soc., 1957, 79: 3292-3293.
3. C h e n g W.-H., V a l e n t i n e B.A., L e i X.G. High levels of dietary vitamin E do not replace cellular glutathione peroxidase in protecting mice from acute oxidative stress. J. Nutr., 1999, 129: 1951-1957.
4. З е н к о в Н.К., Л а н к и н В.З., М е н щ и к о в а Е.Б. Окислительный стресс. Биохимический и патофизиологический аспекты. М., 2001.
5. I p C. Lessons from basic research in selenium and cancer prevention. J. Nutr., 1998, 128: 1845-1854.
6. J a c o b s M., F r o s t C. Toxicological effects of sodium selenite in Sprague-Dawley rats. J. Toxicol. Environ. Health., 1981, 8: 575-585.
7. Б е р е с т о в В.А. Биохимия и морфология крови пушных зверей. Петрозаводск, 1971.
8. И л ь и н а Т.Н., И л ю х а В.А., К а л и н и н а С.Н. и др. Влияние генотипа на сезонные изменения антиоксидантной системы и изоферментного спектра лактатдегид-рогеназы американских норок (MustelavisonSchreber, 1777). Вест. ВОГиС, 2007, 11(1): 145-154.
9. K l i n g e r W., K a r g e E., K r e t z s c h m a r M. e.a. Luminol- and lucigenin-amplified chemiluminescence with rat liver microsomes. Kinetics and influence of ascorbic acid, glutathione, dimethylsulfoxide, N-t-butyl-a-phenyl-nitrone, copperions and a copper complex, catalase, superoxide dismutase, hexobarbital and aniline. Exp. Toxicol. Pathol., 1996, 48(5): 447-460.
10. С к у р и х и н В.Н., Д в и н с к а я Л.М. Определение a-токоферола и ретинола в плазме крови сельскохозяйственных животных методом микроколоночной высокоэффективной жидкостной хроматографии. С.-х. биол., 1989, 4: 127-129.
11. M i s r a H.P., F r i d o v i c h F. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase. J. Biol. Chem., 1972, 247(10): 3170-3175.
12. B e a r s R.F., S i z e s I.N. A spectral method for measuring the breakdown of hydrogen peroxide by catalase. J. Biol. Chem., 1952, 195(1): 133-140.
13. L o w r y O.H., R o s e n b r o u g h N.J., F a r r A.L. e.a. Protein measurement with the Folin phenol reagent. J. Biol. Chem., 1951, 193(1): 265-275.
14. И в а н т е р Э.В., К о р о с о в А.В. Введение в количественную биологию. Петрозаводск, 2003.
15. Y e h J.-Y., V e n d e l a n d S.C., G u Q. e.a. Selenium influences tissue levels of selenoprotein W in sheep. J. Nutr., 1997, 127: 2165-2172.
16. Б у н а т я н Н.Д., Г е р а с и м о в а О.А., С а х а р о в а Т.С. и др. Природные антиоксиданты как гепатопротекторы. Эксп. и клин. фармакол., 1999, 62(2): 64-67.
17. Н а д и р о в Н.К. Токоферолы и их использование в медицине и сельском хозяйстве. М., 1991.
18. Х а в и н с о н В.Х., Б а р и н о в В.А., А р у т ю н я н А.В. и др. Свободнорадикаль-ное окисление и старение. СПб, 2003.
19. S c h w e i g e r t F.J., B u c h h o l z I. Vitamin A metabolism in carnivores with special reference to fur bearing animals. Scientifur., 1995, 19(4): 305-307.
20. Б у л а т о в А.А. Эндокринология и метаболизм. М., 1985.
21. H a w k e s W.C., K e i m N.L. Dietary selenium intake modulates thyroid hormone and energy metabolism in men. J. Nutr., 2003, 133: 3443-3448.
22. П е р е л ь д и к Н.Ш., М и л о в а н о в Л.В., Е р и н А.Т. Кормление пушных зверей. М., 1981.
23. Canids: foxes, wolves, jackals and dogs /C. Sillero-Zubiri, M. Hoffmann, D.W. Macdonald (eds.). N.Y., USA, 2004.
24. Г е о д а к я н В.А. Эволюционная теория пола. Природа, 1998, 4: 60-69.
FEATURES OF ANTIOXIDANT SYSTEM FUNCTIONING IN CARNIVOROUS MAMMALS UNDER THE INFLUENCE OF SODIUM SELENITE
S.N. Sergina1, T.N. Il’ina1, V.A. Ilyukha1, M.V. Fatysheva2, L.G. Podlepina2
The authors studied the influence of sodium selenite on antioxidant system (AOS) of liver and kidney in veil polar fox, silver fox and American mink of the pastel breed and deep-brown type of the standard breed. The species-specificity of AOS reactions was revealed on the addition of this preparation to animal’s ration. It was shown, that sodium selenite has various influence on functioning enzymatic and non-enzymatic AOS component, the latter has greater susceptibility.
Key words: antioxidant system, sodium selenite, fur animals.
1Институт биологии Карельского научного |
Поступила в редакцию |













