УДК 636.4.033:636.084.412:612.015.6:577.152.1
АКТИВНОСТЬ КАТАЛАЗЫ КРОВИ У ПОРОСЯТ В СВЯЗИ С ФИЗИОЛОГИЧЕСКИМ СОСТОЯНИЕМ НА ФОНЕ РАЗНОЙ ОБЕСПЕЧЕННОСТИ РАЦИОНОВ ВИТАМИНАМИ А И Е
С.В. ГРИЩУК
В условиях научно-производственных опытов на помесных (ландрас и крупная белая) и чистопородных (крупная белая) поросятах в период послеотъемного стресса изучали динамику активности каталазы в связи с выбраковкой животных по состоянию здоровья и обеспеченностью рациона витаминами А и Е.
Ключевые слова: поросята, витамины А и Е, активность каталазы крови и печени, связь активности каталазы с состоянием здоровья поросят, α-токоферол, α-токоферилхинон.
Известно, что каталаза разрушает Н2О2 за счет диспропорционирования двух молекул субстрата с образованием двух молекул Н2О и одной молекулы О2. При достаточно простой технике анализа определение активности каталазы связано с большими трудностями, поскольку перекись водорода при температуре выше 10 °С чрезвычайно агрессивна по отношению к ферментному белку, вследствие чего возрастает погрешность измерения. В этой связи, помимо проведения реакции при 0-10 °С (1), предлагалось сократить период контакта перекиси с образцом гемолизированной крови до 1 или 15 с (2). Концентрация перекиси водорода в реакционной среде, как правило, очень большая: в классическом методе А.Н. Баха и С.Р. Зубковой (3) — 1 % (на анализ 2 мл x 10 мг/мл = 20 мг), С.И. Крайнева — 0,85 % (на анализ 5 мл x 8,5 мг/мл = 42,5 мг). В организме каталаза действует как пероксидаза, поскольку концентрация Н2О2 в тканях невысока (4). В методе В.И. Дудина (5) (колориметрическое определение количества перекиси водорода с реактивом Фолина) перекись водорода используется в концентрации 1,5 мМ (на анализ 1 мл x 51 мкг/мл = 51 мкг), то есть имеются основания полагать, что таким образом определяется активность каталазы как пероксидазы. В реакционную среду восстановители не добавляются, и в качестве восстановителя может выступать другая молекула перекиси водорода, фенолы или гидрохиноны (например, a-токо-ферилгидрохинон). При этом активностями истинных пероксидаз как малыми величинами можно пренебречь.
Интересно отметить, что ряд эффектов витамина Е объясняется его способностью регулировать биосинтез гема, что не может не влиять на статус каталазы как гемсодержащего фермента (6, 7). Мы воспользовались колориметрическим методом при анализе каталазной активности гемолизи-рованной крови поросят, получавших разные дозы витамина Е (D,L-α-токоферилацетата) для противодействия послеотъемному стрессу.
Целью представляемой работы было изучение механизма участия витаминов А и Е в регуляции активности каталазы.
Методика. Первый научно-производственный опыт выполняли на свинокомплексе «Кузнецовский комбинат» (Московская обл.), где изучали возможность и целесообразность применения иммуностимулирующих доз витамина Е для купирования послеотъемного стресса. Определение показателя жизнеспособности основывалось на данных о выбраковке поросят ветеринарной службой по состоянию здоровья (легочные нарушения). Объектами исследования были поросята-помеси (породы ландрас и крупная белая) в возрасте от 28 до 50 сут (5 групп по 52 гол. в каждой). Комфортность содержания поросят падала от I к V группе. В этом опыте, проводившемся в зимний период, размещение поросят V группы у бетонной стены с окнами и вентиляторами было наиболее неблагоприятным в отношении угрозы простудных заболеваний, I группы (контроль) — наиболее комфортным. Контрольные особи получали комбикорма СК-3 и СК-4 без добавок витамина Е, остальные — D,L-α-токоферилацетат в количестве 100, 247, 433 и 712 мг/кг корма (соответственно II, III, IV и V группа) (значения приведены по результатам прямого химического анализа).
Второй опыт проводили в Республике Беларусь на свинокомплексе «Боровица» Дрогиченского комбикормового завода (Ивановский р-н, Брестская обл.) для изучения влияния разных доз витаминов А и Е на активность каталазы в цельной гемолизированной крови и в сыворотке крови, исходя из предположения об эритроцитарном происхождении каталазы в сыворотке крови. По принципу аналогов по массе сформировали 5 групп 30-35-суточных поросят крупной белой породы по 120 гол. в каждой. Поросята I (контрольной) группы получали основной рацион (ОР) в соответствии с возрастными нормами и комбикорма СК-3 или СК-4, содержащие витамины А (30 000 МЕ/кг корма) и Е (30 мг/кг корма), без дополнительных добавок к рациону витаминов А и Е, II и IV групп — дополнительно D,L-a-токоферилацетат (соответственно 30 и 60 мг/кг корма), III и V — ретинилацетат (микровит А Промикс-1000, «Adisseo Euroasie») (соответственно 30 000 и 60 000 МЕ/кг корма). Условия содержания по группам были одинаковыми. Кроме того, на двух группах поросят этой партии (по 10 гол. в каждой), убитых в 105-суточном возрасте, изучали активность каталазы в цельной крови и в гомогенатах печени в зависимости от физической формы витамина E (порошок и раствор в растительном масле) при одинаковых дозах его скармливания (30 мг/кг корма) в течение 45 сут (60-105-е сут).
Для уточнения характера прямого взаимодействия токоферола с перекисью водорода провели опыт in vitro. В первом варианте для оценки взаимодействия в водной среде α-токоферол (6 мг) солюбилизировали в 25 мл перекиси водорода (3 % водный раствор) с использованием силикагеля (1,5 г). Через 12 ч перемешивания липидную часть экстрагировали бензолом, который упаривали, а остаток растворяли в гексане для проведения высокоэффективной жидкостной хроматографии (ВЭЖХ). Во втором варианте α-токоферол (6 мг) растворяли в этаноле (18 мл), приливали 2 мл 3 % водного раствора Н2О2 и инкубировали 10 ч, 1 и 10 сут.
Кровь для анализа брали из хвостовой артерии (первый опыт) в 50-суточном и из аорты (второй опыт) в 105-суточном возрасте. В плазме крови определяли концентрацию ретинола и a-токоферола с использованием ВЭЖХ на хроматографе Милихром (Россия) со стальной колонкой 120x2 мм; адсорбент — Силасорб-600 (Чешская Республика), размер гранул 6,0 мкм, элюент — смесь гексан : серный эфир : метанол (89:10:1). Эту же технику применяли при анализе α-токоферола (8). Активность каталазы в цельной крови, в печени и сыворотке крови оценивали, как описано в литературе (5).
Статистическую обработку данных выполняли в соответствии с методикой, изложенной в монографии Е.К. Меркурьевой (9).
Результаты. В первом опыте в период послеотъемного стресса не выявили существенных различий между группами по среднесуточным приростам живой массы поросят, за исключением животных, получавших максимальную дозу витамина Е (712 мг D,L-α-токоферилацетата), у которых этот показатель был достоверно ниже (P < 0,001), чем у особей из I группы (107±6 против 139±7 г в контроле). То есть предполагаемый эффект витамина Е как антистрессора в период после отъема поросят, когда, в частности, наблюдается торможение роста молодняка, не проявился. В этом варианте на результаты повлияла некомфортность содержания, а сверхдоза витамина Е не оказала иммунностимулирующего действия.
Резкие изменения концентрации α-токоферола в плазме крови поросят зафиксировали только при введении в рацион D,L-a-токоферилаце-тата в дозе 100 мг/кг корма у поросят из II группы по сравнению с особями из I (1,66±0,36 против 0,13±0,02 мкг/мл; P < 0,02). При этом разница между группами по содержанию витамина Е в корме была 17-кратной (в контроле корм содержал только фоновое количество природного a-токоферола — 5,8 мг/кг корма). Дальнейшее увеличение дозы витамина Е не приводило к заметному увеличению концентрации α-токоферола в плазме крови, но даже максимальная доза (V группа) не обеспечила ее повышения (показатель — 2,48±0,41 мкг/мл) до значений, которые считаются иммуноактивными — 3 мкг/мл (10). Несомненная причина этого — невысокая поедаемость кормов в период послеотъемного стресса.
Как уже отмечалось, каталаза относится к гемсодержащим ферментам (четыре гемовые группы на молекулу) и характеризуется очень высоким числом оборотов: одна молекула способна разложить 2 600 000 молекул Н2О2 в минуту. В нашем опыте наименьшую активность каталазы наблюдали у поросят, получавших D,L-α-токоферилацетат в количестве 100 мг/кг корма. Повышение дозы витамина Е приводило к статистически достоверному увеличению активности каталазы в цельной гемолизированной крови (для III группы относительно I, V относительно I, IV относительно II, V относительно II, IV относительно III и V относительно III — соответственно Р = 0,004; Р < 0,0001; Р = 0,002; Р = 0,0001; Р = 0,024 и Р = 0,001). Поскольку D,L-α-токоферилацетат поросятам из I группы в корм не добавляли при низком естественном фоне a-токоферола (5,8 мг/кг корма), у них причиной повышения активности каталазы в цельной гемолизированной крови мог послужить дефицит витамина Е.
|
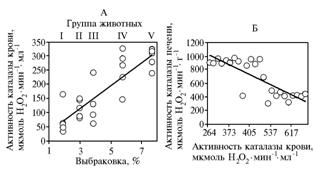
Нами была выявлена тесная положительная корреляция (r = 0,87; P < 0,001) между индивидуальной величиной ак-тивности каталазы в гемолизированной крови у 25 поросят (по 5 животных из каждой группы) и соответствующими показателями выбраковки по группам (рис. 1), тогда как концентрация α-токоферола в плазме крови коррелировала с выбраковкой поросят гораздо слабее (r = 0,49; P < 0,05). В итоге зависимость между концентрацией a-токоферола в плазме и активностью каталазы в гемолизированной крови была весьма незначительной (r = 0,31; P > 0,05).
Выяснилось также (второй опыт, дополнительные группы), что между активностью каталазы в гемолизированной крови и гомогенатах печени существует обратная зависимость (r = -0,67, P = 0,001). Известно, что между кровью и печенью происходит обмен регуляторными биохимическими агентами; возможно, подобные функции выполняет a-токоферилхинон.
Во втором опыте мы выявили очень высокую (по сравнению с первым опытом) активность каталазы в эритроцитах, что соответствовало доле выбраковки заболевших поросят (в контроле — 30 %).В гемолизированной цельной крови в связи с включением в рацион поросят витамина А или Е этот показатель в основном снижался (рис. 2). При этом межгрупповые различия по большей части оказывались статистически достоверными (III группа относительно I, IV относительно I, V относительно I, III относительно II, IV относительно II и V относительно II соответственно Р = 0,0313; Р < 0,0001; Р = 0,0001; Р = 0,0067; Р < 0,0001 и Р < 0,0001).
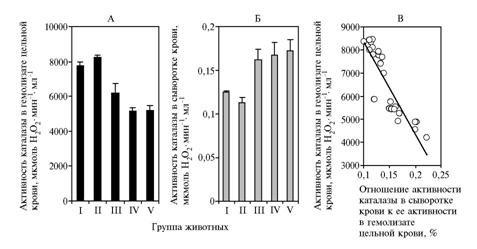 |
Рис. 2. Активность каталазы в цельной крови (А), сыворотке крови (Б) и их соотношение (В) в зависимости от обеспеченности рационов витаминами А и Е по группам поросят крупной белой породы (научно-производственный опыт, свинокомплекс «Боровица», Республика Беларусь). Описание групп см. в разделе «Методика». |
Активность каталазы в сыворотке крови тех же поросят по сравнению с аналогичным показателем для цельной крови оказалась весьма невелика (см. рис. 2) при статистически достоверных различиях между группами: для III относительно I, IV относительно I, V относительно I, III относительно II, IV относительно II и V относительно II — соответственно Р = 0,0089; Р = 0,0181; Р = 0,0061; Р = 0,0049; Р = 0,01 и Р = 0,0036. Между активностью фермента в сыворотке крови и в эритроцитах отмечалась отрицательная корреляция (r = -0,89; P < 0,001). Поскольку в сыворотке крови фермент имеет эритроцитарное происхождение, выявленная обратная зависимость между его активностью в гемолизированной крови и сыворотке дополнительно указывает на ведущую роль каталазы эритроцитов в защите организма от повреждающего действия продуктов перекисного окисления липидов (ПОЛ).
В научной литературе имеются сведения о взаимосвязи между содержанием перекиси водорода и концентрацией α-токоферола в крови (11). Введение в кровь перекиси водорода приводит к исчезновению α-токоферола. Каталаза при внесении до добавления перекиси устраняет этот эффект, после добавления — не влияет на количество a-токоферола. Добавленная в кровь перекись водорода может вступать в реакцию Фентона c Fe2+, которая сопровождается образованием очень токсичного продукта — гидроксидного радикала ОН•, способного атаковать любое соединение, в том числе a-токоферол. Возможно, отмеченный выше нелинейный характер изменения концентрации a-токоферола в плазме крови при повышении концентрации D,L-α-токоферилацетата обусловлен именно образованием активных форм кислорода.
Перекись водорода опасна тем, что в отличие от супероксиданиона легко проникает через мембраны. Она участвует как в окислительных, так и в восстановительных реакциях (12):
![]()
В клетках эукариотов образование активных форм кислорода происходит в реакциях, катализируемых НАДФН-оксидазой и некоторыми другими специализированными оксидазами (13). Увеличение интенсивности синтеза активных форм кислорода выше определенного уровня вызывает окислительный стресс, сопровождающийся усилением перекисного окисления липидов, окислительной модификации белков и нуклеиновых кислот.
Упомянутые выше свойства позволяют перекиси водорода участвовать в качестве кофактора в пероксидазных реакциях, вследствие чего in vivo при очень невысокой концентрации Н2О2 и достаточном количестве других доноров каталаза, как уже отмечалось, действует исключительно как пероксидаза (4). Активные формы кислорода (супероксиданион) служат катализаторами окисления α-токоферола молекулярным кислородом (8). Этот многостадийный процесс, в частности, ведет к образованию α-токоферилхинона. В то же время механизм действия Н2О2 может быть иным из-за образования при ее распаде чрезвычайно активного гидроксидного радикала. Достаточно давно была предложена схема окисления α-токоферола в a-токоферилхинон через хинонметин в свободнорадикальных процессах (14).
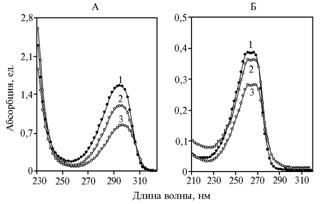 |
Рис. 3. УФ-спектры a-токоферола (А, 1), a-токоферилхинона (Б, 1) и веществ, обнаруженных при добавлении in vitro к a-токоферолу Н2О2 в спиртовой (2) и водной (3) среде. |
При сравнении in vitro влияния перекиси водорода, добавленной к a-токоферолу, на количество α-токоферола и α-токоферилхинона в смеси, оказалось, что в водном растворе у первого оно изменялось мало, у второго — заметно увеличивалось (с 0 до 5 %), в спиртовом — у обоих соединений оно практически не изменялось (концентрация второго составляла 0,25-0,30 %). Следовательно, прямого окисления α-токоферола за счет перекиси водорода практически не происходит. Меньшее образование α-токоферилхинона в спиртовой среде обусловлено тем, что спиртовый гидроксил в молекуле этанола хорошо нейтрализует свободные радикалы. На рисунке 3 представлены УФ-спектры продуктов, обнаруженных после контакта α-токоферола с перекисью водорода в спиртовой и водной среде.
Таким образом, повышение активности каталазы в образцах крови при малых концентрациях субстрата может служить субклиническим показателем состояния животных, что объясняется усилением свободнорадикальных процессов при наличии скрытых воспалений, а также положительно коррелирует с частотой выбраковки. С увеличением дозы витаминов Е и А в рационе активность каталазы в гемолизате цельной крови снижается, в сыворотке крови — наоборот, повышается, причем корреляция между этими показателями отрицательная и очень высокая (r= -0,89; P < 0,001), свидетельствующая о том, что уменьшение активности каталазы с повышением обеспеченности поросят витаминами А и Е приводит к усилению ее выхода из эритроцитов в сыворотку крови. При этом между активностью каталазы в гемолизированной крови и в гомогенатах печени обнаружена обратная зависимость, указывающая на наличие координации между этими двумя основными источниками фермента в организме, возможно, за счет вторичного мессенджера. Поскольку также показано, что in vitro в присутствии Н2О2 не происходит заметного окисления α-токоферола, его окисление в крови под влиянием перекиси водорода, по всей видимости, осуществляется ферментативно или в реакции Фентона с Fe2+, которая сопровождается образованием очень токсичного гидроксидного радикала. Эти данные подчеркивают важность проблемы оптимальной обеспеченности рационов витаминами A и E, необходимой для более точной коррекции физиологического состояния животных, в том числе, возможно, через влияние на метаболизм a-токоферилхинона (15).
Л и т е р а т у р а
1. С а м н е р Д.Б., С о м е р с Г.Ф. Химия ферментов и методы их исследования. М., 1948.
2. К р а й н е в С.И. Определение каталазной активности гемолизированной крови при односекундном и пятнадцатисекундном сроках реакции с перекисью водорода. Лаб. дело, 1962: 13-18.
3. Б а х А.Н. Сб. избр. тр. Л., 1937.
4. У а й т А., Х е н д л е р Ф., С м и т Э. и др. Основы биохимии. М., 1981.
5. Д у д и н В.И. Способ определения каталазы крови. Авт. св. СССР ¹ 1399682 от 01.02.1988.
6. C a a s i R.H., H a u s w i r t h J.W., N a i r P.P. Biosynthesis of heme in vitamin E deficiency. Ann. N.Y. Acad. Sci., 1972, 203: 93-102.
7. N a i r P.P. Vitamin E and metabolic regulation. Ann. N.Y. Acad. Sci., 1972, 203: 53-61.
8. Д у д и н В.И. Биохимия витамина Е и связанных с ним биологически активных веществ. М., 2004.
9. М е р к у р ь е в а Е.К. Биометрия в животноводстве. М., 1964.
10. J e n s e n M. Vitamin E and the growing pig. Uppsala: Swed. Univ. Agr. Sci., 1989, 150: 3710-3715.
11. S z a b o S.J., M e n g e l C.E. Effect of diet and in vivo hyperoxia on plasma tocopherol levels. Am. J. Med. Sci., 1968, 255: 132-136.
12. С а м у и л о в В.Д., Б е з р я д н о в Д.В., Г у с е в М.В. и др. Н2О2 ингибирует рост цианобактерий. Биохимия, 1999, 64(1): 60-67 .
13. Т у р п а е в К.Т. Активные формы кислорода и регуляция экспрессии генов. Биохимия, 2002, 67(3): 339-352.
14. T a p p e l A.L. Vitamin E and free radical peroxidation of lipids. N.Y. Acad. Sci., 1972, 203: 12-28.
15. Д у д и н В.И., Г р и щ у к С.В., С а к о в ц е в а Т.В. Об участии a-токоферилхинона и убихинона в регуляции процессов роста у свиней и птицы. С.-х. биол., 2008, 6: 53-58.
CATALASE ACTIVITY IN PIGLETS BLOOD IN CONNECTION WITH PHYSIOLOGICAL STATE ON THE BACKGROUND OF VARIOUS CONTENT OF A AND E VITAMINS IN RATIONS
S.V. Grishchuk
In the conditions of scientific-practical experiment on piglets of the Landras and Big White hybreeds and Big White breed during the weaning stress the author investigated a dynamics of catalase activity in connection with animals draft out on health state and content of A and E vitamins in rations.
Key words: piglets, vitamins A and E, blood and liver catalase activity, relationship of catalase activity with health of piglets, α-tocopherol, α-tocopherol quinine.
ГНУ Всероссийский НИИ физиологии, |
Поступила в редакцию |













