doi: 10.15389/agrobiology.2019.5.920rus
УДК 633.1:581.14:577.21
Работа выполнена при поддержке гранта РНФ № 17-76-20023.
ИЗУЧЕНИЕ ЭФФЕКТA ГЕНОВ КОРОТКОСТЕБЕЛЬНОСТИ ПШЕНИЦЫ (Triticum aestivum L.) И РЖИ (Secale cereale L.) НА ПРИМЕРЕ РАСЩЕПЛЯЮЩЕЙСЯ ПОПУЛЯЦИИ ЯРОВОЙ ТРИТИКАЛЕ В УСЛОВИЯХ ВЕГЕТАЦИОННОГО ОПЫТА
П.Ю. КРУПИН1, 2, А.Г. ЧЕРНООК1, 2, Г.И. КАРЛОВ1, 2, А.А. СОЛОВЬЕВ1, А.Д. КОРШУНОВА2, М.Г. ДИВАШУК1, 2
Интрогрессия генов короткостебельности считается одним из надежных приемов преодоления полегания у сортов тритикале. При этом снижение высоты растений тритикале может происходить под влиянием генов как пшеничного, так и ржаного происхождения. В нашей работе в геном яровой тритикале был перенесен ген ржаного происхождения Ddw1 и изучено влияние генов Ddw1 и Rht-B1b на ряд хозяйственно значимых признаков. Мы получили семена F2 от скрещивания сортов озимой тритикале Авангард (Ddw1 Ddw1 Rht-B1a Rht-B1a) и яровой тритикале Соловей Харьковский (ddw1 ddw1 Rht-B1b Rht-B1b). Из них в условиях вегетационного опыта вырастили 273 растения с яровым типом развития (расщепляющаяся популяция F2). У каждого растения индивидуально определяли высоту; число и длину междоузлий; длину, число колосков и плотность главного колоса; массу зерна, число зерен и массу 1000 зерен с главного колоса. Каждое изучаемое растение генотипировали по аллельному состоянию генов с использованием ПЦР маркеров: аллельное состояние Rht-B1 определяли с помощью комбинации праймеров BF, MR1 и WR1; аллельное состояние Ddw1 — с праймерами для микросателлитного локуса REMS1218, сцепленного с указанным геном. Для выявления механизма наследования изучаемых генов короткостебельности мы изучили их доминантные и аддитивные эффекты. При определении влияния алеллей короткостебельности на хозяйственно ценные признаки сравнивали между собой гомозиготы по аллелям дикого типа (ddw1 и Rht-B1a) и по аллелям короткостебельности (Ddw1 и Rht-B1b), рассматривая эффект каждого из генов (независимый анализ) и межлокусное взаимодействие. Статистическую значимость различий и ассоциаций между анализируемыми признаками и генотипом оценивали с помощью критерия FФишера, U-теста Манна-Уитни и коэффициента ранговой корреляции r Спирмена. Наши исследования показали, что эффекты интродуцированных генов Ddw1 и Rht-B1b несколько отличаются от таковых у ржи и пшеницы. Ddw1 статистически значимо влиял на высоту растения (снижение достигало 40 %, p = 0,05), проявив себя как частично доминантный аллель. В присутствии Rht-B1b высота яровой тритикале тоже снижалась, но в меньшей степени, чем под воздействием гена Ddw1 (до 20 %, p = 0,05), то есть аллель Rht-B1b проявил себя как частично рецессивный. Наличие гена Rht-B1b привело к увеличению массы зерна с колоса с 1,4 г до 1,7 г (на 21,4 %, р = 0,05) за счет повышения плотности колоса, большего числа колосков и возросшей фертильности. Интрогрессия гена Ddw1 вызывала снижение общей массы зерен с колоса с 1,8 г до 1,5 г (на 16,7 %, р = 0,05) за счет уменьшения массы 1000 зерен с 45,7 г до 41,3 г (на 9,6 %, р = 0,05). В целом оба изучаемых гена по влиянию на показатели зерновой продуктивности выступали антагонистами. Полученные результаты свидетельствуют о том, что у яровой тритикале сочетание двух генов короткостебельности — ржаного Ddw1 и пшеничного Rht-B1b формирует потенциал для повышения урожайности при создании низкостебельных форм и перспективно для селекции этой культуры.
Ключевые слова: яровая тритикале, Rht-B1b, Ddw1, структурный анализ, гены короткостебельности, ДНК маркеры, селекция.
Главной идеей при создании тритикале было комбинирование положительных признаков ржи Secale cerealeL. (устойчивость к неблагоприятным условиям) и пшеницы Triticum aestivum L. (пригодность к разнообразному использованию в пищевой промышленности). Мировое производство тритикале сохраняет стабильный рост и достигло 15 млн т в 2016 году с общей площадью посевов 4,2 млн га (1), при этом культура имеет как фуражное, так и продовольственное значение (2, 3). К недостаткам тритикале, ограничивающим ее более широкое распространение при возделывании на зерно, относится полегание. Для борьбы с полеганием используют обработку ретардантами, однако это удорожает продукцию и увеличивает химическую нагрузку на окружающую среду. Другой подход в решении этой проблемы — селекционное улучшение тритикале и создание сортов, устойчивых к полеганию. Выявлена высокая корреляция между устойчивостью растений тритикале к полеганию и высотой растения (4, 5). D. Losert с соавт. (5), проанализировав коллекцию из 199 озимых и 2 яровых тритикале, показали, что в результате селекции у тритикале в течение последних 30 лет наблюдается тренд существенного снижения высоты растений (на 0,38 см в год) и уменьшения склонности к полеганию, что обусловлено сильной взаимосвязью этих двух признаков (более короткие растения, как правило, устойчивее к полеганию) (4, 6).
Высота растения — сложный количественный признак (7, 8). У гексаплоидной тритикале (BBAARR), сочетающей геномы пшеницы (ВВАА) и ржи (RR), укорочение растений может обеспечиваться генами пшеницы, ржи и/или их комбинацией.
В настоящее время у мягкой пшеницы выявлено 24 гена, снижающих высоту растения (9, 10). Наибольшее распространение в коммерческих сортах пшеницы получили гены Rht-B1b(=Rht1), Rht-D1b(=Rht2), Rht-8c, Rht-B1e(=Rht11). Они действуют даже при высоких дозах удобрений и обладают плейотропным эффектом в отношении множества хозяйственно ценных признаков (11-13). У растений пшеницы в присутствии нечувствительных к гиббереллину генов короткостебельности Rht-B1b, Rht-D1b, Rht-B1eвысота снижается в среднем на 10-15 % по сравнению с таковой у носителей аллеля дикого типа Rht-B1a (14-16). По влиянию на рост стебля эти гены проявляют себя как рецессивные или частично рецессивные. У ржи высота растения также контролируется множеством генетических факторов (17, 18). Уже известно 14 различных генов короткостебельности ржи (19-21), среди них три доминантных, из которых наибольшую селекционную ценность представляет ген Ddw1. В присутствие доминантного гена Ddw1 уменьшение высоты растений составляет до 40 % у диплоидной и до 55 % — у тетраплоидной ржи (22). Около 80 % сортов ржи российской селекции созданы с использованием источников и доноров гена Ddw1, что позволило в среднем повысить урожайность озимой ржи на 12-15 % (23). Ген Ddw1 был успешно перенесен в озимую тритикале (сорта Debo и Dalo) (24, 25), и с участием этого гена в Польше и Румынии получена серия низкостебельных сортов озимой тритикале (26, 27).
Различные гены короткостебельности пшеницы и ген короткостебельности ржи Ddw1 широко распространены среди коммерческих сортов озимой тритикале. У яровой тритикале гены короткостебельности задействованы не столь активно. Так, A.D. Korshunova соавт. (28) в результате анализа 86 образцов яровой тритикале у 76 выявили ген Rht-B1b, причем все они относятся к коммерческим сортам. Однако ни у одного образца яровой тритикале не найден ген Ddw1. Таким образом, в настоящее время разнообразие генов короткостебельности у яровой тритикале крайне ограничено (28). Хромосомное замещение 2R/2D, которое также снижает высоту растений, в коммерческих сортах яровой тритикале не встречается (29, 30).Для пшеницы и озимой тритикале характерно большее разнообразие по генам короткостебельности, и в разных сортах снижение высоты обеспечивается различными генами или их сочетаниями. У яровой тритикале такого разнообразия не наблюдается, а целенаправленные работы по введению в ее геном других генов короткостебельности не проводились. Интрогрессии дополнительных генов короткостебельности из озимой тритикале и/или пшеницы в геномный пул яровой тритикале может помочь решить проблему высокорослости этой культуры и придать новый импульс ее развитию благодаря плейотропному действию генов короткостебельности на многие хозяйственно ценные признаки. При этом следует учитывать, что механизмы влияния генов короткостебельности на высоту растений сложны, оно, как правило, реализуются через вовлечение в различные пути ответа на фитогормоны (31) и зависит в том числе от дозы гена в геноме. Эффекты разных генов короткостебельности в геноме тритикале, где в результате межродового скрещивания сочетаются далекие друг от друга геномы, вызывают интерес в связи с познанием особенностей межлокусного взаимодействия генов и практическими задачами селекции и все еще исследованы недостаточно.
В настоящей работе мы показали, что у яровой тритикале эффекты генов короткостебельности ржаного происхождения Ddw1 и пшеничного происхождения Rht-B1b несколько отличаются от таковых на ржи и пшенице. Изученные гены неодинаково влияли на высоту растений тритикале и выступали антагонистами по воздействию на элементы продуктивности.
Наша цель заключалась в оценке влияния генов Ddw1 и Rht-B1b и их взаимодействия на высоту растений и другие хозяйственно ценные признаки у яровой тритикале в условиях вегетационного опыта в расщепляющейся популяции F2.
Методика. В качестве родительских форм были выбраны сорта, несущие контрастные комбинации аллелей корокостебельности пшеницы и ржи, — сорт озимой тритикале Авангард (генотип Ddw1 Ddw1 Rht-B1a Rht-B1a; материнская форма) и сорт яровой тритикале Соловей Харьковский (генотип ddw1 ddw1 Rht-B1b Rht-B1b; отцовская форма). В 2014 году в теплице Центра молекулярной биотехнологии (РГАУ—МСХА им. К.А. Тимирязева) выращивали родительские растения, выполняли гибридизацию методом подстановки и получали растения F1. Семена материнского сорта Авангард высевали в вегетационные сосуды по 10 шт. В фазу кущения растения помещались в яровизационную комнату на 2 мес при 5 °С. После прохождения яровизации (в фазу колошения) растения вновь перемещали в теплицу; на стадии лигулы колосья кастрировали и помещали под изолятор из пергаментной бумаги. Под изолятор также помещали колос срезанного отцовского растения в фазу цветения, стебель которого находился в сосуде с водой для поддержания жизнеспособности.
Семена поколения F2 высевали в вегетационные сосуды по 10 шт. и выращивали при одинаковых условиях освещения с дозированным поливом и внесением равных доз удобрений (теплица Центра молекулярной биотехнологии РГАУ—МСХА им. К.А. Тимирязева). В общей сложности получили 273 растения F2. Так как один из родительских сортов озимый, в расщепляющейся популяции F2 присутствовало некоторое количество озимых форм, которые выбраковали по фенотипу.
Каждое растение индивидуально анализировали по следующим признакам: высота, число междоузлий, длина каждого междоузлия, длина главного колоса (ДК), число зерен с главного колоса (ЧЗ), число колосков на главном колосе, масса зерен с главного колоса (МЗ). Также рассчитывали плотность колоса (ПК) и массу 1000 зерен (М1000) по формулам соответственно [1] и [2]:

Для каждого растения F2 индивидуально устанавливали аллельное состояние генов Ddw1 иRht-B1 с помощью молекулярных маркеров.
Геномную ДНК, используемую для оценки гибридности и генотипа по аллелям анализируемых генов выделяли из каждого вегетирующего растения F1 и F2 CTAB методом (32).
Аллельное состояние генов Rht-B1 и Ddw1 у растений F1 и F2 определяли с помощью ПЦР с использованием молекулярных маркеров (синтез праймеров выполнен в ООО «Синтол», Россия). Для выявления аллелей Rht-B1a (дикий тип) и Rht-B1b использовали праймеры BF, MR1 и WR1; ПЦР осуществляли в соответствии с условиями, рекомендованными для этих целей авторами молекулярного маркера (33). Продукты ПЦР разделяли в 2 % агарозном геле в буфере ТВЕ и окрашивали бромистым этидием для последующей визуализации в УФ-трансиллюминаторе. Использовали маркер молекулярных масс GeneRuler 100 bp DNA Ladder («Thermo Fisher Scientific», США). Наличие гена Ddw1 определяли с помощью праймеров для амплификации последовательности микросателлитного локуса REMS1218, тесно сцепленного с этим геном (34). Аллели микросателлита REMS1218 определяли при помощи ПЦР согласно протоколу, описанному авторами молекулярного маркера, с последующим анализом фрагментов (генетический анализатор 3130xlGenetic Analyzer, «Applied Biosystems», США). Доминантная гомозигота Ddw1 Ddw1 выявляется в виде двух фрагментов размером 317 п.н. и 321 п.н. при одинаковой высоте пиков, гетерозигота Ddw1 ddw1 — как два фрагмента с разной высотой пиков: 317 п.н. (высокий) и 321 п.н. (низкий), у рецессивной гомозиготы ddw1 ddw1 выявляется один фрагмент размером 317 п.н.
Схему наследования определяли на основе оценки генетических эффектов согласно методике, изложенной А.В. Смиряевым и А.В. Кильчевским (35). Рассчитывали аддитивный (a) и доминантный (d) эффекты относительно среднего по всей популяции. При d = 0 схема наследования аддитивная; если d = a, то аллель доминантный, если d = -a — аллель рецессивный; если 0 < |d| < |a|, то аллель частично доминантный (при одинаковом знаке d и a) или частично рецессивный (при разных знаках d и a); если |d| > |a|, то гетерозигота проявляет сверхдоминирование по анализируемому признаку (гетерозис).
Влияние аллелей короткостебельности на изучаемые признаки определяли на основе сравнения их проявления у гомозиготы по аллелю короткостебельности и гомозиготы по аллелю дикого типа двумя способами. Для оценки эффектов каждого из генов в отдельности (независимый анализ) сопоставляли средние по популяции показатели у гомозигот только по гену пшеничного происхождения (Rht-B1a или Rht-B1b) без учета влияния ржаного генотипа или у гомозигот только по ржаному гену (Ddw1 или ddw1) без учета пшеничного генотипа. При втором способе учитывали совместный эффект ржаного (Ddw1) и пшеничного (Rht-B1) генотипов, определяя влияние пшеничного гена в зависимости от аллельного состояния ржаного гена и наоборот (межлокусное взаимодействие).
Для каждого количественного признака проводили проверку на нормальность распределения с помощью W-теста Шапиро-Уилка. Для каждой из непрерывных величин определяли среднее арифметическое (M) и стандартное отклонение (±SD). Значимость различий между показателями у гомозигот с аллелями дикого типа (ddw1 или Rht-B1a) и с аллелями короткостебельности (Ddw1 или Rht-B1b) определяли на основе следующих критериев. Для оценки различий между двумя группами использовали непараметрический U-критерий Манна-Уитни. Для выявления связей между сопоставляемыми показателями применяли метод рангового корреляционного анализа r Спирмена. Различия, при которых р ≤ 0,05, рассматривали как статистически значимые. Для выявления значимости различий между средними проводили дисперсионный анализ и использовали критерий наименьшей существенной разницы на 5 % уровне значимости (p = 0,05; НСР05). Статистический анализ данных выполняли с применением пакета программ Statistica 10.0 («StatSoft Inc.», США).
Результаты. Для определения схемы наследуемости и влияния генов короткостебельности на хозяйственно ценные признаки яровой тритикале в условиях вегетационного опыта мы использовали семена поколения F2 от скрещивания сортов озимой тритикале Авангард (генотип Ddw1 Ddw1 Rht-B1a Rht-B1a)и яровой тритикале Соловей Харьковский (генотип ddw1 ddw1 Rht-B1b Rht-B1b). Сорт Авангард сочетает высокую продуктивность зерна с устойчивостью к полеганию и высокой зимо- и морозостойкостью, хорошие хлебопекарные качества (36-38). Вторая родительская форма — сорт Соловей Харьковский рекомендуется для производства продовольственного, технического и фуражного зерна, обладает хорошими хлебопекарными свойствами, соломина имеет оптимальную высоту (95-110 см), крепкая, устойчивая к полеганию (39).
У каждого растения F2 определили генотип (аллельное состояние генов короткостебельности) (рис.) и проанализировали основные хозяйственно ценные признаки.
Высота растений. Результаты проведенного статистического анализа показывают, что Ddw1 обладает неполным доминированием у тритикале, а Rht-B1b — частично рецессивный аллель; оба гена существенно влияют на высоту растений у яровой тритикале в условиях вегетационного опыта (табл. 1).
Анализ схемы наследования на основе выявления аддитивных и доминантных эффектов генов Ddw1 и Rht-B1b показал, что у яровой тритикале в полученной расщепляющейся популяции F2 аллель короткостебельности Ddw1 обладает аддитивным эффектом в случае снижения высоты в среднем на 20,9 см и доминантным — при снижении на 11,7 см (d < a). Гомо- и гетерозиготы по аллелю Ddw1 статистически значимо различались (p = 0,05). То есть по общему влиянию на высоту растения этот аллель проявляет неполное доминирование. Аллель Rht-B1b оказался частично рецессивным: его аддитивный эффект составлял -7,1 см при доминантном эффекте +2,3 см (0 < |d| < |a|) (гомо- и гетерозиготы Rht-B1b без Ddw1 различаются существенно, p = 0,05). В литературе аллель Rht-B1b также описан как частично рецессивный (40-43).
При анализе эффекта аллеля Rht-B1b без учета влияния гена Ddw1 (см. табл. 1) разница между гомозиготами Rht-B1b Rht-B1b и Rht-B1a Rht-B1a оказалась статистически значимой и составила 9 см, или 9,1 % (p = 0,05). Независимый анализ эффекта Ddw1 также выявил, что гомозиготы Ddw1 Ddw1 и ddw1 ddw1 статистически значимо различались по высоте растений (в среднем на 40 см, или 34,4 %, p = 0,05).
При изучении межлокусного взаимодействия разница между гомозиготами Rht-B1b Rht-B1b и Rht-B1a Rht-B1a в отсутствие аллеля Ddw1 также оказалась значимой и составила 28 см, или 21,0 % (p = 0,05) (см. табл. 1). Снижение высоты растений у мягкой пшеницы с аллелем Rht-B1b по сравнению с носителями аллеля дикого типа Rht-B1a, по данным литературы, может составлять до 17 % (42, 44). В присутствии аллеля Ddw1 различия между гомо- и гетерозиготами по алеллю Rht-B1bбыли статистически несущественными, что, вероятно, объясняется маскирующим эффектом гена Ddw1, то есть снижение высоты за счет Ddw1 значительно превышает таковое вследствие присутствия Rht-B1b.
Разница по высоте между растениями-гомозиготами Ddw1 Ddw1 и ddw1ddw1, не несущими Rht-B1b пшеницы, была значима (p = 0,05) и составляла -55,5 см (-42,4 %), а с несущими аллель Rht-B1b — -28,1 см (-27,3 %) (см. табл. 1). Уменьшение разницы между гомозиготами по Ddw1 в зависимости от наличия Rht-B1b можно объяснить тем, что во втором случае ген Ddw1 снижает высоту растений, у которых высота уже снижена благодаря Rht-B1b. Различия между гомозиготами Ddw1 Ddw1 с аллелем и без аллеля Rht-B1b статистически незначима. По имеющимся сообщениям (22), снижение высоты растений ржи за счет аллеля Ddw1 составляет от 40 до 55 %.
По полученным нами в вегетационном опыте данным, у яровой тритикале при статистическом анализе независимо по каждому из изучаемых генов короткостебельности наблюдаются эффекты, схожие с эффектами этих генов у пшеницы и ржи. В геноме яровой тритикале эффект ржаного гена короткостебельности Ddw1 значительно сильнее эффекта пшеничного гена короткостебельности Rht-B1b. Однако при этом отсутствует кумулятивный эффект по снижению высоты растений от совместного присутствия двух генов. В то же время у пшеницы, по данным литературы (45, 46), при совместном присутствии генов короткостебельности Rht-B1b и Rht-D1b или Rht-B1b/Rht-B1е/Rht-D1b и Rht-8 высота снижается значительно сильнее, чем под влиянием только одного из генов. Таким образом, если цель селекционного процесса будет заключаться в снижении высоты растения у тритикале, то сочетание двух генов короткостебельности (Ddw1 и Rht-B1b) вряд ли окажется более эффективным, чем интрогрессия одного из генов. При этом следует учитывать, что введение в геном гена Ddw1 у яровой тритикале позволит в большей степени снизить высоту растений, чем использование гена Rht-B1b, распространенного в настоящее время среди коммерческих сортов данной культуры.
Число и длина междоузлий. При независимом анализе мы не выявили влияния пшеничного гена Rht-B1b на число и длину междоузлий в популяции яровой тритикале. Наличие ржаного аллеля Ddw1 независимо от аллельного состояния пшеничного гена Rht-B1 статистически значимо (p = 0,05) снижает число междоузлий в среднем на 0,2 междоузлия; достоверное снижение длины за счет Ddw1 наблюдалось по всем междоузлиям, при этом наиболее сильное — по верхнему 1-му и 2-му междоузлиям (соответственно на 32,7 и 37,5 %, p = 0,05, табл. 2).
При анализе межлокусного взаимодействия в изучаемой расщепляющейся популяции F2 мы не обнаружили эффекта алелля Rht-B1b у в отношении числа междоузлий как в присутствии, так и в отсутствие аллеля Ddw1. Так как аллель Ddw1 маскирует влияние Rht-B1b на высоту растения у яровой тритикале, то последствия присутствия аллеля Rht-B1b на изменение длины междоузлий мы изучили только у растений, не несущих аллель Ddw1 (см. табл. 2). Статистически значимое снижение длины за счетRht-B1bпроизошло по 1-му верхнему междоузлию и составило 9,5 см (-22,0 %, р = 0,05). По всем междоузлиям отмечали общую тенденцию по уменьшению длины за счет Rht-B1b. Согласно опубликованным данным, в разных популяциях пшеницы высота междоузлий из-за присутствия Rht-B1b уменьшается неодинаково. Так, W. Liu с соавт. (4) сообщают о распределении по междоузлиям 17, 21 и 24 % (соответственно 1-е, 2-е и 3-е сверху), у Y.G. Hu (47) распределение по междоузлиям составило 23, 14 и 28 %. По данным литературы (4, 47) и результатам, полученным в нашей работе, наибольший вклад в снижение высоты растений в присутствии Rht-B1b обеспечивается за счет уменьшения длины именно 1-го междоузлия.
Анализ межлокусного взаимодействия показал, что в отсутствие пшеничного аллеля короткостебельности Rht-B1b 1-е верхнее междоузлие укорачивается под воздействием аллеля Ddw1 в среднем на 18,5 см (42,0 %), а в присутствии аллеля Rht-B1b — на 10,6 см (30,0 %); в обоих вариантах статистически значимое снижение высоты (р = 0,05) наблюдали по трем верхним междоузлиям (см. табл. 2). Зависимость влияния Ddw1 на длину междоузлий от наличия/отсутствия Rht-B1b связано с тем, что в присутствии Rht-B1b 1-е междоузлие уже укорочено из-за эффекта пшеничного гена низкостебельности.
Длина колоса.Аллель Rht-B1b не показал достоверного влияния на длину колоса. При независимом анализе влияния ржаного гена короткостебельности Ddw1 на длину колоса с использованием непараметрического U-критерия Манна-Уитни (распределение отклонялось от нормального) были выявлены статистически значимые различия (на уровне значимости p = 0,04). Также при применении рангового корреляционного анализа Спирмена была выявлена статистически значимая корреляция между длиной колоса и наличием в геноме растения Ddw1 (r = -0,15; p = 0,05). Таким образом, в условиях вегетационного опыта наличие ржаного гена Ddw1 статистически значимо снижало длину колоса в среднем на 1 см.
Мы не выявили статистически значимого влияния межлокусного взаимодействия двух генов на длину главного колоса у яровой тритикале в изученной расщепляющейся популяции F2. Средняя длина колоса у растений без генов короткостебельности составляла 10,3 см, с геном Ddw1 — 9,3 см, с геном Rht-B1b — 8,9 см, с двумя генами — 9,5 см (табл. 3).
Число колосков. Статистически значимого влияния двух изученных генов на число колосков главного колоса у яровой тритикале в исследованной расщепляющейся популяции F2 мы не выявили ни при независимом анализе, ни при анализе межлокусного взаимодействия (см. табл. 3), но можно отметить определенную тенденцию в изменении этого признака. Так, пшеничный ген короткостебельности Rht-B1b при наличии гена короткостебельности ржи Ddw1 увеличивал число колосков в главном колосе, а в отсутствие ржаного гена наблюдался обратный эффект (см. табл. 3).
Плотность колоса. При независимом анализе генов (см. табл. 3) мы установили статистически значимое влияние гена Rht-B1b (U-критерий Манна-Уитни, p = 0,02) на увеличение плотности колоса. При применении метода рангового корреляционного анализа Спирмена также была выявлена статистически значимая корреляция (r = 0,19, р = 0,05). Увеличение плотности колоса в этом случае происходит за счет увеличения числа колосков. Аллель Ddw1 при независимом анализе статистически достоверного влияния на плотность колоса у яровой тритикале не проявил. Вероятно, это связано с однонаправленностью тенденций по снижению как длины колоса, так и числа колосков. Статистически значимого взаимодействия генов по этому показателю у яровой тритикале в расщепляющейся популяции F2 мы тоже не выявили.
Число зерен с главного колоса. Анализ схемы наследования гена Rht-B1 показал его достоверное аддитивное влияние на число зерен в главном колосе (+3,3 зерна, или 9,2 %, p = 0,05), при этом аллель Rht-B1b проявлял себя как доминантный, то есть гомо- и гетерозиготы по Rht-B1b значимо не различались (см. табл. 3). Эти данные сопоставимы с влиянием гена Rht-B1b на число зерен у мягкой пшеницы. Так, показано, что этот ген увеличивает число колосков, их фертильность, а в итоге и число зерен у мягкой пшеницы (42, 44, 48, 49).
Влияния гена Ddw1 на число зерен с главного колоса мы не обнаружили, хотя и наблюдали тенденцию к снижению этого показателя в отсутствие аллеля короткостебельности Rht-B1b. Статистически значимого влияния взаимодействия двух генов на число зерен с главного колоса у яровой тритикале в расщепляющейся популяции F2 мы также не отмечали (см. табл. 3).
Масса зерен с главного колоса. При независимом анализе эффектов по каждому гену в отдельности в условиях вегетационного опыта нами выявлены следующие закономерности (см. табл. 3. Наличие пшеничного аллеля короткостебельности Rht-B1b приводило к статистически значимому увеличению массы зерна с главного колоса (U-критерий Манна-Уитни p = 0,04) с 1,4 до 1,7 г (на 21,4 %). При этом наблюдается достоверная корреляция между этими параметрами (r = 0,15; р = 0,05). Наличие ржаного гена короткостебельности Ddw1 статистически значимо уменьшало массу зерна с главного колоса (U-критерий Манна-Уитни p = 0,02) с 1,8 до 1,5 г (на 16,7 %) при r = -0,18 (р = 0,05).
При изучении межлокусного взаимодействия в популяции статистически значимый доминантный эффект аллеля Rht-B1b в отношении массы зерна с главного колоса составил +0,28 г (16,0 %), то есть этот аллель повышает массу зерен с главного колоса в гетерозиготах (см. табл. 3). Статистически значимых различий при взаимодействии двух генов не выявили, но прослеживалась тенденция к увеличению массы зерна с колоса в присутствии Rht-B1b и к уменьшению — в присутствии Ddw1. В целом можно говорить о тенденции взаимной компенсации эффектов генов в изучаемой расщепляющейся популяции яровой тритикале по анализируемому признаку (снижение массы зерна с колоса под влиянием гена Ddw1 и увеличение — под воздействием гена Rht-B1b).
Масса 1000 зерен. При анализе изучаемой расщепляющейся популяции F2 по каждому гену в отдельности (см. табл. 3) оказалось, что наличие пшеничного аллеля короткостебельности Rht-B1b не оказывает статистически значимого влияния на массу 1000 зерен. Наличие ржаного гена короткостебельности Ddw1 статистически значимо уменьшало массу 1000 зерен с главного колоса (U-критерий Манна-Уитни p = 0,02) с 45,7 до 41,3 г (на 9,6 %) в условиях вегетационного опыта. При этом между анализируемыми параметрами наблюдалась статистически значимая корреляция r = -0,17 (p = 0,05). Следовательно, общее снижение массы зерна с главного колоса в присутствии ржаного гена короткостебельности Ddw1 обусловлено прежде всего снижением массы зерновок, а не уменьшением их числа. При анализе схемы наследования мы обнаружили незначительный доминантный эффект гена Rht-B1b в отношении массы 1000 зерен, что выражается в повышении показателя у гетерозигот в среднем на 4,2 г (10,1 %). Незначительный аддитивный эффект аллеля Ddw1 заключался в снижении массы 1000 зерен в среднем на 2,0 г (4,5 %), при этом Ddw1 проявлял себя как доминантный аллель, проявляясь в гомо- и гетерозиготах.
Эти и остальные выявленные нами закономерности требуют дополнительного изучения на других популяциях яровой тритикале, а также в полевом опыте.
Итак, наши исследования, выполненные в условиях вегетационного опыта на расщепляющейся популяции гибрида F2 яровой тритикале, показали, что эффекты генов короткостебельности ржаного происхождения Ddw1 и пшеничного происхождения Rht-B1b несколько отличаются от таковых на ржи и пшенице. Ген Ddw1 оказал достоверное влияние на высоту растения (ее уменьшение достигало 40 %). Но при этом наблюдались и потенциально негативные эффекты, которые могут отразиться на урожайности яровой тритикале. Наличие гена Ddw1 привело к снижению общей массы зерна с колоса за счет уменьшения массы 1000 зерен. При этом ген Ddw1, который у ржи увеличивает размер колоса и озерненность колосков, в нашем опыте на яровой тритикале такого эффекта не проявил. Ген Rht-B1b тоже снижал высоту растений яровой тритикале, но значительно слабее, чем ген Ddw1 (до 20 %), и вовсе не влиял на этот признак в присутствии гена Ddw1. В то же время наличие гена Rht-B1b повысило массу зерна с колоса за счет увеличения плотности колоса, числа колосков и повышения фертильности. В целом изучаемые гены короткостебельности (Ddw1 ржаного происхождения и Rht-B1b — пшеничного) по влиянию на параметры зерновой продуктивности выступали антагонистами. Однако их сочетание у яровой тритикале, хотя и не приводит к дополнительному снижению высоты растений относительно гомозигот по Ddw1, перспективно для селекции, так как формирует потенциал для увеличения урожайности за счет создания низкостебельных форм.
1. Статистический анализ влияния генов Rht-B1, Ddw1 и их взаимодействия на высоту растений в расщепляющейся популяции гибрида F2 яровой тритикале (сорт Авангард × сорт Соловей Харьковский; вегетационный опыт) |
|||||
Генотип по аллелям Ddw1 |
Высота, см |
Генотип по аллелям Rht-B1 |
Разница между гомозиготами по Rht-B1b и Rht-B1a, см |
||
Rht-B1b Rht-B1b |
Rht-В1a Rht-B1b |
Rht-B1a Rht-B1a |
|||
высота, см |
|||||
|
|
88,4±22,2а § |
92,6±23,6а § |
97,5±30,9b § |
-9,1* (-9,3 %) |
Ddw1 Ddw1 |
76,3±13,8а § |
74,7±13,7 |
77,9±14,2 |
75,3±13,9 |
-0,6 (-0,8 %) |
Ddw1 ddw1 |
84,3±18,7а § |
84,5±19,6 |
84,3±16,1 |
84,0±22,0 |
|
ddw1 ddw1 |
116,3±23,5b § |
102,8±23,0 |
118,6±19,4 |
130,8±20,1 |
-28,0* (-21,4 %) |
Разница между гомозиготами по Ddw1 и ddw1, см |
-40,0* (-34,4 %) |
-28,1* (-27,3 %) |
|
-55,5* (-42,4%) |
|
Примечание. В таблице указаны средние значения со стандартным отклонением (M±SD); § — результаты независимого анализа эффекта аллелей; F(Ddw1) = 111,2 > F0,05 = 3,0; F(Rht-B1) = 5,0 > F0,05 = 3,0; F(Ddw1 × Rht-B1) = 5,2 > F0,05 = 2,4. |
|||||
2. Статистический анализ влияния генов Rht-B1, Ddw1 и их взаимодействия на длину междоузлий растений в расщепляющейся популяции гибрида F2 яровой тритикале (сорт Авангард × сорт Соловей Харьковский; вегетационный опыт) |
||||||||||||||||
Генотип |
Rht-B1 в отсутствие Ddw1 |
Ddw1§ |
Ddw1 в отсутствие Rht-B1b |
Ddw1 в присутствии Rht-B1b |
||||||||||||
1НМУ |
3ВМУ |
2ВМУ |
1ВМУ |
1НМУ§ |
3ВМУ§ |
2ВМУ§ |
1ВМУ§ |
1НМУ |
3ВМУ |
2ВМУ |
1ВМУ |
1НМУ |
3ВМУ |
2ВМУ |
1ВМУ |
|
2 |
5,3±3,8a |
17,6±4,2a |
27,4±5,7a |
34,7±8,7a |
4,8±2,6b |
12,5±3,5b |
17,8±6,4c |
26,8±6,3b |
5,4±3,3 |
12,6±4,2 |
18,0±5,0 |
25,9±6,4 |
4,0±1,9a |
12,58±3,8b |
16,2±4,3b |
24,4±5,0b |
1 |
5,5±3,2a |
19,2±4,6a |
28,8±6,0a |
40,6±9,3b |
4,7±2,4b |
13,1±3,3b |
19,9±5,8b |
28,0±7,4b |
4,3±2,0 |
12,6±3,2 |
21,5±7,8 |
29,1±7,8 |
5,2±2,8a |
13,36±3,4b |
18,8±5,0ab |
26,1±8,4b |
0 |
7,0±3,8a |
18,2±3,6a |
32,6±6,5a |
44,2±10,0a |
5,9±3,6a |
17,8±4,3a |
28,5±6,3a |
39,8±9,9a |
7,0±3,8 |
18,2±3,7 |
31,0±6,5 |
44,4±10,0 |
5,3±3,8a |
16,30±4,2a |
26,0±5,7a |
35,1±8,7a |
Разница между гомозиго-тами, см (%) |
-1,7 |
-2,0 |
-5,2 |
-9,5* |
1,1* |
5,3* |
10,7* |
13,0* |
-1,6 |
5,6* |
-13,0* |
-18,5* |
-1,3 |
-3,7* |
-9,8* |
-10,6* |
Примечание. В таблице указаны средние значения со стандартным отклонением (M±SD); 0 — гомозигота по аллелю дикого типа (Rht-B1a Rht-B1a или ddw1 ddw1), 1 — гетерозигота (Rht-B1a Rht-B1b или Ddw1 ddw1), 2 — гомозигота по аллелю низкостебельности (Rht-B1b Rht-B1b или Ddw1 Ddw1); 1НМУ — 1-е нижнее междоузлие, 1ВМУ — 1-е верхнее междоузлие, 2ВМУ — 2-е верхнее междоузлие, 3ВМУ — 3-е верхнее междоузлие; § — результаты независимого анализа эффекта Ddw1. |
||||||||||||||||
3. Статистический анализ влияния генов Rht-B1, Ddw1 и их взаимодействия |
|||
Генотип |
Генотип по аллелямRht-B1 |
||
Rht-B1b Rht-B1b |
Rht-B1a Rht-B1b |
Rht-B1a Rht-B1a |
|
Длина главного колоса |
|||
Ddw1Ddw1 |
9,5±3,4 |
8,5±1,8 |
9,3±2,9 |
Ddw1 ddw1 |
10,1±2,5 |
9,8±1,5 |
10,0±2,0 |
ddw1 ddw1 |
8,9±2,1 |
10,2±2,1 |
10,3±1,8 |
Число колосков в главном колосе |
|||
Ddw1Ddw1 |
24,0±5,5 |
23,4±3,5 |
21,1±5,2 |
Ddw1 ddw1 |
25,4±4,2 |
23,7±3,4 |
22,1±4,1 |
ddw1 ddw1 |
23,5±4,1 |
25,2±3,6 |
25,1±3,2 |
Плотность главного колоса |
|||
Ddw1Ddw1 |
25,1±7,0 |
26,6±3,2 |
23,2±4,5 |
Ddw1 ddw1 |
25,5±4,7 |
24,6±4,0 |
22,6±4,1 |
ddw1 ddw1 |
27,4±5,3 |
25,5±5,6 |
25,4±6,1 |
Число зерен с главного колоса |
|||
Ddw1Ddw1 |
38,3±10,7 |
38,3±11,3 |
28,5±13,7 |
Ddw1 ddw1 |
36,4±17,8 |
36,2±12,5 |
32,2±15,8 |
ddw1 ddw1 |
34,2±18,0 |
42,1±15,6 |
37,4±7,9 |
Масса зерен с главного колоса |
|||
Ddw1Ddw1 |
1,70±0,45 |
1,67±0,66 |
1,27±0,69 |
Ddw1 ddw1 |
1,56±0,87 |
1,64±0,72 |
1,27±0,77 |
ddw1 ddw1 |
1,61±0,92 |
2,01±0,80 |
1,66±0,40 |
Масса 1000 зерен |
|||
Ddw1Ddw1 |
45,6±9,7 |
42,8±9,0 |
40,7±14,2 |
Ddw1 ddw1 |
41,6±9,5 |
45,6±17,1 |
37,5±12,9 |
ddw1 ddw1 |
45,0±11,5 |
48,1±7,8 |
44,5±9,2 |
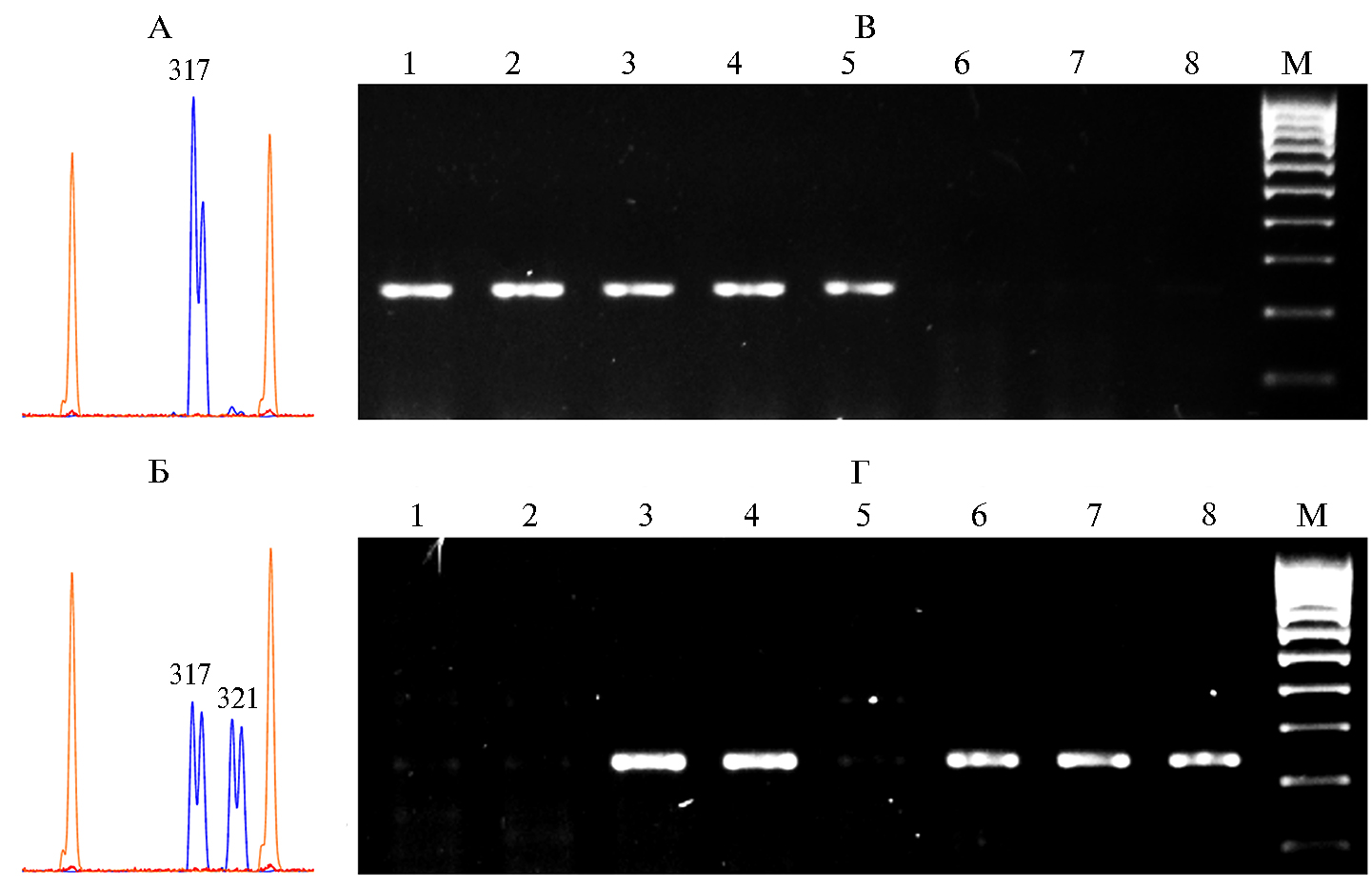
Определение аллельного состояния геновDdw1 (слева, а и б) и Rht-B1(справа, в и г) у растений F2 яровой тритикале (сорт Авангард × сорт Соловей Харьковский). Слева представлена электрофореграмма продуктов амплификации с использованием праймеров для микросателлитного локуса REMS1218 (фрагментный анализ): а — гомозигота по аллелю ddw1, размер фрагмента 317 п.н.; б — гомозигота по аллелю Ddw1, размеры фрагментов 317 п.н. и 321 п.н. Справа представлена электрофореграмма продуктов амплификации с праймерами BF + WR1 (в, идентификация аллеля Rht-B1a, 237 п.н.) и BF + MR1 (г, идентификация аллеля Rht-B1b, 237 п.н.): 1, 2, 5 — гомозиготы Rht-B1a Rht-B1a; 6, 7, 8 — гомозиготы Rht-B1b Rht-B1b; 3, 4 — гетерозиготы Rht-B1a Rht-B1b; М — маркер молекулярной массы (GeneRuler 100 bp DNA Ladder («Thermo Fisher Scientific», США).
ЛИТЕРАТУРА
- FAOSTAT. Data. Режим доступа: http://www.fao.org/faostat/en/#data. Дата обращения: 20.04.2018.
- Горянина Т.А. Сорта озимой тритикале на зернофураж в Среднем Поволжье. Известия Оренбургского государственного аграрного университета, 2017, 5(67): 42-44.
- McGoverin C.M., Snyders F., Muller N., Botes W., Fox G., Manley M. A review of triticale uses and the effect of growth environment on grain quality. Journal of the Science of Food and Agriculture, 2011, 91(7): 1155-1165 (doi: 10.1002/jsfa.4338).
- Liu W., Leiser W.L., Maurer H.P., Li J., Weissmann S., Hahn V., Würschum T. Evaluation of genomic approaches for marker-based improvement of lodging tolerance in triticale. Plant Breeding, 2015, 134(4): 416-422 (doi: 10.1111/pbr.12284).
- Losert D., Maurer H.P., Marulanda J.J., Würschum T. Phenotypic and genotypic analyses of diversity and breeding progress in European triticale (½ Triticosecale Wittmack). Plant Breeding, 2017, 136(1): 18-27 (doi: 10.1111/pbr.12433).
- Navabi A., Iqbal M., Strenzke K., Spaner D. The relationship between lodging and plant height in a diverse wheat population. Canadian Journal of Plant Science, 2006, 86(3): 723-726 (doi: 10.4141/p05-144).
- Würschum T., Liu W., Busemeyer L., Tucker M., Reif J., Weissmann E., Hahn V., Ruckelshausen A., Maurer H. Mapping dynamic QTL for plant height in triticale. BMC Genetics, 2014, 15(1): 59 (doi: 10.1186/1471-2156-15-59).
- Miedaner T., Hübner M., Korzun V., Schmiedchen B., Bauer E., Haseneyer G., Wilde P., Reif J.C. Genetic architecture of complex agronomic traits examined in two testcross populations of rye (Secale cereale L.). BMC Genomics, 2012, 13(1): 706 (doi: 10.1186/1471-2164-13-706).
- McIntosh R.A., Yamazaki Y., Dubcovsky J., Rogers J., Morris C., Appels R., Xia X.C. Catalogue of gene symbols for wheat, 2013. Режим доступа: https://shigen.nig.ac.jp/wheat/komu-gi/genes/macgene/2013/GeneSymbol.pdf. Дата обращения: 20.04.2018.
- McIntosh R.A., Dubcovsky J., Rogers W.J., Morris C., Xia X.C. Catalogue of gene symbols for wheat, 2017. Режим доступа: https://shigen.nig.ac.jp/wheat/komugi/genes/macgene/sup-plement2017.pdf. Дата обращения: 20.04.2018.
- Mo Y., Vanzetti L., Hale I., Spagnolo E., Guidobaldi F., Al-Oboudi J., Odle N., Pearce S., Helguera M., Dubcovsky J. Identification and characterization of Rht25, a locus on chromosome arm 6AS affecting wheat plant height, heading time, and spike development. Theoretical and Applied Genetics, 2018, 131(10): 2021-2035 (doi: 10.1007/s00122-018-3130-6).
- Jobson E., Martin J., Schneider T., Giroux M. The impact of the Rht-B1b, Rht-D1b, and Rht-8 wheat semi-dwarfing genes on flour milling, baking, and micronutrients. Cereal Chemistry, 2018, 95(6): 770-778 (doi: 10.1002/cche.10091).
- Zhao K., Xiao J., Liu Y., Chen S., Yuan C., Cao A., You F., Yang D., An S., Wang H., Wang X. Rht23 (5Dq′) likely encodes a Q homeologue with pleiotropic effects on plant height and spike compactness. Theoretical and Applied Genetics, 2018, 131(9): 1825-1834 (doi: 10.1007/s00122-018-3115-5).
- Rebetzke G.J., Bonnett D.G., Ellis M.H. Combining gibberellic acid-sensitive and insensitive dwarfing genes in breeding of higher-yielding, sesqui-dwarf wheats. Field Crops Research, 2012, 127: 17-25 (doi: 10.1016/j.fcr.2011.11.003).
- Divashuk M., Vasilyev A., Bespalova L., Karlov G. Identity of the Rht-11 and Rht-B1e reduced plant height genes. Russian Journal of Genetics, 2012, 48(7): 761-763 (doi: 10.1134/S1022795412050055).
- Divashuk M.G., Fesenko I.A., Karlov G.I., Bespalova L.A., Vasilyev A.V., Puzyrnaya O.Y. Reduced height genes and their importance in winter wheat cultivars grown in southern Russia. Euphytica, 2013, 190(1): 137-144 (doi: 10.1007/s10681-012-0789-7).
- Mahone G.S., Frisch M., Bauer E., Haseneyer G., Miedaner T., Falke K.C. Detection of donor effects in a rye introgression population with genome-wide prediction. Plant Breeding, 2015, 134(4): 406-415 (doi: 10.1111/pbr.12283).
- Alheit K., Busemeyer L., Liu W., Maurer H., Gowda M., Hahn V., Weissmann S., Ruckelshausen A., Reif J., Würschum T. Multiple-line cross QTL mapping for biomass yield and plant height in triticale (× Triticosecale Wittmack). Theoretical and Applied Genetics, 2013, 127(1): 251-260 (doi: 10.1007/s00122-013-2214-6).
- Börner A., Plaschke J., Korzun V., Worland A. The relationships between the dwarfing genes of wheat and rye. Euphytica, 1996, 89(1): 69-75 (doi: 10.1007/bf00015721).
- Кобылянский В.Д. Новые селекционные признаки озимой ржи. Материалы II Вавиловской международной конференции «Генетические ресурсы культурных растений в XXI веке. Состояние, проблемы, перспективы». СПб, 2007: 476-477.
- Stojałowski S., Myskow B., Hanek M. Phenotypic effect and chromosomal localization of Ddw3, the dominant dwarfing gene in rye (Secale cereale L.). Euphytica, 2015, 201(1): 43-52 (doi: 10.1007/s10681-014-1173-6).
- Hackauf B., Goldfisch M., Musmann D., Melz G., Wehling P. Evaluation of the dominant dwarfing gene Ddw1 with respect to its use in hybrid rye breeding. Tagung der Vereinigung der Pflanzenzüchter und Saatgutkaufleute Österreichs, 2013, 63: 41-42.
- Кобылянский В.Д., Солодухина О.В. Развитие идей Н.И. Вавилова в современных исследованиях рода Secale L. Труды по прикладной ботанике, генетике и селекции, 2012, 169: 53-64.
- Wolski T., Gryka J. Semidwarf winter triticale. Triticale today and tomorrow /H. Guedes-Pinto, N. Darvey, V.P. Carnide (eds.). Kluwer Academic Publishers, Dordrecht Boston London, 1996: 581-588.
- Pojmaj M.S., Wolski T. Breeding strategies for improving lodging resistance in winter triticale in connection with heterosis. CIMMYT, 1991. Режим доступа: http://agris.fao.org/agris-search/search.do?recordID=QY9200132. Без даты.
- Ittu G., Saulescu N.N., Ittu M., Mustatea P. Introduction of short straw genes in Romanian triticale germplasm. Romanian Agricultural Research, 2007, 24: 7-10.
- Banaszak Z. Breeding of triticale in DANKO. Tagung der Vereinigung der Pflanzenzüchter und Saatgutkaufleute Österreichs, 2010, 61: 65-68.
- Korshunova A.D., Divashuk M.G., Soloviev A.A., Karlov G.I. Analysis of wheat and rye semidwarfing gene distribution in spring hexaploid triticale (Triticosecale Wittm.) cultivars and breeding lines. Russian Journal of Genetics, 2015, 51(3): 272-277 (doi: 10.1134/s1022795415030072).
- Коршунова А.Д., Дивашук М.Г., Карлов Г.И., Соловьев А.А. Распространение замещения 2R/2D среди сортообразцов яровой гексаплоидной тритикале (× Triticosecale Wittm.). ИзвестияТСХА, 2014, 6: 5-14.
- Bazhenov M.S., Divashuk M.G., Krupin P.Yu., Pylnev V.V., Karlov G.I. The effect of 2D (2R) substitution on the agronomical traits of winter triticale in early generations of two connected crosses. Cereal Research Communications, 2015, 43(3): 504-514 (doi: 10.1556/0806.43.2015.002).
- Thomas S.G. Novel Rht-1 dwarfing genes: tools for wheat breeding and dissecting the function of DELLA proteins. Journal of Experimental Botany, 2017, 68(3): 354-358 (doi: 10.1093/jxb/erw509).
- Bernatzky R., Tanksley S.D. Genetics of actin-related sequences in tomato. Theoretical and Applied Genetics, 1986, 72(3): 314-321 (doi: 10.1007/BF00288567).
- Ellis M., Spielmeyer W., Gale K., Rebetzke G., Richards R. “Perfect” markers for the Rht-B1b and RhtD1b dwarfing genes in wheat. Theoretical and Applied Genetics, 2002, 105: 1038-1042 (doi: 10.1007/s00122-002-1048-4).
- Tenhola-Roininen T., Tanhuanpää P. Tagging the dwarfing gene Ddw1 in a rye population derived from doubled haploid parents. Euphytica, 2010, 172(3): 303-312 (doi: 10.1007/s10681-009-9982-8).
- Смиряев А.В., Кильчевский А.В. Генетика популяций и количественных признаков. М., 2007.
- Ковтуненко В.Я., Тимофеев В.Б., Дудка Л.Ф., Панченко В.В. Селекционная программа по тритикале в краснодарском НИИСХ им. П.П. Лукьяненко. Селекція і насінництво, 2008, 96: 89-97.
- Пинкаль А.В. Зимостойкость и устойчивость к полеганию гибридов озимой тритикале. Омский научный вестник, 2012, 2 (114): 167-172.
- Гольдварг Б.А., Грициенко В.Г., Бораева Л.Н. Озимый тритикале — культура больших возможностей. Сборник научных трудов Всероссийского научно-исследовательского института овцеводства и козоводства, 2007, 2(2-2): 124-128.
- Инновационные сорта и технологии возделывания ярового тритикале: коллективная монография. Владимир, 2017.
- Gale M.D., Salter A.M., Angus F.J. The effect of dwarfing genes on the expression of heterosis for grain yield in F1 hybrid wheat. In: Current options for cereal improvement /M. Maluszynski (ed.). Kluwer Academic, Dordrecht, 1989: 49-62.
- Keyes G., Sorrells M. Rht1 and Rht2 semidwarf genes effect on hybrid vigor and agronomic traits of wheat. Crop Science, 1989, 29: 1442-1447 (doi: 10.2135/cropsci1989.0011183X002900060023x).
- Flintham E., Borner A., Worland A., Gale M. Optimizing wheat grain yield effects of Rht (gibberellin-insensitive) dwarfing genes. The Journal of Agricultural Science, 1997, 128: 11-25 (doi: 10.1017/S0021859696003942).
- Flintham J.E., Gale M.D. Plant height and yield components of inbred isogenic and F1 hybrid dwarf wheat. Journal of Applied Genetics, 1998, 39: 73-83.
- Gale M.D., Youssefian S. Dwarfing genes in wheat. In: Progress in plant breeding /G.E. Russel (ed.). Butterworths and Co., London, 1985, V. 1: 1-35.
- Li X., Lan S., Liu Y., Gale M., Worland T. Effects of different Rht-B1b, Rht-D1b and Rht-B1c dwarfing genes on agronomic characteristics in wheat. Cereal Research Communications, 2006, 34(2-3): 919-924 (doi: 10.1556/CRC.34.2006.2-3.220).
- Chebotar G., Motsnyy I., Chebotar S., Sivolap Y. Effects of dwarfing genes on the genetic background of wheat varieties in Southern Ukraine. Cytology and Genetics, 2012, 46(6): 366-372 (doi: 10.3103/S0095452712060023).
- Hu Y.G. Utilization of dwarfing genes to improve drought tolerance and yield potential in wheat, 2012. Режим доступа: http://www.ub.edu/optichinagriculture/data/uploads/workshop2/present-ations/hu-yin-gang-nwaandfu.pdf. Дата обращения: 20.04.2018.
- Miralles D.J., Katz S.D., Colloca A., Slafer G.A. Floret development in near isogenic wheat lines differing in plant height. Field Crops Research, 1998, 59(1): 21-30 (doi: 10.1016/S0378-4290(98)00103-8).
- Miralles D.J., Slafer G.A. Individual grain weight responses to genetic reduction in culm length in wheat as affected by source-sink manipulations. Field Crops Research, 1995, 43 (2-3): 55-66 (doi: 10.1016/0378-4290(95)00041-N).