doi: 10.15389/agrobiology.2019.5.958rus
УДК 635.21:631.523:631.526.32:632.938.1:577.21
Работа выполнялась при поддержке подпрограммы «Развитие селекции и семеноводства картофеля в РФ» ФНТП развития сельского хозяйства на 2017-2025 годы (№ 0481-2018-0023). Коллекция сортов картофеля, входящая в состав ЦКП УНУ «Коллекция ВИР», образцы которой были использованы в молекулярном скрининге, поддерживалась в рамках программы 0662-2019-0004.
СКРИНИНГ СОРТОВ КАРТОФЕЛЯ (Solanum tuberosum L.) РОССИЙСКОЙ СЕЛЕКЦИИ С ПОМОЩЬЮ МАРКЕРОВ R-ГЕНОВ УСТОЙЧИВОСТИ К Y-ВИРУСУ КАРТОФЕЛЯ
Н.С. КЛИМЕНКО1, О.Ю. АНТОНОВА1, В.В. ЖЕЛТОВА1, Н.А. ФОМИНА1, Л.И. КОСТИНА1, Ф.Т. МАМАДБОКИРОВА2,
Т.А. ГАВРИЛЕНКО1
Картофель (Solanum tuberosum L.) поражают около 40 видов вирусов, из них одним из самых вредоносных является Y-вирус картофеля (Potato virus Y, PVY). У восприимчивых к PVY сортов потери урожая могут достигать 80 %. На современном этапе для создания высокоустойчивых к PVY форм широко применяется метод маркер-опосредованной селекции (marker-assisted selection, MAS), что повышает эффективность селекционного процесса, а также позволяет оценить генетическую защищенность или уязвимость сортового генофонда. У картофеля идентифицирован ряд генов, вовлеченных в контроль разных типов устойчивости к PVY, из них Ry гены, обусловливающие отсутствие накопления вирусных частиц в инфицированном растении независимо от штамма вируса, наиболее часто вовлекаются в селекционные программы в разных странах. В задачу нашей работы входил скрининг 178 сортов отечественной селекции по трем маркерам — STM0003, Ry364, RYSC3, сцепленным с генами Rysto, Rychc и Ryadg, которые были перенесены в селекционный генофонд от диких видов S. stoloniferum и S. chacoense, а также от андийских аборигенных сортов S. tuberosum ssp. andigenum. Для скрининга обширной выборки сортов отечественной селекции маркеры STM0003 и Ry364 привлечены впервые. В результате проведенного нами молекулярного скрининга в выборке из 178 сортов отобрано 39 (21,8 %), у которых выявлены диагностические фрагменты как минимум одного из трех маркеров: у 7,3 % сортов имеется маркер STM0003 гена Rysto, у 11,7 % — маркер Ry364 гена Rychc и у 4,5 % — маркер RYSC3 гена Ryadg. Полученные результаты указывают на невысокую генетическую защищенность изученной выборки от PVY: 78,2 % из 178 сортов не имели ни одного из маркеров, сцепленных с Ry генами устойчивости к этому вирусу. Результаты молекулярного скрининга были сопоставлены с данными об устойчивости/восприимчивости сортов к PVY, взятыми из научных публикаций. Наибольшей диагностической ценностью обладает маркер STM0003, сцепленный с геном Rysto; фактически все сорта с этим маркером были высокоустойчивы (иммунны) к PVY, тогда как маркеры Ry364 и RYSC3 оказались не столь эффективны.
Ключевые слова: картофель, PVY, ДНК маркеры, маркер-опосредовання селекция, MAS, сорта.
Картофель поражают около 40 видов вирусов, относящихся к 13 семействам (1, 2). Из них один из самых вредоносных — Y-вирус картофеля (Potato virus Y, PVY) из рода Potyvirus семейства Potyviridae (1). Растениями-хозяевами PVY в естественных условиях могут быть представители 9 семейств растений, а в экспериментальных условиях — 31 семейства (3). В природе переносчиками этого вируса являются около 60 видов тлей (4, 5). Сочетание многообразия растений-хозяев и переносчиков, а также возможность накопления вирусных частиц в толерантных сортах без видимых признаков заражения растений приводит к ухудшению инфекционного фона и снижению урожайности картофеля (5, 6). У восприимчивых к PVY сортов потери урожая могут достигать 80 % (1, 7, 8). Возделывание устойчивых растений считается наиболее эффективным и экологически безопасным способом защиты от патогенов, поэтому создание высокоустойчивых к вирусным болезням cортов относится к наиболее приоритетным направлениям селекции.
У картофеля идентифицирован ряд генов, контролирующих разные типы устойчивости к PVY, из них наиболее изучены Ny-гены, определяющие реакцию сверхчувствительности (hypersensitive resistance, HR) растений в ответ на инфекцию определенным штаммом, и Ry-гены, которые обусловливают отсутствие накопления вирусных частиц в инфицированном растении независимо от штамма (extreme resistance, ER) (8-12).Таким образом, растения картофеля с Ry геном полностью иммунны к PVY. Устойчивость сортов, несущих Ny-гены, преодолевается активно мутирующим вирусом (13, 14), кроме того, проявление признака устойчивости зависит от температуры среды (15, 16), что особенно критично в условиях меняющегося климата.
Несмотря на то, что иммунные к PVY образцы обнаружены у многих видов картофеля (17), гены, определяющие ER тип устойчивости, интродуцированы в селекционный генофонд в основном от трех видов: тесно сцепленные гены Ryysto/Ry-fsto — от дикого мексиканского вида S. stoloniferum (18-22); Rychc — от аргентинского дикого вида S. chacoense (11, 23) и Ryadg— от устойчивых андийских аборигенных сортов S. tuberosum ssp. andigenum (10, 19, 24). В селекционные программы ряда стран Западной Европы (Германия, Венгрия, Нидерланды, Польша, Шотландия) в качестве источника устойчивости к PVY наиболее часто привлекались образцы S. stoloniferum, на основе которых создано большое число иммунных к этому вирусу сортов (18, 21, 22, 25). Гибридный материал, полученный с участием S. stoloniferum, активно использовался в российской селекции (26-28). Высокоустойчивые к PVY образцы S. tuberosum ssp. andigenum наиболее часто использовались в селекционных программах в США (29, 30), Испании (31) и Перу (32, 33). Cелекционеры Японии для создания высокоустойчивых к PVY сортов чаще всего привлекали образцы S. chacoense (11, 12, 34, 35). Устойчивые образцы S. chacoense активно использовались и в российских селекционных программах (26-28).
На современном этапе для создания высокоустойчивых к PVY сортов картофеля широко применяется маркер-опосредованная селекция (marker assisted selection, MAS) с помощью ДНК маркеров, сцепленных с Ry-генами (внутригенные маркеры пока не разработаны), что повышает эффективность селекционного процесса (31, 34-36). Кроме того, маркеры генов Rysto/Ry-fsto (22, 37-39), Ryadg (38, 40), Rychc (11, 40) применяются для оценки разнообразия селекционного генофонда, предоставляя информацию о генетической защищенности или уязвимости сортов (11, 22, 37-40). Список наиболее часто используемых в MAS маркеров Ry-генов приведен в таблице 1. Отметим, что расстояния между определенным Ry геном и разными маркерами этого гена могут существенно различаться. Например, частота рекомбинации Rychc с RAPD маркером 38-530 составляет 16,3 % (11), а разработанные позднее SCAR маркеры Ry364 и Ry186 фланкируют Rychc на расстоянии 0,085 и 0,203 сМ (12, 41).
В литературе сообщалось о разной диагностической ценности маркеров Ry-генов. Например, K. Witek с соавт. (61) у всех 24 иммунных к PVY польских сортов с геном Ry-fsto, выведенных с участием устойчивых образцов S. stoloniferum, обнаружили три CAPS маркера этого гена (GP122-718, GP122-614 и GP122-564), тогда как у 31 восприимчивого сорта результаты MAS были отрицательными. Однако немецкие исследователи (20), анализируя расщепляющуюся популяцию андрогенных дигаплоидов иммунного сорта Assia, не выявили сцепления маркера GP122-718 с Ry геном устойчивости S. stoloniferum; относительное сцепление (34,9 cM) показал только один маркер — GP81. I. Cernák с соавт. (43) отметили высокую диагностическую ценность SSR маркера STM0003 (сцепление с Rysto 2,95 сМ), тогда как косегрегацию признака устойчивости с CAPS маркерами серии GP (21) в этой работе не обнаружили. Можно предположить, что материал из исследования I. Cernák с коллегами включал рекомбинантные генотипы и их потомство, у которых маркеры серии GP оказались сцепленными с рецессивным аллелем гена устойчивости.
Поиск эффективных маркеров целевых генов остается актуальным в связи с перспективами маркер-опосредованной селекции. В представленном исследовании приведены результаты скрининга обширной выборки сортов картофеля с тремя маркерами — STM0003, Ry364, RYSC3, из них маркер STM0003, ассоциированный с геном Rysto, в скрининг отечественных сортов привлечен впервые, а маркер Ry364 гена Rychc ранее использовался только в одной работе на небольшой выборке российских сортов (42).
В нашу задачу входил скрининг набора сортов отечественной селекции с тремя маркерами — STM0003, Ry364, RYSC3, каждый из которых сцеплен с одним из генов, контролирующих устойчивость к Y-вирусу картофеля.
Методика.Анализируемая выборка включала 178 российских сортов картофеля из коллекции ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова). Сорта относили к устойчивым или восприимчивым к PVY на основе данных научных публикаций и сведений в каталогах сортов (27, 81-84).
Молекулярный скрининг проводили с маркерами трех генов устойчивости — STM0003 (Rysto), RYSC3 (Ryadg) и Ry364 (Rychc).
ДНК выделяли модифицированным методом СТАВ-экстракции (85). Использовали листья растений из полевого генбанка ВИР (предварительно сортовую принадлежность растений верифицировали по комплексу морфологических признаков).
ПЦР проводили в 20 мкл смеси следующего состава: 10 нг ДНК, 1× реакционный буфер («Диалат Лтд», Россия), 2,5 мМ MgCl2, 0,6 мM каждого dNTP, по 0,2 мкM каждого из праймеров (прямого и обратного) и 1 ед. Taq ДНК-полимеразы («Диалат Лтд», Россия) с использованием ДНК-амплификатора Mastercycler® Nexus Gradient («Eppendorf», Германия). Для праймеров RYSC3 и Ry364 температура отжига и ПЦР-про-граммы соответствовали указанным в литературе (12, 68). Для микросателлитного маркера STM0003 протокол включал этап с функцией Touchdown: 3 мин 15 с при 94 °С; 45 с при 94 °С, 1 мин 30 с при 54 °С (каждый следующий цикл с понижением на 0,5 °С), 1 мин при 72 °С (8 циклов); 45 с при 94 °С, 45 с при 50 °С, 1 мин при 72 °С (30 циклов); заключительная элонгация — 5 мин при 72 °С. Все реакции проводили не менее чем в трех повторностях.
В качестве положительных контролей использовали ДНК сортов, для которых наличие диагностических фрагментов маркеров было показано ранее: Ania — для STM0003 (36), Saikai 35 — для Ry364 (12), Эффект — для RYSC3 (64). Отрицательным контролем в ПЦР служила стерильная деионизированная вода.
Ампликоны разделяли в 2 % агарозном геле с окрашиванием бромистым этидием и визуализацией в проходящем УФ-свете (система гель-документирования Gel Doc XR+, «Bio-Rad», США), для определения размера фрагментов использовали маркер молекулярной массы 100 bp + 1500 + 3000 (НПО «СибЭнзим», Россия).
Статистическую обработку полученных данных проводили с помощью t-критерия Стьюдента (уровень значимости р < 0,05).
Результаты. ПЦР-скрининг Ry-генов проводили с известными праймерами (табл. 2)
Результаты молекулярного скрининга 178 сортов представлены на рисунке и в таблице 3. У 39 сортов выборки (21,9 %) присутствовали диагностические фрагменты как минимум одного из трех маркеров. У 21 сорта (11,8 %) обнаружили диагностические фрагменты маркера Ry364298 гена Rychc, у 13 сортов (7,3 %) — маркера STM0003111 гена Rysto и у 8 (4,5 %) — маркера RYSC321 гена Ryadg. У трех сортов (Брянский ранний, Букет, Живица) выявили два маркера одновременно — Ry364 и RYSC3. Подавляющее большинство сортов (78,0 %) не имели ни одного из маркеров Ry-генов (см. табл. 3). Согласно t-критерию Стьюдента, различия в частоте встречаемости сортов с маркерами разных Ry-генов недостоверны, за исключением пары маркеров Ry364 (Rychc) и RYSC3 (Ryadg) — в этих группах частота сортов с маркером Ry364 достоверно выше (р < 0,05).
Из 39 сортов выборки, у которых был обнаружен хотя бы один из трех маркеров Ry-генов (см. табл. 3), для 18 сортов (Брянский ранний, Брянский красный, Вектар, Голубизна, Живица, Колобок, Корона, Лошицкий, Метеор, Москворецкий, Накра, Олимп, Погарский, Резерв, Ресурс, Сокольский, Эффект, Юбилей Жукова) в литературе сообщается о высокой и очень высокой устойчивости к PVY, для 6 сортов (Барин, Зольский, Ильинский, Кристалл, Скарб, Темп) описана средняя устойчивость (26, 27, 81-84). Для остальных 15 сортов информацию о фенотипической устойчивости к PVY в доступной литературе мы не обнаружили. Таким образом, фактически все протестированные сорта с маркером STM0003 гена Rysto были высокоустойчивы (иммунны) к PVY, тогда как среди сортов с маркерами Ry364 и RYSC3 встречались и сорта со средней устойчивостью.
Из 139 сортов, у которых в своем исследовании мы не выявили ни один из трех маркеров генов Ry, только по 43 удалось найти четкие и непротиворечивые данные об устойчивости к PVY. Так, для 17 сортов (Брянский деликатес, Брянский надежный, Гарант, Дружный, Жигулевский, Кортни, Кузнечанка, Ласунак, Любава, Манифест, Никулинский, Одиссей, Призер, Скороплодный, Смена, Фаленский, Чайка) сообщалось о высокой устойчивости к PVY, а для 21 сорта — о средней и низкой (26, 27, 81, 82, 84, 87). Для остальных (101 сорт) таких сведений мы не нашли.
К сожалению, в большинстве сообщений не приводится данных о типе устойчивости к PVY, диагностированной у сортов, — обусловлена ли она отсутствием накопления вирусов в инфицированном растении (ER), реакцией сверхчувствительности (HR), полевой устойчивостью или устойчивостью к переносчикам вирусов. Также не указано, какие именно методы использовались для оценки устойчивости (полевые испытания в условиях массового распространения вирусных болезней или искусственное заражение — механическая инокуляция растений либо испытание прививкой). Поэтому имеющихся сведений явно недостаточно для сопоставления результатов молекулярного скрининга с данными литературы по фенотипизации проявления признака устойчивости к PVY.
Как упоминалось выше, два из трех маркеров — Ry364 (ген Rychc) и STM0003 (ген Rysto) — для всех 178 сортов в молекулярном скрининге использовались впервые. Однако для ряда сортов выборки информация о потенциальном наличии/отсутствии этих генов была получена ранее, но с использованием других маркеров: RAPD маркера 38-530 (ген Rychc), разработанного K. Hosaka с коллегами (11),а также SCAR маркера YES3-3A (22) и CAPS маркера GP122-406/EcoRV (21) генов Rysto/Ry-fsto. Для таких сортов можно сравнить результаты скрининга, проведенного с разными маркерами. Так, диагностический фрагмент 111 п.н. маркера STM0003 гена Rysto мы выявили у 13 сортов (см. табл. 3), у которых ранее был детектирован и другой маркер этого гена — YES3-3А (39, 51), а также маркеры GP122-406 (39, 64) и GP122-564 (37) гена Ry-fsto, тесно сцепленного с Rysto. Таким образом, на материале отечественных сортов результаты применения всех трех маркеров (STM0003, YES3-3А и GP122) Ry-генов, интрогрессированных от S. stoloniferum, полностью совпали. Согласно данным литературы, в родословных 10 из этих 13 сортов присутствуют межвидовые гибриды с S. stoloniferum: Брянский красный, Вектар, Колобок, Корона, Москворецкий, Накра, Погарский, Ресурс, Сокольский, Юбилей Жукова (17, 28, 88, 89). Диагностический фрагмент маркера RYSC3321 встречается редко — мы нашли его у 8 из 178 сортов (см. табл. 3, рис.). Отметим, что о выявлении SCAR маркера RYSC3 гена Ryadg ранее сообщалось для четырех сортов — Эффект (64), Брянский ранний и Голубизна (51), Живица (49). Также в литературе встречаются упоминания об отсутствии маркера RYSC3321 у сортов Октябренок (58) и Ресурс (72). Однако данные об отрицательных результатах MAS с этим маркером единичны и получены на небольших выборках (42, 58, 72).
Обращает на себя внимание обнаружение маркера RYSC3 гена Ryadg у нескольких иммунных к PVY сортов (например, Брянский ранний, Голубизна, Эффект), у которых в родословных указаны гибриды с S. stoloniferum в качестве доноров гена Ry (26). Следовательно, у таких сортов ожидалась детекция маркеров гена Rysto/Ry-fsto, которые, тем не менее, не были выявлены. В этой связи отметим следующее. Маркер RYSC3 считается специфичным для гена Ryadg, картированного на 11-й хромосоме. Однако первоначально сообщалось о картировании на этой хромосоме гена Rysto (90). Позднее в литературе сформировалось мнение об ошибочности локализации гена Rysto на 11-й хромосоме. Другие исследователи (68) определили ген устойчивости к PVY, локализованный на 11-й хромосоме, как Ryadg. Основанием для этого послужило отсутствие совместной сегрегации маркеров гена Rysto и маркера RYSC3 (36), а также тот факт, что у устойчивых сортов картофеля маркер RYSC3 и маркер M45 из работы G. Brigneti с соавт. (90) всегда выявлялись совместно (70). Представляется, однако, вполне вероятным, что на 11-й хромосоме и у S. stoloniferum, и у S. tuberosumssp. andigenum локализован один ген-ортолог, контролирующий устойчивость к PVY и ассоциированный с маркером RYSC3. Действительно, при молекулярном скрининге образцов из коллекции ВИР маркер RYSC3 был детектирован нами у 5 из 8 изученных образцов S. stoloniferum(62,5 %) и только у 2 из 95 образцов S. tuberosum ssp. andigenum (2,1 %) (65).
Судя по данным литературы, межвидовые гибриды с S. chacoense принимали участие ввыведении ряда сортов: Алена, Алиса, Бородянский розовый, Брянский деликатес, Брянский красный, Брянский надежный, Ветеран, Горянка, Крепыш, Луговской, Метеор, Накра, Никулинский, Победа, Сапрыкинский, Сентябрь, Утенок (28, 88, 89), однако в нашей работе маркер Ry364 у этих сортов не был обнаружен. Отметим, что у четырех высокоустойчивых сортов (Брянский деликатес, Брянский надежный, Метеор, Никулинский) ранее детектирован другой маркер гена Rychc— RAPD маркер 38-530 (51). В то же время из 21 сорта с амплификацией диагностического фрагмента Ry364298 гена Rychc только у двух (Бежицкий и Бронницкий) S. chacoense указан в родословных (89). Не исключено, что у исходных межвидовых гибридов с S. chacoense, которые принимали участие в создании устойчивых к PVY отечественных сортов, произошла рекомбинация на участке между геном Rychc и маркером Ry364. Для отбора генотипов с функциональным аллелем Rychc необходимы внутригенные маркеры, которые пока не разработаны.
Итак, полученные результаты позволяют сделать следующие выводы. В нашем исследовании наибольшей диагностической ценностью обладал маркер STM0003, сцепленный с геном Rysto: фактически все сорта с этим маркером высокоустойчивы (иммунны) к Y-вирусу картофеля (PVY), тогда как маркеры Ry364 и RYSC3 оказались не столь эффективны. Результаты MAS указывают на невысокую степень генетической защищенности от PVY у сортов изученной выборки, в которой 78,2 % сортов не имели ни одного из маркеров Ry-генов устойчивости к Y-вирусу картофеля
1. ДНК маркеры Ry-генов устойчивости в Y-вирусу картофеля (PVY), наиболее часто применяемые в молекулярном скрининге |
||
Ген |
Название маркера |
Cсылки |
Rysto(12-я) |
STM0003 (SSR) |
|
YES3-3A (SCAR), YES3-3B (SCAR) |
||
YES3-3A (SCAR) |
||
YES3-3B (SCAR) |
||
Ry-fsto(12-я) |
GP81, GP122, GP204, GP269 (все CAPS) |
|
GP122-718 (CAPS) |
||
GP122-614 (CAPS) |
(36а) |
|
GP122-564 (CAPS) |
||
GP122-406 (CAPS) |
||
Ryadg(11-я) |
RYSC3 (SCAR) |
|
Rychc(9-я) |
Ry186 (SCAR) |
|
38–530 (RAPD) |
||
Ry364 (SCAR) |
||
Примечание. SSR — simple sequence repeat, SCAR — sequence-characterized amplified region, CAPS — cleaved amplified polymorphic sequence, RAPD — random amplification of polymorphic DNA; буквой (а) помечены ссылки на работы, в которых опубликованы данные о разработке этих маркеров. |
||
2. Праймеры, использованные при молекулярном скрининге выборки российских сортов по маркерам Ry-генов устойчивости к Y-вирусу картофеля (PVY) |
|||||
Ген |
Маркер |
Последовательность праймеров (5´→ 3´) |
Tm, |
Диагностический фрагмент |
Разработчик праймеров |
Rysto |
STM0003 |
F: GGAGAATCATAACAACCAG |
50 |
111 п.н. |
|
Ryadg |
RYSC3 |
3.3.3s: ATACACTCATCTAAATTTGATGG |
60 |
321 п.н. |
(68) |
Rychc |
Ry364 |
RY364-14: CTATTATAAGTCTGGTACTAGGACG |
55 |
298 п.н. |
|
3. Результаты молекулярного скрининга 178 российских сортов картофеля (Solanum tuberosum L.) с использованием трех маркеров генов устойчивости к Y-вирусу (PVY) |
|||
Группа сортов по гаплотипу |
Ген/маркер |
||
Rysto/STM0003 |
Ryadg/RYSC3 |
Rychc/Ry364 |
|
I группа, n = 13 (7,3 %) |
|||
Ильинский; |
1 |
0 |
0 |
II группа, n = 3 (1,7 %) |
|||
Букет; |
0 |
1 |
1 |
III группа, n = 18 (10,1 %) |
|||
Имандра, Красная Горка, Лидер, Маугли, Октябренок, Приморский |
0 |
0 |
1 |
IV группа, n = 5 (2,8 %) |
|||
Барин, Зольский, Юбилейный Осетии; |
0 |
1 |
0 |
V группа, n = 139 (78,1 %) |
|||
Аврора, Аксамит, Алена, Алиса, Альпинист, Аметист, Амур, Антошка, Арлекин, Архидея, Бабушка, Барон, Белуха, Болвинский, Большевик, Бородянский розовый, Браво, Брат 2, Брянская новинка, Вармас, Варсна, Веселовский 2-4, Виза, Вираж, Волжский, Вымпел, Вятка, Гарт, Горизонт, Горноуральский, Горянка, Гранат, Губернатор, Диво, Донцовский, Жаворонок, Жуковский ранний, Загадка, Зарево, Зауральский, Звездочка, Здабытак, Искра, Кабардинский, Калинка, Каменский, Камераз, Катюша (Украина), Кемеровский, Кемеровчанин, Колпашевский, Комсомолец 20, Кореневский, Кормилец, Красавица, Красная заря, Красная роза, Красноуфимский, Крепыш, Кустаревский, Ладожский, Лазарь, Лазурит, Лаймдота, Лекарь, Лорх, Луговской, Лыбидь, Люкс, Матс, Матушка, Мурманский, Мусинский, Надежда, Нальчикский, Нарочь, Нарт 1, Нарымка, Наука, Незабудка, Нестеровский, Огниво, Парус, Победа, Престиж, Прибрежный, Пригожий 2, Приекульский ранний, Приобский, Пролисок, Рапсодия, Ромашка, Росинка (Расiнка), Россиянка, Румянка, Русалка, Русич, Рябинушка, Самба, Сапрыкинский, Саровский, Свенский, Светлячок, Сентябрь, Солнышко, Старт, Танго, Теща, Томич, Украинский розовый, Успех, Утенок, Фермер, Филатовский, Фиолетовый, Фокинский, Чая, Шаман, Шурминский 2, Энергия, Юпитер, Явар; |
0 |
0 |
0 |
Число (%) сортов с диагностическим фрагментом маркера |
13 (7,3 %) |
8 (4,5 %) |
21 (11,8 %) |
Примечание. Буквой в верхнем индексе (а) отмечены сорта с нестабильной амплификацией диагностического фрагмента маркера Ry364. |
|||
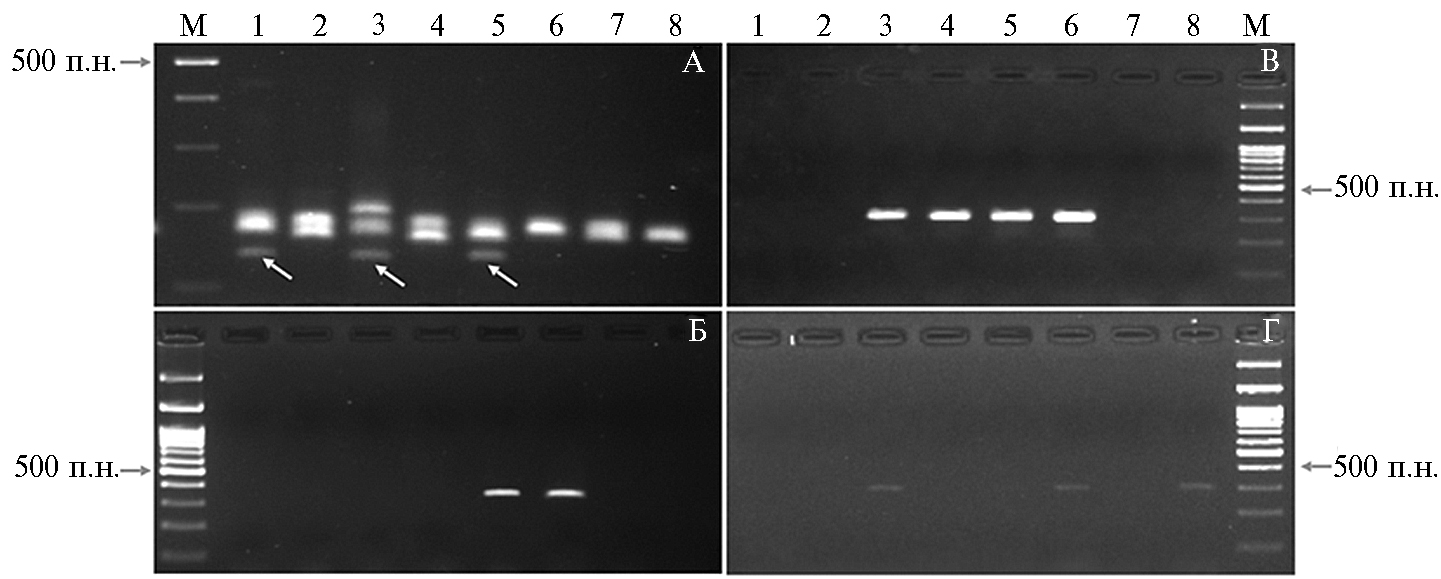
Скрининг российских селекционных сортов картофеля (Solanum tuberosum L.) на наличие маркеров генов устойчивости к Y-вирусу (PVY): А — STM0003 (ген Rysto), Б — RYSC3 (ген Ryadg), В — Ry364 (ген Rychc); Г — пример слабой амплификации диагностических фрагментов маркера Ry364. M — маркер молекулярных масс 100 bp + 1500 + 3000 (НПО «СибЭнзим», Россия).
А, Б, В: 1 — Корона, 2 — Бабушка, 3 — Олимп, 4 — Синтез, 5 — Ресурс, 6 — Северянин, 7 — Аврора, 8 — Веселовский 2-4.
Г: 1 — Аксамит, 2 — Москворецкий, 3 — Скарб, 4 — Эффект, 5 — Голубизна, 6 — Темп, 7 — Барин, 8 — Кристалл.
ЛИТЕРАТУРА
- Valkonen J.P.T. Viruses: economical losses and biotechnological potential. In: Potato biology and biotechnology, advances and perspectives. Elsevier, Oxford, 2007: 619-633 (doi: 10.1016/B978-044451018-1/50070-1).
- Lacomme C., Jacquot E. General characteristics of Potato virus Y (PVY) and its impact on potato production: an overview. In: Potato virus Y: biodiversity, pathogenicity, epidemiology and management /C. Lacomme, L. Glais, D. Bellstedt, B. Dupuis, A. Karasev, E. Jacquot (eds.). Springer, Cham, 2017: 1-19 (doi: 10.1007/978-3-319-58860-5_1).
- Edwardson J.R., Christie R.G. Potyviruses. In: Florida Agricultural Experiment Station Monograph Series 18-II — viruses infecting pepper and other Solanaceous crops. University of Florida, Gainesville, 1997.
- Al-Mrabeh A., Anderson E., Torrance L., Evans A., Fenton B. A literature review of insecticide and mineral oil use in preventing the spread of nonpersistent viruses in potato crops. Potato council, Agriculture and Horticulture Development Board, Stoneleigh Park, United Kingdom, 2010.
- Lacomme C., Pickup J., Fox A., Glais L., Dupuis B., Steinger T., Rolot J.-L., Valkonen J.P.T., Kruger K., Nie X., Modic S., Mehle N., Ravnikar M., Hullé M. Transmission and epidemiology of Potato virus Y. In: Potato virus Y: biodiversity, pathogenicity, epidemiology and management /C. Lacomme, L. Glais, D. Bellstedt, B. Dupuis, A. Karasev, E. Jacquot (eds.). Springer, Cham, 2017: 141-176 (doi: 10.1007/978-3-319-58860-5_6).
- Gray S., De Boer S., Lorenzen J., Karasev A., Whitworth J., Nolte P., Singh R., Boucher A., Xu H.M. Potato virus Y: an evolving concern for potato crops in the United States and Canada. Plant Disease, 2010, 94: 1384-1397 (doi: 10.1094/pdis-02-10-0124).
- Solomon-Blackburn R.M., Barker H. A review of host major-gene resistance to Potato viruses X, Y, A and V in potato: genes, genetics and mapped locations. Heredity, 2001, 86: 8-16 (doi: 10.1046/j.1365-2540.2001.00798.x).
- Solomon-Blackburn R.M., Barker H. Breeding virus resistant potatoes (Solanum tuberosum): a review of traditional and molecular approaches. Heredity,2001, 86(1): 17-35 (doi: 10.1046/j.1365-2540.2001.00799.x).
- Ross H. Inheritance of extreme resistance to virus Y in Solanum stoloniferum and its hybrids with Solanum tuberosum. Proc. of 3rd Conf. on potato virus diseases. Veenman, Lisse-Wageningen,1958: 204-211.
- Muňoz F.J., Plaisted R.L., Thurston H.D. Resistance to potato virus Y in Solanum tuberosum ssp. andigena. American Journal of Potato Research, 1975, 52(4): 107-115 (doi: 10.1007/BF02852043).
- Hosaka K., Hosaka Y., Mori M., Maida T., Matsunaga H. Detection of a simplex RAPD marker linked to resistance to potato virus Y in a tetraploid potato. American Journal of Potato Research, 2001, 78(3): 191-196 (doi: 10.1007/bf02883544).
- Mori K., Mukojima N., Nakao T., Tamiya S., Sakamoto Y., Sohbaru N., Hayashi K., Watanuki H., Nara K., Yamazaki K., Ishii T., Hosaka K. Germplasm release: Saikai 35, a male and female fertile breeding line carrying Solanum Phureja-derived cytoplasm and potato cyst nematode resistance (H1) and potato virus y resistance (Rychc) Genes. American Journal of Potato Research,2012, 89(1): 63-72 (doi: 10.1007/s12230-011-9221-4).
- Valkonen J.P.T. Elucidation of virus-host interactions to enhance resistance breeding for control of virus diseases in potato. Breeding Science, 2015, 65(1): 69-76 (doi: 10.1270/jsbbs.65.69).
- Davie K., Holmes R., Pickup J., Lacomme C. Dynamics of PVY strains in field grown potato: Impact of strain competition and ability to overcome host resistance mechanisms. Virus Research, 2017, 241: 95-104 (doi: 10.1016/j.virusres.2017.06.012).
- Valkonen J.P.T. Novel resistance to four potyviruses in tuber bearing potato species and temperature — sensitive expression of hypersensitive resistance to potato virus Y. Annals of Applied Biology, 1997, 130: 91-104 (doi: 10.1111/j.1744-7348.1997.tb05785.x).
- Szajko K., Chrzanowska M., Witek K., Strzelczyk-Żyta D., Zagórska H., Gebhardt C., Henning J., Marczewski W. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics,2008, 116(2): 297-303 (doi: 10.1007/s00122-007-0667-1).
- Valkonen J.P.T., Gebhardt C., Zimnoch-Guzowska E., Watanabe K.N. Resistance to Potato virus Y in potato. In: Potato virus Y: biodiversity, pathogenicity, epidemiology and management /C. Lacomme, L. Glais, D. Bellstedt, B. Dupuis, A. Karasev, E. Jacquot (eds.). Springer, Cham, 2017: 207-241 (doi: 10.1007/978-3-319-58860-5_8).
- Cockerham G. Potato breeding for virus resistance. Annals of Applied Biology, 1943, 30: 105-108.
- Ross H. Potato breeding — problems and perspectives. In:Fortschritte der Pflanzenzüchtung, 13.Verlag Paul Parey, Berlin & Hamburg, 1986.
- Song Y.-S., Hepting L., Schweizer G., Hartl L., Wenzel G., Schwarzfischer A. Mapping of extreme resistance to PVY (Rysto) on chromosome XII using anther-culture-derived primary dihaploid potato lines. Theoretical and Applied Genetics, 2005, 111(5): 879-887 (doi: 10.1007/s00122-005-0010-7).
- Flis B., Hennig J., Strzelczyk-Żyta D., Gebhardt C., Marczewski W. The Ry-fsto gene from Solanum stoloniferum for extreme resistant to Potato virus Y maps to potato chromosome XII and is diagnosed by PCR marker GP122718 in PVY resistant cultivars. Molecular Breeding, 2005, 15: 95-101 (doi: 10.1007/s11032-004-2736-3).
- Song Y.-S., Schwarzfischer A. Development of STS markers for selection of extreme resistance (Rysto) to PVY and maternal pedigree analysis of extremely resistant cultivars. American Journal of Potato Research, 2008, 85(2): 159-170 (doi: 10.1007/s12230-008-9012-8).
- Asama K., Ito H., Murakami N., Itoh T. New potato variety “Konafubuki”. The Bulletin of Hokkaido Prefectural Agricultural Experiment Stations, 1982, 48: 75-84.
- Valkonen J.P.T., Slack S.A., Plaisted R.L., Watanabe K. Extreme resistance is epistatic to hypersensitive resistance to potato virus Y in a Solanum tuberosum ssp. andigena-derived potato genotype. Plant Disease, 1994, 78: 1177-1180.
- Bradshaw J.E. Potato breeding at the Scottish Plant Breeding Station and the Scottish Crop Research Institute: 1920-2008. Potato Research, 2009, 52: 141-172 (doi: 10.1007/s11540-009-9126-5).
- Яшина И.М., Склярова Н.П., Симаков Е.А. Результаты использования генетических источников из коллекции ВИР в селекции картофеля на устойчивость к болезням и вредителям. Труды по прикладной ботанике, генетике и селекции, 2007, 163: 118-135.
- Яшина И.М. Значение сорта в современных технологиях производства картофеля. Режим доступа: https://refdb.ru/look/1153053-pall.html. Дата обращения 17.10.2019.
- Симаков Е.А., Яшина И.М. Использование межвидовых гибридов-беккроссов в селекции картофеля на устойчивость к патогенам. Мат. конф. «Мировые генетические ресурсы картофеля и их использование в современных направлениях селекции» (к 125-летию со дня рождения Н.И. Вавилова). М., 2012: 52-60.
- Plaisted R.L. Advances and limitations in the utilization of Neotuberosum in potato breeding. In: The production of new potato varieties: technological advances /G.J. Jellis, D.E. Richardson (eds.). Cambridge University Press, Cambridge, 1987: 186-196.
- Sagredo D.B., Mathias R.M., Barrientos P.C., Acuña B.I., Kalazich B.J., Rojas J.S. Evaluation of a SCAR RYSC3 marker of the Ryadg gene to select resistant genotypes to potato virus Y (PVY) in the INIA potato breeding program. Chilean Journal of Agricultural Research, 2009, 69(3): 305-315.
- Ortega F., Lopez-Vizcon C. Application of molecular marker-assisted selection (MAS) for disease resistance in a practical potato breeding programme. Potato Research, 2012, 55: 1-13 (doi: 10.1007/s11540-011-9202-5).
- Mendoza H.A., Jayashinghe U. Progress in breeding for combined resistance to potato viruses Y, X and leafroll. Proc. 12th Trienn Conf EAPR. Paris, 1993: 457-458.
- Mendoza H.A., Mihovilovich E.J., Saguma F. Identification of the triplex (YYYy) potato virus Y (PVY) immune progenitors derived from Solanum tuberosum ssp. andigena. American Journal of Potato Research, 1996, 73(1): 13-19 (doi: 10.1007/BF02849300).
- Sakamoto Y., Mori K., Matsuo Y., Mukojima N., Watanabe W., Sobaru N., Tamiya S., Nakao T., Hayashi K., Watanuki H., Nara K., Yamazaki K., Chaya M. Breeding of a new potato variety “Nagasaki Kogane” with high eating quality, high carotenoid content, and resistance to diseases and pests. Breeding Science, 2017, 67(3): 320-326 (doi: 10.1270/jsbbs.16168).
- Fujimatsu M., Hashizume H., Fudan T., Koma Y., Sanetomo R., Ono S., Hosaka K. Harimaru: a new potato variety for a local specialty. Breeding Science, 2018, 68(2): 284-288 (doi: 10.1270/jsbbs.17109).
- Valkonen J.P.T., Wiegmann K., Hämäläinen J.H., Marczewski W., Watanabe K.N. Evidence for utility of the same PCR-based markers for selection of extreme resistance to Potato virus Y controlled by Rysto of Solanum stoloniferum derived from different sources. Annals of Applied Biology, 2008, 152: 121-130 (doi: 10.1111/j.1744-7348.2007.00194.x).
- Павлючук Н.В., Волуевич Е.А., Маханько В.Л., Русецкий Н.В. Метод мультиплексной ПЦР для поиска генотипов картофеля, устойчивых к Y- и S-вирусам. Картофелеводство, 2013, 21(1): 184-192.
- Bhardwaj V., Sharma R., Dalamu S.A.K., Baswaraj R., Singh R., Singh B.P. Molecular characterization of potato virus Y resistance in potato (Solanum tuberosum L.). Indian Journal of Genetics and Plant Breeding, 2015, 75: 389-392 (doi: 10.5958/0975-6906.2015.00062.0).
- Antonova O.Y., Klimenko N.S., Evdokimova Z.Z., Kostina L.I., Gavrilenko T.A. Finding RB/Rpi-blb1/Rpi-sto1-like sequences in conventionally bred potato varieties. Vavilov Journal of Genetics and Breeding, 2018, 22(6): 693-702 (doi: 10.18699/VJ18.412).
- Li W.L., Guo W., Xiao J.P., Bai L., Guo H.C. Germplasm evaluation and molecular selection of potato (Solanum tuberosum L.) cultivars with disease resistance in China. Czech Journal of Genetics and Plant Breeding, 2017, 53(3): 114-121 (doi: 10.17221/101/2016-CJGPB).
- Takeuchi T., Sasaki J., Suzuki T., Horita H., Hiura S., Iketani S., Fujita R., Senda K. DNA markers for efficient selection of disease and pests resistance genes in potato (in Japanese). In: Hokkaido Nogyo-Shiken-Kaigi-Shiryo 2008. Hokkaido, 2009: 1-26.
- Гавриленко Т.А., Клименко Н.С., Антонова О.Ю., Лебедева В.А., Евдокимова З.З., Гаджиев Н.М., Апаликова О.В., Алпатьева Н.В., Костина Л.И., Зотеева Н.М., Мамадбокирова Ф.Т., Егорова К.В. Молекулярный скрининг сортов и гибридов картофеля северо-западной зоны Российской Федерации. Вавиловский журнал генетики и селекции, 2018, 22(1): 35-45 (doi: 10.18699/VJ18.329).
- Cernák I., Taller J., Wolf I., Fehér E., Babinszky G., Alföldi Z., Csanádi G., Polgár Z. Analysis of the applicability of molecular markers linked to the PVY extreme resistance gene Rysto, and the identification of new markers. Acta Biologica Hungarica,2008, 59(2): 195-203 (doi: 10.1556/abiol.59.2008.2.6).
- Heldak J., Bezo M., Stefunova V., Gallikova A. Selection of DNA markers for detection of extreme resistance to potato virus Y in tetraploid potato (Solanum tuberosum L.) F1 progenies. Czech Journal of Genetics and Plant Breeding, 2007, 43: 125-134 (doi: 10.17221/2074-CJGPB).
- Slater T. National potato breeding program: strategic trait development. Final Report for Horticulture Australia. Horticulture Innovation Australia Limited, Sydney, 2012.
- Schwarzfischer A., Behn A., Groth J., Reichmann M., Kellermann A., Songe Y.-S. Markergestützte Selektion in der praktischen Kartoffelzüchtung — Erfahrungen und Perspektiven. 60. Tagung der Vereinigung der Pflanzenzüchter und Saatgutkaufleute Österreichs 2009. Raumberg-Gumpenstein, 2010: 81-85.
- Lindner K., Behn A., Schwarzfischer A., Song Y.-S. Extreme Y-Resistenz im Aktuellen Deutschen Kartoffelsortiment. Journal Für Kulturpflanzen, 2011, 63(4): 97-103 (doi: 10.5073/JfK.2011.04.01).
- Nie X., Chen H., Zhang J., Zhang Y., Yang J., Pan H., Song W.X., Murad F., He Y.Q., Bian K. Rutaecarpine ameliorates hyperlipidemia and hyperglycemia in fat-fed, streptozotocin-treated rats via regulating the IRS-1/PI3K/Akt and AMPK/ACC2 signaling pathways. Acta Pharmacologica Sinica, 2016, 37(4): 483-496 (doi: 10.1038/aps.2015.167).
- Бекетова М.П., Рогозина Е.В., Чалая Н.А., Хавкин Э.Е. Маркеры генов экстремальной устойчивости к Y вирусу картофеля у дикорастущих видов секции Petota рода Solanum L. Биотехнологиярастений,2018, 4: 99-106 (doi: 10.18384/2310-7189-2018-4-99-106).
- Sharma R., Bhardwaj V., Dalamu D., Kaushik S.K., Singh B.P., Sharma S., Umamaheshwari R., Baswaraj R., Kumar V., Gebhardt C. Identification of elite potato genotypes possessing multiple disease resistance genes through molecular approaches. Scientia Horticulturae,2014, 179: 204-211 (doi: 10.1016/j.scienta.2014.09.018).
- Бирюкова В.А., Шмыгля И.В., Абросимова С.Б., Запекина Т.И., Мелешин А.А., Митюшкин А.В., Мананков В.В. Поиск источников генов устойчивости к патогенам среди образцов селекционно-генетических коллекций ВНИИКХ с использованием молекулярных маркеров. Защита картофеля, 2015, 5: 3-7.
- Бирюкова В.А., Шмыгля И.В., Мелёшин А.А., Митюшкин А.В., Мананков В.В., Абросимова С.Б. Изучение генетических коллекций ВНИИ картофельного хозяйства с помощью молекулярных маркеров. Достижения науки и техники АПК, 2016, 30(10): 22-26.
- Yermishin A.P., Svitoch O.V., Voronkova E.V., Gukasian O.N., Luksha V.I. Determination of the composition and the allelic state of disease and pest resistance genes in potato parental lines using DNA markers. Russian Journal of Genetics, 2016, 52: 498-506 (doi: 10.1134/S1022795416050057).
- Сайнакова А.Б., Романова М.С., Красников С.Н., Литвинчук О.В., Алексеев Я.И., Никулин А.В., Терентьева Е.В. Исследование коллекционных образцов картофеля на наличие генетических маркеров устойчивости к фитопатогенам. Вавиловский журнал генетики и селекции, 2018, 22(1): 18-24 (doi: 10.18699/VJ18.326).
- Шанина Е.П., Сергеева Л.Б., Стафеева М.А., Клюкина Е.М. Применение ДНК-маркеров для оценки исходного селекционного материала картофеля. Достижения науки и техники АПК, 2018, 32(12): 47-49 (doi: 10.24411/0235-2451-2018-11213).
- Рогозина Е.В., Терентьева Е.В., Потокина Е.К., Юркина Е.Н., Никулин А.В., Алексеев Я.И. Идентификация родительских форм для селекции картофеля, устойчивого к болезням и вредителям, методом мультиплексного ПЦР-анализа. Сельскохозяйственная биология, 2019, 54(1): 19-30 (doi: 10.15389/agrobiology.2019.1.19rus).
- Lopez M., Riegel R., Lizana C., Behn A. Identification of virus and nematode resistance genes in the Chilota Potato Genebank of the Universidad Austral de Chile. Chilean Journal of Agricultural Research, 2015, 75(3): 320-327 (doi: 10.4067/s0718-58392015000400008).
- Fulladolsa A.C., Navarro F.M., Kota R., Severson K., Palta J.P., Charkowski A.O. Application of marker assisted selection for Potato virus Y resistance in the University of Wisconsin potato breeding program. American Journal of Potato Research,2015, 92(3): 444-450 (doi: 10.1007/s12230-015-9431-2).
- Лукша В.И., Воронкова Е.В., Гукасян О.Н., Ермишин А.П. Оценка первичных дигаплоидов S. tuberosum на наличие генов устойчивости к болезням и вредителям методом ПЦР-анализа. В сб.: Молекулярная и прикладная генетика. Минск, 2012: 82-87.
- Левый А.В., Воронкова Е.В., Полюхович Ю.В., Ермишин А.П. ДНК-маркеры генов устойчивости к фитофторозу и к Y-вирусу у образцов дикого аллотетраплоидного вида картофеля Solanum stoloniferum. Весці Нацыянальнай акадэміі навук Беларусі. Серыя біялагічных навук, 2017, 2: 46-54.
- Witek K., Strzelczyk-Żyta D., Hennig J., Marczewski W. A multiplex PCR approach to simultaneously genotype potato towards the resistance alleles Ry-fsto and Ns. Molecular Breeding, 2006, 18: 273-275 (doi: 10.1007/s11032-006-9021-6).
- Lopez-Pardo R., Barandalla L., Ritter E., Ruiz de Galarreta J.I. Validation of molecular markers for pathogen resistance in potato. Plant Breeding, 2013, 132: 246-251 (doi: 10.1111/pbr.12062).
- Milczarek D., Plich J., Tatarowska B., Flis B. Early selection of potato clones with resistance genes: the relationship between combined resistance and agronomical characteristics. Breeding Science, 2017, 67: 416-420 (doi: 10.1270/jsbbs.17035).
- Гавриленко Т.А., Афанасенко О.С., Антонова О.Ю., Рогозина Е.В., Хютти А.В., Шувалов О.Ю., Исламшина А.Р., Чалая Н.А. Разработка технологии оценки генетического разнообразия культурных и диких видов картофеля по устойчивости к вирусным заболеваниям и к раку на основе современных молекулярно-генетических и фитопатологических методов (08-04-13747). Мат. конф. РАСХН—РФФИ «Ориентированные фундаментальные исследования и их реализация в АПК России». Сергиев Посад, 2009: 94-100.
- Рогозина Е.В., Шувалов О.Ю., Антонова О.Ю., Гавриленко Т.А. Межвидовое и внутривидовое разнообразие картофеля по устойчивости к Y-вирусу. Сельскохозяйственная биология, 2012, 5: 64-69 (doi: 10.15389/agrobiology.2012.5.64rus).
- Кузьминова О.А., Вологин С.Г., Сташевски З.А., Гимаева Е.А. Маркёр-вспомогательная селекция картофеля на устойчивость к вирусу Y, Globodera rostochiensis Woll. и Synchytrium endobioticum (Schilb.) Percival. Защита картофеля, 2014, 1: 14-15.
- Кузьминова О.А., Вологин С.Г., Сташевски З., Гимаева Е.А. Поиск источников вирусоустойчивости картофеля при помощи молекулярных маркеров. Мат. XV молодежной науч. конф. «Биотехнология в растениеводстве, животноводстве и ветеринарии». М., 2015: 38-39.
- Kasai K., Morikawa Y., Sorri V.A., Valkonen J.P.T., Gebhardt C., Watanabe K.N. Development of SCAR markers to the PVY resistance gene Ryadg based on a common feature of plant disease resistance genes. Genome, 2000, 43(1): 1-8 (doi: 10.1139/g99-092).
- Gebhardt C., Bellin D., Henselewski H., Lehmann W., Schwarzfischer J., Valkonen J.P.T. Marker-assisted combination of major genes for pathogen resistance in potato. Theoretical and Applied Genetics,2006, 112(8): 1458-1464 (doi: 10.1007/s00122-006-0248-8).
- Rizza D.M., Vilaró F.L., Torres D.G., Maeso D. Detection of PVY extreme resistance genes in potato germplasm from the Uruguayan breeding program. American Journal of Potato Research, 2006, 83(4): 297-304 (doi: 10.1007/BF02871590).
- Ottoman R.J., Hane D.C., Brown C.R., Yilma S., James S.R., Mosley A.R., Crosslin J.M., Vales M.I. Validation and implementation of marker-assisted selection (MAS) for PVY resistance (Ryadg gene) in a tetraploid potato breeding program. American Journal of Potato Research,2009, 86(4): 304-314 (doi: 10.1007/s12230-009-9084-0).
- Whitworth J.L., Novy R.G., Hall D.G., Crosslin J.M., Brown C.R. Characterization of broad spectrum potato virus Y resistance in a Solanum tuberosum ssp. andigena-derived population and select breeding clones using molecular markers, grafting, and field inoculations. American Journal of Potato Research, 2009, 86(4): 286-296 (doi: 10.1007/s12230-009-9082-2).
- Neder D.G., Pinto C.A.B.P., Melo D.S., Lepre A.L., Peixouto L. dos S. Seleção de clones de batata com resistência múltipla à pinta preta e aos vírus X e Y. Ciência Rural, 2010, 40(8): 1702-1708 (doi: 10.1590/s0103-84782010000800005).
- Kaushik S.K., Sharma R., Garg I.D., Singh B.P., Chakrabarti S.K., Bhardwaj V., Pandey S.K. Development of a triplex (YYYy) parental potato line with extreme resistance to potato virus Y using marker assisted selection. The Journal of Horticultural Science and Biotechnology,2013, 88(5): 580-584 (doi: 10.1080/14620316.2013.11513009).
- Tiwari J.K., Pandey S.K., Poonam, Chakrabarti S.K., Gopal J., Kumar V. Molecular markers of Ryadg gene and serological assay reveal potato virus Y (PVY) resistance in the tetraploid Indian potato (Solanum tuberosum) germplasm. Indian Journal of Agricultural Sciences, 2013, 83: 397-401.
- Gabriel J., Veramendi S., Pinto L., Pariente L., Angulo A. Associations of molecular markers with diseases resistance, morphological and agronomic characters in potato diploid families (Solanum tuberosum L.). Revista Colombiana de Biotecnología, 2016, 18(1): 17-32 (español).
- Herrera M. del R., Vidalon L.J., Montenegro J.D., Riccio C., Guzman F., Bartolini I., Ghislain M. Molecular and genetic characterization of the Ryadg locus on chromosome XI from Andigena potatoes conferring extreme resistance to potato virus Y. Theoretical and Applied Genetics,2018, 131(9): 1925-1938 (doi: 10.1007/s00122-018-3123-5).
- Mori K., Sakamoto Y., Mukojima N., Tamiya S., Nakao T., Ishii T., Hosaka K. Development of a multiplex PCR method for simultaneous detection of diagnostic DNA markers of five disease and pest resistance genes in potato. Euphytica, 2011, 180(3): 347-355 (doi: 10.1007/s10681-011-0381-6).
- Tomczyńska I., Jupe F., Hein I., Marczewski W., Śliwka J. Hypersensitive response to Potato virus Y in potato cultivar is conferred by the Ny-Smira gene located on long arm of chromosome IX. Molecular Breeding, 2014, 34: 471-480 (doi: 10.1007/s11032-014-0050-2).
- Sato M., Nishikawa K., Komura K., Hosaka K. Potato virus Y resistance gene, Rychc, mapped to the distal end of potato chromosome 9. Euphytica, 2006, 149: 367-372 (doi: 10.1007/s10681-006-9090-y).
- Российские сорта картофеля. Каталог. Чебоксары, 2011.
- Каталог мировой коллекции ВИР. Вып. 809. Картофель. Генетическая коллекция. 2012 г. СПб, 2012.
- Ванягина А.А. Сорта картофеля белорусской селекции. Каталог. Минск, 2018.
- Сорта картофеля российской селекции /Под ред. Е.А. Симакова. М., 2018.
- Gavrilenko T., Antonova O., Shuvalova A., Krylova E., Alpatyeva N., Spooner D.M., Novikova L. Genetic diversity and origin of cultivated potatoes based on plastid microsatellite polymorphism. Genetic Resources and Crop Evolution, 2013, 60(7): 1997-2015 (doi: 10.1007/s10722-013-9968-1).
- Milbourne D., Meyer R.C., Colli A.J., Ramsay L.D., Gebhardt C., Waugh R. Isolation, characterisation and mapping of simple sequence repeat loci in potato. Molecular and General Genetics MGG,1998, 259(3): 233-245 (doi: 10.1007/s004380050809).
- Анисимов Б.В., Еланский С.Н., Зейрук В.Н., Кузнецова М.А., Симаков Е.А., Склярова Н.П., Филиппов С.Н., Яшина И.М. Сорта картофеля, возделываемые в России. Каталог 2013. М., 2013.
- Симаков Е.А., Анисимов Б.В., Склярова Н.П., Яшина И.М., Еланский С.Н. Сорта картофеля, возделываемые в России. Каталог 2005. Ежегодное приложение к газете «Картофелевод». М., 2005.
- Каталог мировой коллекции ВИР. Вып. 829. Селекционные сорта картофеля России и СНГ. СПб, 2015.
- Brigneti G., Garcia-Mas J., Baulcombe D.C. Molecular mapping of the potato virus Y resistance gene Rysto in potato. Theoretical and Applied Genetics, 1997, 94(2): 198-203 (doi: 10.1007/s001220050400).