doi: 10.15389/agrobiology.2019.5.892rus
УДК 633.18:581.14:577.21
Работа выполнена при поддержке гранта РНФ (№ 19-16-00064).
МОЛЕКУЛЯРНОЕ МАРКИРОВАНИЕ ЛОКУСОВ, ОПРЕДЕЛЯЮЩИХ ВЫСОКИЕ ТЕМПЫ РОСТА НА НАЧАЛЬНЫХ ЭТАПАХ РАЗВИТИЯ РАСТЕНИЙ У РОССИЙСКИХ СОРТОВ РИСА (Oryza sativa L.)
Е.М. ХАРИТОНОВ1, Ю.К. ГОНЧАРОВА1, С.В. ГОНЧАРОВ2, В.Н. БРУЯКО1
Высокая скорость роста — признак, который в значительной степени определяет физиологические преимущества гетерозисных гибридов различных культур. Быстрое развитие листового аппарата и корневой системы обеспечивает высокую эффективность фотосинтеза и минерального питания. Гетерозисные гибриды быстро проходят фазу, характеризующуюся низкой устойчивостью к абиотическим стрессовым факторам, что значительно снижает вероятность повреждения всходов. Скорость роста связана с генами, определяющими высоту растения. Наследуемость признаков, характеризующих эффективность роста проростка, его массу и длину корня и стеблей, составляет 87-90 %. В настоящей работе мы впервые обнаружили локусы, определяющие формирование признака скорость роста в период прорастания у отечественных сортов риса (Oryza sativa L.). Целью работы было выявление локусов и хромосомных регионов, а также изучение генетики признаков, обусловливающих быстрое получение и развитие всходов риса. Опыты проводили в 2013-2019 годах. Коллекционные образцы (32 сорта российской селекции) и гибриды риса изучали общепринятыми методами. Семенной материал обрабатывали 20 % стерилизующим раствором (гипохлорит натрия с содержанием активного хлора 95,2 %, ООО «Гринфилд РУС», Россия) в течение 40 мин с целью стерилизации. Проращивали по 30 зерновок каждого образца (в 2 повторностях) при температуре 28-29 °С в термостате в течение 7 сут. У 20 растений каждого сорта или гибрида определяли массу проростка, размеры колеоптиля и зародышевого корня. Гибридизацию между сортами с контрастными признаками проводили твелл-методом (метод Борлоуга) по полной диаллельной схеме. Полиморфизм изучали с помощью 60 нейтральных или ассоциированных с высокой скоростью роста проростков SSR маркеров, распределенных по 12 хромосомам риса. Массу проростков российских сортов определяли локусы, расположенные на четырех хромосомах. Выявлены маркеры, позволяющие изучить их полиморфизм: RM261, RM405, RM463, RM242, RM6314, RM289, RM126. Два хромосомных региона на 4-й и 9-й хромосомах обусловливали длину зародышевого корня, а высоту проростка — локус на 5-й хромосоме, расположенный в районе маркера RM289. Показана возможность упростить методику выявления хромосомных регионов, детерминирующих величину признаков, при изучении неизвестных образцов. Для выявления маркеров с максимальным фенотипическим эффектом проявления признаков можно использовать групповую селекцию (bulk breeding). Для этого нет необходимости создавать популяции для маркирования признака типа рекомбинантных инбредных линий (recombinant inbred lines, RILs) или дигаплоидных линий (doubled haploid, DН) и фенотипировать их. Гораздо больше информации дает использование сортов, контрастных по признаку, что в короткие сроки позволяет определить наиболее важные для формирования признака локусы. Полученная информация позволит установить маркеры, тесно сцепленные с генами, определяющими признак в выявленном хромосомном регионе (http://www.gramene.org). В дальнейшей работе можно использовать именно эти маркеры, если изучение полиморфизма подтвердит возможность достоверного разделения сортов с их помощью на контрастные группы. Таким образом, у отечественных сортов риса нами установлены восемь хромосомных регионов, связанных с темпами роста, и предложена методика, упрощающая их выявление.
Ключевые слова: Oryza sativa L., рис, молекулярное маркирование, генетика, темпы роста, начальные фазы развития, проростки, масса, высота, зародышевые корни.
Одна из важных агрономических особенностей риса, предназначенного для прямого посева, — высокие темпы роста побега, которые обеспечивают растениям преимущество как при затоплении, так и при дефиците влаги. Установлено, что темпы роста могут быть индикатором высокой продуктивности и наличия гетерозисного эффекта (1, 2). Однако на разных популяциях получены неодинаковые результаты картирования генов, отвечающих за скорость роста.
Значительный межсортовой и межподвидовой полиморфизм определяет эффективность селекционной работы по созданию сортов риса (3). Высокие темпы роста связаны с генами, определяющими высоту растения (4). Наследуемость высоты проростка, его массы, и длины зародышевого корня составляет 87-90 % (5). Признаки, характеризующие проросток, взаимосвязаны, о чем свидетельствует высокая корреляция между ними (6), но их генетика практически не изучена (7, 8). Высота всходов при разных режимах выращивания контролируются несколькими генами, однако отмечена низкая корреляция между данными, полученными при контрастных температурах (9). Полевая всхожесть и темпы роста сортов подвида indica в холодных условиях невысокие, поэтому выявление генов, которые влияют на скорость роста проростков при низких температурах, важно для селекции сортов этого подвида (10). Показана связь генов, определяющих хлороз всходов риса, вызванный холодом, с локусами, отвечающими за темпы роста. В этом процессе участвуют локусы, определяющие гормональный статус проростков, в том числе вовлеченные в биосинтез гиббереллина. Повышенное содержание хлорофилла также способствует увеличению темпов роста всходов, ускоряя образование и накопление углеводов (11). Высокая концентрация сахарозы, глюкозы и активность амилазы в прорастающих семенах служат предпосылками для быстрого роста проростков (12, 13). Высокопродуктивные формы в большинстве случаев имеют более длинную и разветвленную корневую систему на начальных этапах развития растения (14, 15). Пятисуточные проростки риса характеризуются максимальными различиями по этому признаку (16).
Скорость формирования органов проростка определяется эффективностью фотосинтеза и минеральным питанием на ранних этапах развития. Кроме того, улучшение питания молодого растения также повышает его устойчивость к биотическим и абиотическим стрессам (17, 18).
У проростков гибридов с эффектом гетерозиса высокую скорость роста обусловливает сверхэкспрессия генов. Отметим, что сверхэкспрессия генов, определяющих скорость деления клеток, начало репликации, транскрипцию, трансляцию, рассматривается как один из возможных механизмов, обеспечивающих гетерозисный эффект. При изучении почти 14 тыс. генов сверхэкспрессия была характерна более чем для 15 %, причем экспрессия 9 % генов оказалась в 2 раза выше, чем у родителей. Повышенная экспрессия отмечена для регуляторных и структурных генов. В этот процесс вовлечена гормональная регуляция, метаболизм углеводов и митохондриальная активность (19, 20). Полученные данные позволяют предположить, что при гибридизации стартовое преимущество гибридов F1 может быть обусловлено уменьшением эффектов метилирования, которые повышают экспрессию локусов, способствующих гетерозису. Гетерозисные гибриды отличаются от родительских форм рядом эпигенетических изменений генома, среди которых метилирование или снятие этого эффекта. Оптимальное протекание биохимических реакций, вызываемое изменением функционального состояния генов, и каскадные реакции в полигенных структурах отвечают за гетеротический ответ гибридного генома (21).
Высокие темпы метаболизма и роста проростков также обеспечивают сортам стабильность урожайности за счет быстрого прохождения наиболее чувствительных к стрессам фаз. Такие признаки полезны и с точки зрения формирования дружных всходов на затопляемых и не выровненных чеках, поскольку высокая скорость прохождения слоя воды проростками обеспечивает жизнеспособность растений риса (22). Генетика этих признаков изучалась при проращивании семян в течение 5 сут из-под слоя воды (20 см) в темноте. В работе использовали гибриды между образцами подвида indica или межподвидовые гибриды. При создании высокопродуктивных сортов риса контроль признаков, участвующих в получении дружных всходов, может обеспечиваться пирамидированием нескольких положительных QTLs, вклад которых в формирование признака и фенотип особи незначителен.
Генплазма подвида japonica долгое время не использовалась для выявления генов устойчивости к прорастанию в бескислородной среде и картирования QTLs (quantitative trait loci), определяющих формирование этих признаков (23). Впервые такие опыты выполнили китайские ученые. Y. Wang с соавт. (24) изучили 247 рекомбинантных инбредных линий (recombinant inbred lines, RILs), которые были производными гибрида двух форм подвида japonica — сорта Xiushui 79 и линии-восстановителя С Bao, а также 98 беккроссных инбредных линий (backcross inbred line, BIL), полученных от скрещивания Nipponbare (japonica)/Kasalath (indica)//Nipponbare (japonica). Два соответствующих QTLs были обнаружены на 2-й и 7-й хромосомах в популяции RIL. Положительный аллель qSAT-1-R, полученный от сорта С Bao, определял 8,7 % фенотипической дисперсии по длине колеоптиля. С аллелем qSAT-2-R (размер продукта амплификации 140 п.н.) был тесно сцеплен SSR маркер RM525, с которым связано 9,8 % фенотипической дисперсии. Его положительный аллель также принадлежал сорту С Bao. С SSR маркером RM418 оказался тесно сцеплен локус qSAT-7-R (размер продукта амплификации 250 п.н.) (24). Шесть QTLs по признаку длина колеоптиля в бескислородной среде обнаружили в популяции BIL на 2-й, 3-й, 5-й, 8-й, 9-й и 12-й хромосомах. Эти QTLs обусловливали от 5,8 до 16,2 % фенотипического проявления признака. Сорт Nipponbare несет положительные аллели генов qSAT-2-B, qSAT-3-В и qSAT-9-B. Образцу Kasalath принадлежат положительные аллели локусов qSAT-5-B, qSAT-8-В и qSAT-12-B. У образца Kasalath колеоптиль был в среднем более чем на 11 мм длиннее, чем у сорта Nipponbare, у которого этот показатель составлял 5,5 мм. Величина признака у гибридов Kasalath/Nipponbare — 6,4±1,3 мм, коэффициент вариации — 20,2 %. Один QTL, связанный с длиной стебля проростка, был локализован между RM525 и RM2127. Этот локус qCL-2-R определяет 5,2 % фенотипической вариабельности. Его положительный аллель принадлежит Xiushui 79. Найдены QTLs, связанные с длиной стебля проростка, на четырех других хромосомах, однако их вклад не превышал 10 %. Локус qCL-1-B гибриды получали от родительской формы Nipponbare (24).
В других работах c использованием для молекулярного маркирования популяций рекомбинантных инбредных линий (RILs) обнаружено пять QTLs, определяющих длину колеоптиля при стрессе (недостатке кислорода). Они расположены на 1-й, 2-й, 5-й, 5-й и 7-й хромосомах. Позитивные аллели генов qAG-1, qAG-G2 и qAG-7, увеличивающих скорость прорастания в бескислородной среде (anoxic growth, AG), несет сорт Kinmaze. Локусы qAG-5a и qAG-5b унаследованы от образца DV85. RILs получили при скрещивании Kinmaze (japonica) и DV85 (indica). При фенотипировании признака для последующего статистического анализа использованы средние значения длины колеоптиля (25-27).
С точки зрения методики проведения опытов необходимо учитывать, что время прорастания увеличивается при снижении температуры (11). При предварительном замачивании (прайминге) семян (на 24 ч или 48 ч при 20 °C и на 12 ч при 30 °С) время прорастания уменьшается. Так, замачивание семян в течение 12 ч при 30 °C сокращает длительность прорастания почти на 18 ч по сравнению с контролем. Меньшее время прорастания характерно также для образцов, подвергшихся предварительному замачиванию с последующим высушиванием. Кроме того, прайминг повышает единообразие в скорости роста образцов (28).
В настоящей работе мы впервые выявили локусы, определяющие скорость роста в период прорастания, у отечественных сортов риса.
Нашей целью был поиск локусов и хромосомных регионов, обусловливающих быстрое получение и развитие всходов у риса, а также изучение генетики этих признаков.
Методика. Опыты проводили в 2013-2019 годах. Коллекционные образцы (32 сорта российской селекции) и гибриды риса (Oryza sativa L.) изучали общепринятыми методами (16). Гибридизацию между сортами отечественной селекции с контрастными признаками проводили твелл-методом (метод Борлоуга) по полной диаллельной схеме (29).
Семенной материал обрабатывали 20 % стерилизующим раствором Белизны (бытовой препарат Белизна — гипохлорит натрия с содержанием активного хлора 95,2 %, «ООО Гринфилд РУС», Россия) в течение 40 мин. Проращивали по 30 зерновок каждого образца (в 2 повторностях) при температуре 28-29 °С в термостате в течение 7 сут. У 20 растений каждого сорта или гибрида определяли массу проростка, размеры колеоптиля и зародышевого корня.
ДНК выделяли из этиолированных проростков и листьев с помощью STAB-метода в различных модификациях. Полиморфизм изучали с 60 нейтральными или сцепленными с высокой скоростью роста проростков SSR маркерами, распределенными по 12 хромосомам риса. При маркировании образцов использовали стандартные условия полимеразной цепной реакции (ПЦР) для объема реакционной смеси 10 мкл (30) и следующий режим амплификации (ДНК-амплификатор Multibaсk System, «Bio-Rad», США): 5 мин при 94 °C (начальная денатурация); 1 мин при 94 °C (денатурация), 1 мин при 55 °C (отжиг праймеров), 2 мин при 72 °C (синтез) (35 циклов); 7 мин при 72 °C. ПЦР смесь включала 40 нг ДНК (2 мкл), 1 мкл dNTPs (1 мM), 3,7 мкл Н2О, 1 мкл буферного раствора, 0,3 мкл MgCl2; 1 мкл праймеров, 1 мкл Taq ДНК-полимеразы (ЗАО «Евроген», Россия). ПЦР и визуализацию продуктов амплификации выполняли по методике Международного исследовательского института риса (International Rice Research Institute, Филиппины) (9). Продукты амплификации разделяли электрофорезом в полиакриламидном геле при 100 В в электрофоретической камере на 204 образца («C.B.S. Scientific», США).
Для дисперсионного анализа использовали относительный размер продукта амплификации при работе с соответствующим маркером. Размер продукта амплификации у образца с его минимальным значением принимали за единицу, остальные аллели обозначали в соответствии с увеличением размера продукта амплификации. Для морфофизиологических признаков рассчитывали средние (M) и их стандартные ошибки (±SEM). Взаимосвязь данных по генотипированию и фенотипированию признака анализировали после статистической обработки, которую проводили в программе Statistica 6.0 («StatSoft, Inc.», США) с использованием дисперсионного и кластерного анализа (31). Достоверность различий оценивали по F-критерию Фишера и уровню значимости p.
Результаты. Использованные нами маркеры приведены в таблице 1.
Большинство изученных в работе гибридов характеризовались гетерозисом по скорости роста, следовательно, в изучаемой популяции высокие темпы роста были доминантным признаком. Они обеспечивали высокую продуктивность гибридов, о чем свидетельствует величина коэффициента корреляции r > 0,9 между признаками, определяющими продуктивность (масса зерна с растения, масса главной метелки, масса боковых метелок, число выполненных колосков) и связанными со скоростью роста проростка. Анализ данных по методу Хеймана показал, что величина признака определяется полигенами, а также ненаправленностью доминирования, то есть существованием как доминантных, так и рецессивных генов, увеличивающих признак у изучаемых сортов (16, 32).
Характеристика проростков позволила разделить образцы на группы, достоверно (p < 0,05) различающиеся по морфофизиологическим признакам (табл. 2).
Мы провели маркирование в контрастных по признаку группах для анализа аллельного разнообразия в локусах. Большинство маркеров, которые, по данным других авторов, связаны с темпами роста проростков, при изучении российского генофонда оказались мономорфными или их полиморфизм не был связан с формированием признака (рис. 1).
Для выявления хромосомных регионов, определяющих характеристики проростков у отечественных сортов риса, был выполнен дисперсионный анализ взаимосвязи размеров и массы проростков с аллельным разнообразием локусов. В результате выявили 10 микросателлитных маркеров, полиморфизм которых был достоверно (p < 0,05) связан с изменением размеров всходов (табл. 3).
Мы также проанализировали (табл. 4) имеющиеся сведения о связи выявленных нами маркеров с локусами, отвечающими за какие-либо признаки у растений риса (http://www.gramene.org). Ранее в этих хромосомных локусах уже были обнаружены гены, ассоциированные с формированием корневой системы и энергией прорастания. В районе локализации маркеров расположены гены, определяющие энергию прорастания, устойчивость к засухе, толерантность к низким температурам, число корней, соотношение длины корней и стеблей, относительную массу корней, стабильность клеточных мембран в условиях стресса. Формирование стебля, по нашим данным, определяли локусы, расположенные в районе маркера RM289. В зоне его локализации расположены гены скорости прорастания, высоты растения (33). Различия кластеров сортов с контрастными темпами роста проростка были достоверны для маркеров RM261, RM405, RM463, RM242 и RM6314, расположенных соответственно на 4-й, 5-й, 12-й, 9-й и 4-й хромосомах (см. табл. 4). В районе расположения этих маркеров описаны локусы, связанные с толерантностью к недостатку влаги, числом корней, резистентностью к низким температурам, длиной корневой системы и главной метелки, дифференциацией эксплантов, относительной массой корневой системы, скоростью образования проростков, стабильностью мембранного комплекса образца (33).
Мы обнаружили взаимосвязь темпов роста проростка со многими локусами, определяющими адаптивность к абиотическим стрессам. Это ожидаемый результат, поскольку высокая скорость образования корневой и фотосинтетической систем определяет меньшую зависимость проростка от внешних факторов, повышая его адаптивность. Быстрое прохождения всходами фаз, на которых молодые растения максимально чувствительны к стрессу, также сокращает вероятность их повреждения экстремальными температурами или другими факторами, снижающими жизнеспособность (16).
Эффективность использования выявленных маркеров для кластеризации сортов была неодинакова, большинство из маркеров позволяли выделить только наиболее контрастные группы. Например, маркеры RM242, RM463 и RM6314 можно было использовать только для выявления образцов 1-й группы с наиболее интенсивным проявлением признака. RM126 и RM242 позволили достоверно идентифицировать две группы образцов — с максимальным и минимальным значением признака (рис. 2).
Результат исследования можно считать закономерным, так как изучаемые признаки наследуются полигенно. Локусы с разнонаправленными эффектами, компенсирующими действие друг друга, не позволяют идентифицировать работу отдельных генов, определяющих признак. Локализованные впервые хромосомные регионы, связанные с быстрым формированием всходов, в дальнейшем позволят разработать методику маркер-вспомогательной селекции для российских образцов.
Формирование признаков и эффективность работы многих генов, определяющих темпы роста, зависят от фотосинтетической деятельности растения и минерального питания. Следовательно, для селекции по темпам роста нужен контроль не только тех локусов и генов,которые напрямую связаны со скоростью роста проростка, но и комплексов, определяющих эффективность фотосинтеза, минерального питания, активность ряда ферментов, адаптивность к стрессам.
В связи c небольшим размером выборки и числом маркеров мы смогли выявить только локусы с максимальным фенотипическим эффектом. Маркеров, позволяющих достоверно разделить группы сортов по общему и относительному содержанию хлорофилла на принятом в биологических исследованиях уровне значимости (р ≤ 0,05), мы не обнаружили. Снижение уровня значимости до р £ 0,09 повысило порог чувствительности метода и все же дало возможность выделить несколько маркеров, которые могут быть связаны с указанными признаками. Сведения о локализации генов, собранные на сайте http://www.gramene.org, позволяют не только использовать в работе известные маркеры, но и проверить полученные данные, поскольку связь выявленных хромосомных регионов с изучаемыми признаками, установленная ранее, косвенно подтвердила наши результаты.
Маркеры RM245, RM162, RM154, RM240, выделенные нами как информативные, являются внутригенными для признаков, определяющих эффективность фотосинтеза (38). Разделение признака на его составляющие позволило установить, что маркер RM509 связан с содержанием хлорофилла a. Данных об ассоциации маркеров RM5361, RM5707, RM5508, RM347, RM509, RM600, RM574, расположенных на 5-й, 2-й, 7-й, 3-й, 5-й, 1-й хромосомах и связанных с разделением отечественных сортов на группы с различной эффективностью фотосинтеза, с какими-либо признаками фотосинтеза в литературе мы не обнаружили. Маркеры с четырехзначными номерами относительно новые, их редко использовали в работах. Возможно, в районе этих маркеров расположены гены, специфичные для российского генофонда.
О маркерах RM574 и RM600 известно, что они связаны с эффективностью минерального питания, которая в значительной степени определяет изучаемые нами признаки — скорость роста и фотосинтез (33). При дефиците фосфора, калия, магния нарушаются фотохимические и темновые реакции фотосинтеза. Показано, что внесение азотных удобрений усиливает фотосинтетическую деятельность растений (16). Многие соединения, функционирующие как переносчики электронов, содержат железо (цитохромы, ферредоксин) или медь (пластоцианин). Естественно, что при недостатке этих элементов интенсивность фотосинтеза снижается (33, 38).
Наши результаты свидетельствуют о возможности упрощенного выявления хромосомных регионов, определяющих величину признаков, при изучении неизвестных образцов. На этапе, когда локализованы тысячи генов, для выявления маркеров, ассоциированных с максимальным желаемым фенотипическим эффектом, можно использовать групповую селекцию (bulk breeding). Для этого нет необходимости создавать и фенотипировать популяции по типу рекомбинантных инбредных линий (RILs) или дигаплоидных линий (DH), что требует нескольких лет работы. Гораздо больше информации дает использование сортов, контрастных по признаку. Это позволяет в короткие сроки определить наиболее важные для его формирования локусы у всей изучаемой группы сортов. Такая информация позволит установить маркеры, тесно сцепленные с генами, определяющими признак в выявленном хромосомном регионе. В дальнейшей работе можно использовать именно эти маркеры, если изучение их полиморфизма подтвердит возможность достоверного разделения сортов на контрастные группы. Эта предварительная работа необходима, поскольку не всегда гены, дифференцирующие сорта по какому-либо признаку в одном районе мира, эффективны для другого, в котором признак может определяться совершенно другими локусами.
Анализ работ других авторов показал что локусы, связанные с формированием всходов, локализованы на всех хромосомах риса, причем у разных образцов они неодинаковы. Для маркирования использовались дигаплоидные и рекомбинантные или беккроссные инбредные линии, гибриды второго и третьего поколений (от 80 до 2800 образцов) (24, 34, 35). Результативность исследований также различалась. Увеличение объема популяции не гарантирует повышения эффективности маркирования. Например, в популяции F2 при объеме выборки 2810 образцов авторами был выявлен один локус, тогда как в популяции из 191 RILs — 15 локусов (36, 37). Очень важно подобрать в качестве родительских форм максимально контрастные образцы. В нашей работе были выявлены локусы на 4-й, 5-й, 9-й и 12-й хромосомах. Локус на 9-й хромосоме участвовал в формировании признаков масса проростка и длина колеоптиля, два локуса были обнаружены на 5-й хромосоме, три — на 4-й, один — на 12-й. О локусах qCTS-9 и qCTS-12 со значительным фенотипическим эффектом (от 5,5 до 22,4 %) на 9-й и 12-й хромосомах ранее сообщали китайские и индийские ученые, работавшие преимущественно с популяциями на основе межподвидовых гибридов (34, 35). На 5-й и 4-й хромосомах у подвида indica также было обнаружено от одного до трех локусов, влияющих на формирование признаков (25, 37). Выявляемые наиболее часто локусы на 1-й, 2-й, 8-й хромосомах не были связаны с полиморфизмом по изучаемому признаку в популяции отечественных образцов риса, для которых многие локусы, сцепленные с ростовыми параметрами, были мономорфны, что объясняется продолжительной целенаправленной селекцией (33).
Таким образом, впервые для российского генофонда риса нами установлены восемь хромосомных регионов, связанных с темпами роста, и предложена методика, упрощающая их выявление при изучении неизвестных образцов. Для обнаружения маркеров с максимальным фенотипическим эффектом можно использовать групповую селекцию (bulk breeding) и сорта, контрастные по признаку. Это позволит установить маркеры, тесно сцепленные с генами, определяющими признак в выявленном хромосомном регионе (http://www.gramene.org). Если изучение полиморфизма подтвердит возможность достоверного разделения сортов на контрастные группы с помощью таких маркеров, их можно применять в дальнейшем. В результате нашего исследования установлено, что массу проростков российских сортов определяют локусы, которые находятся в районах расположения маркеров RM261, RM6314, RM405, RM242 и RM463 соответственно на 4-й, 5-й, 9-й и 12-й хромосомах риса. Два хромосомных региона на 4-й и 9-й хромосомах (RM126, RM242) обусловливали длину зародышевого корня, локус на 5-й хромосоме, расположенный в районе маркера RM289, — высоту проростка. Разработанная в этом исследовании методика применима для картирования локусов количественных признаков других культур.
1. Распределение по хромосомам риса (Oryza sativa L.) SSR маркеров, |
||
Хромосома |
Число |
Маркеры, расположенные на хромосоме |
1-я |
5 |
RM104, RM259, RM600, RM5638, RM24 |
2-я |
7 |
RM53, RM154, RM240, RM318, RM322, RM2770, RM5707 |
3-я |
3 |
RM227, RM347, RM218 |
4-я |
9 |
RM124, RM127, RM140, RM255, RM261, RM317, RM335, RM3276, RM6314 |
5-я |
9 |
RM13, RM30, RM289, RM405, RM440, RM509, RM574, RM5361, RM6024 |
6-я |
6 |
RM141, RM162, RM276, RM588, RM5371, RM6811 |
7-я |
5 |
RM82, RM542, RM5508, RM7110, RM11 |
8-я |
6 |
RM25, RM126, RM256, RM284, RM3155, RM8243 |
9-я |
4 |
RM242, RM245, RM444, RM7048 |
10-я |
2 |
RM258, RM590 |
11-я |
2 |
RM286, RM3428 |
12-я |
2 |
RM463, RM6410 |
Примечание. Информация доступна на сайте http://www.gramene.org (32). |
||
2. Полиморфизм сортов риса (Oryza sativa L.) российской селекции по морфофизиологическим признакам (М±SEM, лабораторные тесты, 2013-2015 годы) |
||||||
Сорт |
Масса проростка, г |
Группа |
Длина зародышевого корешка, см |
Группа |
Длина колеоптиля, см |
Группа |
Лиман |
1,08±0,0038e |
5-я |
0,9+0,0009g |
2-я |
5,5+0,018k |
1-я |
Гарант |
1,11+0,0021e |
5-я |
0,6+0,0013i |
4-я |
3,8+0,190m |
3-я |
Павловский |
1,12+0,0011d |
4-я |
0,8+0,0008h |
3-я |
0,7+0,092o |
5-я |
Рапан |
1,13+0,0007d |
4-я |
0,5+0,0010j |
5-я |
2,5+0,057n |
4-я |
Снежинка |
1,14+0,0018d |
4-я |
1,0+0,0013g |
2-я |
4,0+0,126l |
2-я |
Приморский |
1,14+0,0045d |
4-я |
1,0+0,0020g |
2-я |
2,2+0,200n |
4-я |
Регул |
1,25+0,0031d |
4-я |
0,8+0,0011h |
3-я |
2,6+0,067n |
4-я |
Атлант |
1,25+0,0022d |
4-я |
0,8+0,0019h |
3-я |
3,3+0,155m |
3-я |
Лидер |
1,26+0,0033c |
3-я |
0,7+0,0006h |
3-я |
2,9+0,094n |
4-я |
Хазар |
1,27+0,0041c |
3-я |
0,8+0,0015h |
3-я |
3,9+0,066m |
3-я |
Новатор |
1,27+0,0049c |
3-я |
0,7+0,0020i |
4-я |
2,5+0,137n |
4-я |
Изумруд |
1,29+0,0050c |
3-я |
0,9+0,0008g |
2-я |
3,0+0,093m |
3-я |
Курчанка |
1,33+0,0015c |
3-я |
1,0+0,0012g |
2-я |
5,1+0,095k |
1-я |
Серпантин |
1,39+0,0017b |
2-я |
1,0+0,0009f |
1-я |
4,2+0,124l |
2-я |
Аметист |
1,47+0,0044b |
2-я |
1,1+0,0007f |
1-я |
5,2+0,178k |
1-я |
Янтарь |
1,54+0,0029a |
1-я |
1,2+0,0009f |
1-я |
3,6+0,134m |
3-я |
Примечание. МП — масса проростка, ДК — длина корня, ДС — длина колеоптиля. Анализ выполнен на наиболее контрастных по признаку образцах. По каждому признаку различия между значениями, отмеченными неодинаковыми буквами, статистически значимы при р < 0,05. |
||||||
3. Анализ достоверности различий по темпам роста проростка у сортов риса (Oryza sativa L.) |
||||
SSR маркер |
Сумма квадратов |
Сумма квадратов |
F-критерий |
Уровень |
Длина зародышевого корня |
||||
RM126 |
1,971 |
1,472 |
3,702 |
0,042 |
RM509 |
0,952 |
0,804 |
3,271 |
0,050 |
RM242 |
2,202 |
0,802 |
7,563 |
0,001 |
RM463 |
2,441 |
2,003 |
3,351 |
0,050 |
RM289 |
0,173 |
2,271 |
0,212 |
0,939 |
Масса проростка |
||||
RM405 |
11,723 |
8,031 |
4,011 |
0,031 |
RM261 |
3,641 |
0,801 |
12,501 |
0,000 |
RM6314 |
3,604 |
0,832 |
11,892 |
0,000 |
RM242 |
2,201 |
0,803 |
7,563 |
0,001 |
RM463 |
3,940 |
0,504 |
21,661 |
0,000 |
RM289 |
0,603 |
1,831 |
0,912 |
0,499 |
RM3155 |
4,641 |
4,802 |
2,661 |
0,091 |
Высота проростка |
||||
RM6410 |
1,043 |
2,401 |
1,191 |
0,370 |
RM463 |
0,743 |
3,702 |
0,553 |
0,700 |
RM289 |
1,641 |
0,801 |
5,632 |
0,011 |
4. Микросателлитные маркеры для кластеризации сортов риса (Oryza sativa L.) российской селекции по признакам, определяющим темпы роста |
|||||
SSR маркер |
Хромосома |
Температура |
Продукт амплификации, п.н. |
Гены, расположенные в районе локализации маркера (33) |
|
Кластеры по длине зародышевого стебля |
|||||
RM289 |
5-я |
55 |
108 |
Размер надземной части, энергия прорастания |
|
Кластеры по длине зародышевого корня |
|||||
RM242 |
9-я |
55 |
225 |
Толерантность к низким температурам, активность и размер корневой системы (длина, число корешков и их толщина, масса корня) и ее длина по отношению к размерам надземной части (масса стебля, его длина, число побегов и листьев), дифференциация эксплантов, стабильность мембран при стрессе, скорость прорастания |
|
RM126 |
4-я |
55 |
125 |
Адаптивность к недостатку поливной воды, толерантность к низким температурам, размер корневой системы и ее длина по отношению к размерам надземной части |
|
Кластеры по массе проростка |
|||||
RM405 |
5-я |
55 |
110 |
Размер надземных генеративных и ве-гетативных органов |
|
RM261 |
4-я |
55 |
125 |
Адаптивность к недостатку поливной воды, толерантность к низким температурам, размеры корневой системы, размер надземных генеративных и вегетативных органов |
|
RM242 |
9-я |
55 |
225 |
Дифференциация эксплантов, размеры корневой системы, ее активность и длина по отношению к размерам надземной части, толерантность к низким температурам, скорость прорастания, стабильность мембран при стрессе, размер надземных генеративных и вегетативных органов по отношению к подземным |
|
RM463 |
12-я |
55 |
192 |
Размер надземных органов |
|
RM6314 |
4-я |
50 |
169 |
Нет сведений |
|
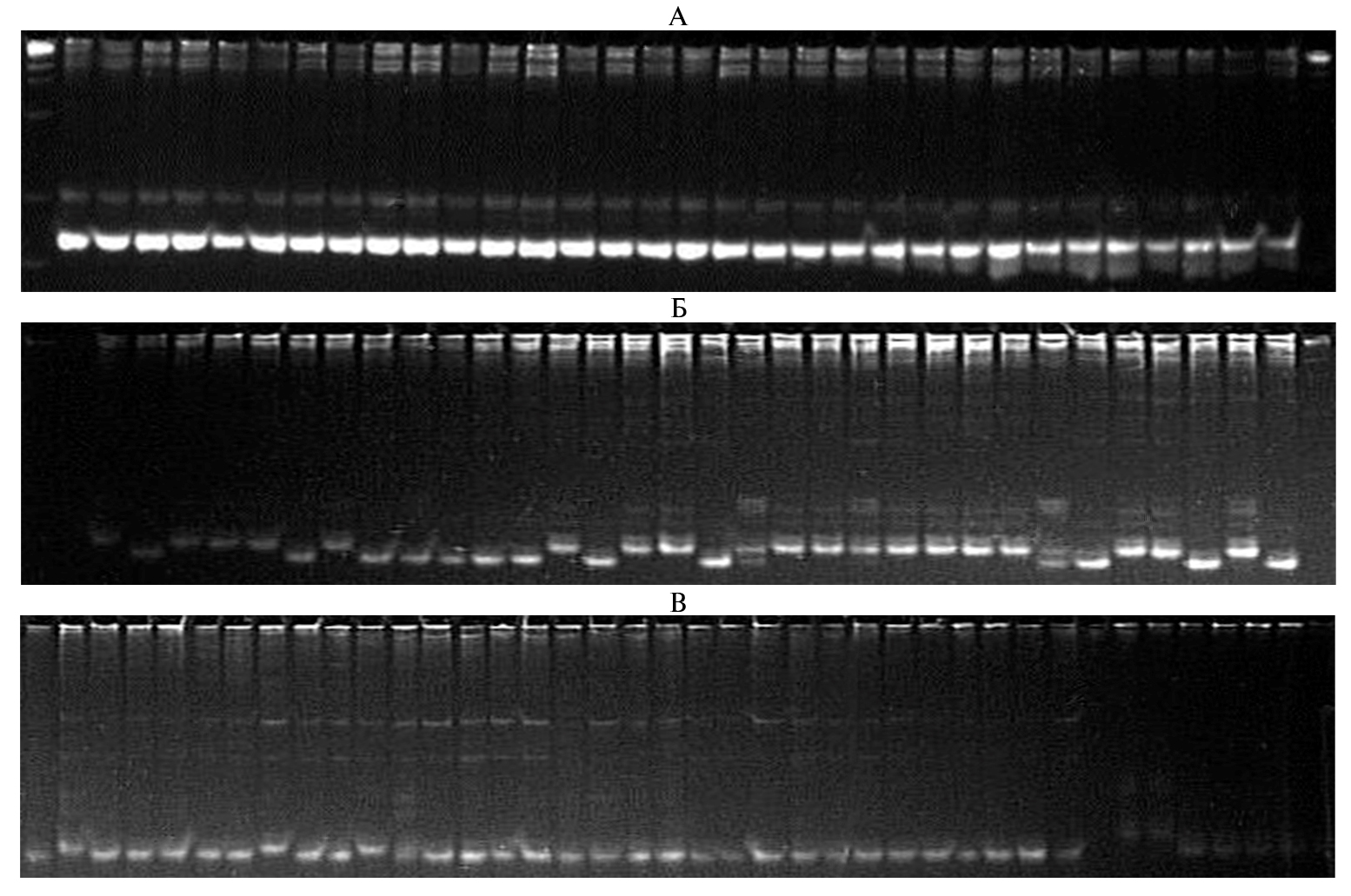
Рис. 1. Результаты молекулярного маркирования сортов риса (Oryza sativa L.) российской селекции с использованием SSR маркеров: А — RM7048 (мономорфный маркер), Б — RM213 (полиморфизм не связан с формированием признака у российских сортов риса), В — RM261 (полиморфизм связан с формированием признака у российских сортов риса). Слева направо маркер молекулярной массы, сорта Ханкайский, Садко, Приморский, Лиман, Гарант, Павловский, Рапан, Новатор, Серпантин, Боярин, Регул, Янтарь, Жемчуг, Лидер, Хазар, Аметист, Нарцисс, Дружный, Спринт, Виола, Дальневосточный, Фонтан, Касун, Юпитер, Атлант, Курчанка, Факел, Снежинка, Анаит, Флагман, Изумруд, Нарцисс, маркер молекулярной массы (маркер длин ДНК, 100 + 50 п.н., «Диаэм», Россия).
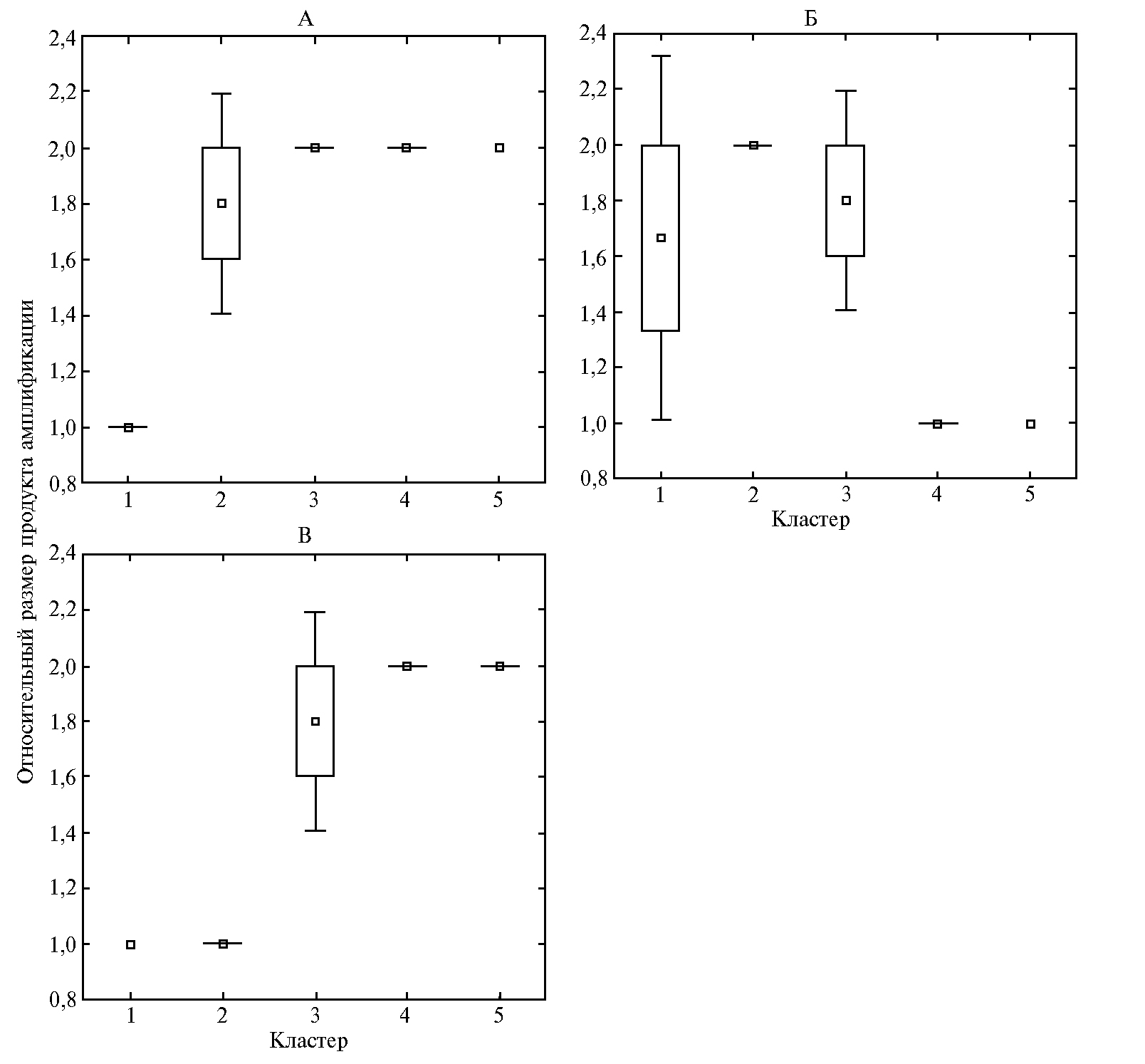
Рис. 2. Кластеризация изученных сортов риса (Oryza sativa L.) российской селекции по скорости роста корневой системы в фазу проростков с использованием маркеров двух признаков: А — RM126 242 (длина корней), Б — RM242 (длина корней), В — RM242 (масса проростка); малые квадраты — среднее (М), прямоугольники — М±SEM, «усики» — М±1,96×SEM.
ЛИТЕРАТУРА
- Meyer R.C., Törjék O., Becher M., Altman T. Heterosis of biomass production in Arabidopsis. Establishment during early development. Plant Physiology, 2004, 134(4): 1813-1823 (doi: 10.1104/pp.103.033001).
- Meyer R., Pospisil C.H., Scholten S. Heterosis associated gene expression in maize embryos 6 days after fertilization exhibits additive, dominant and overdominant pattern. Plant Mol. Biol., 2007, 63: 381-391 (doi: 10.1007/s11103-006-9095-x).
- Chang T.T. Manual on genetic conservation of rice germplasm for evaluation and utilization: IRRI Los Banos. Philippines, 1976: 75.
- Suge H. The genetic control of gibberellin production in rice. Jpn. J. Genet., 1976, 53: 199-207.
- Hu C.H. Evaluation of breeding semidwarf rice by induced mutation and hybridization. Euphytica, 1973, 22: 562-574.
- Alvarado-Sanabria O., Garcés-Varón G., Restrepo-Díaz H. Physiological response of rice seedlings (Oryza sativa L.) subjected to different periods of two night temperatures. Journal of Stress Physiology and Biochemistry, 2017, 13(1): 35-43.
- Science of the rice plant. Vol. 3. Genetics /T. Matsuo, Y. Futsuhara, F. Kikuchi, H. Yamaguchi (eds.). Food and Agriculture Policy Research Center, Tokyo, 1997.
- Miura K., Kuroki M., Shimizu H., Ando I. Introduction of the long-coleoptile trait to improve the establishment of direct-seeded rice in submerged fields in cool climates. Plant Production Science, 2002, 5(3): 219-223 (doi: 10.1626/pps.5.219).
- Wang Z., Wang J., Bao Y., Wu Y., Zhang H. Quantitative trait loci controlling rice seed germination under salt stress. Euphytica, 2011, 178(3): 297-307 (doi: 10.1007/s10681-010-0287-8).
- Ohsumi A., Furuhata M., Matsumura O. Varietal differences in biomass production of rice early after transplanting at low temperatures. Plant Production Science, 2012, 15(1): 32-39 (doi: 10.1626/pps.15.32).
- Fukuda A., Terao T. QTLs for shoot length and chlorophyll content of rice seedlings grown under low-temperature conditions, using a cross between indica and japonica cultivars. Plant Production Science, 2015, 18(2): 128-136 (doi: 10.1626/pps.18.128).
- Sasaki A., Ashikari M., Ueguchi-Tanaka M., Itoh H., Nishimura A., Swapan D., Ishiyama K., Saito T., Kobayashi M., Khush G.S., Kitano H., Matsuoka M. Green revolution: A mutant gibberellin-synthesis gene in rice. Nature, 2002, 416: 701-702 (doi: 10.1038/416701a).
- Adachi Y., Sugiyama M., Sakagami J., Fukuda A., Ohe M., Watanabe H. Seed germination and coleoptile growth of new rice lines adapted to hypoxic conditions. Plant Production Science, 2015, 18(4): 471-475 (doi: 10.1626/pps.18.471).
- Bastawisi A.O., El-Mowafi H.F., Abo Yousef M.I., Draz A.E., Aidy I.R., Maximos M.A., Badawi A.T. Hybrid rice research and development in Egypt. In: Hybrid rice for food security, poverty alleviation and environmental protection. Proceedings of the 4th International Symposium on Hybrid Rice, Hanoi, Vietnam, 14-17 May 2002 /S.S. Virmani, C.X. Mao, B. Hardy (eds.). International Rice Research Institute, Los Baños, Philippines, 2003: 257-263.
- Костылев П.И., Вожжова Н.Н. Селекция сортов на устойчивость к глубокому затоплению и полеганию. В сб.: Экологическаягенетикакультурных растений. Краснодар, 2011: 296-299.
- Гончарова Ю.К. Генетические основы повышения продуктивности риса. Докт. дис. Краснодар, 2014.
- Гончарова Ю.К., Харитонов Е.М. О генетико-физиологических механизмах солеустойчивости у риса (Oryza sativa L.). Сельскохозяйственная биология, 2013, 3: 3-11 (doi: 10.15389/agrobiology.2013.3.3rus).
- Goncharova Yu.K. Inheritance of heat resistance in rice. Russian Journal of Genetics: Applied Research, 2011, 1(3): 248-251.
- Meyer S., Scholten S. Equivalent parental contribution to early plant zygotic development. Current Biology, 2007, 17: 1686-1691 (doi: 10.1016/j.cub.2007.08.046).
- Meitzel T., Radchuk R., Link W., Weber H. Molecular physiology and genetics of seed heterosis in the model Vicia faba L. Proc. International Conference on Heterosis in Plants, University of Hohenheim, Stuttgart, Germany September 7-9, 2009. Stuttgart, 2009: 32.
- Шаптуренко М.Н. Генетическая дивергенция и гетерозис у растений. Докт. дис. Минск, 2018.
- Костылев П.И., Парфенюк А.А., Степовой В.И. Северный рис. Ростов-на-Дону, 2004.
- Hua J.P., Xing Y.Z., Xu C.O., Sun X.L., Yu S.B., Zhang Q. Genetic dissection of an elite rice hybrid revealed that heterozygotes are not always advantageous for performance. Genetics, 2002, 162: 1885-1895.
- Wang Y., Guo Y., Hong D.-l. QTL аnalysis of anoxic tolerance at seedling stage in rice. Rice Science, 2010, 17(3): 192-198 (doi: 10.1016/S1672-6308(09)60017-2).
- Wang Z., Wang F., Zhou R., Wang J., Zhang H. Identification of quantitative trait loci for cold tolerance during the germination and seedling stages in rice (Oryza sativa L.). Euphytica, 2011, 181(3): 405-413 (doi: 10.1007/s10681-011-0469-z).
- Бруяко В.Н. Дифференциация сортообразцов риса по темпам роста и развития растений. Канд. дис. Краснодар, 2016.
- McCouch S.R., Sweeney M., Li J., Jiang H., Thomson M., Septiningsih E., Edwards J., Moncada P., Xiao J., Garris A., Tai T., Martinez C., Tohme J., Sugiono M., McClung A., Yuan L., Ahn S. Through the genetic bottleneck: O. rufipogon as a source of trait-enhancing alleles for O. sativa. Euphytica, 2007, 154(3): 317-339 (doi: 10.1007/s10681-006-9210-8).
- Matsushima K., Sakagami J. Effects of seed hydropriming on germination and seedling vigor during emergence of rice under different soil moisture conditions. American Journal of Plant Sciences, 2013, 4(8): 1584-1593 (doi: 10.4236/ajps.2013.48191).
- Лось Г.Д. Перспективный способ гибридизации риса. Сельскохозяйственная биология, 1987, 2: 107-109.
- Thomson M., de Ocampo M., Egdane J., Rahman M.A., Sajise A.G., Adorada D.L., Tumimbang-Raiz E., Blumwald E., Seraj Z.I., Singh R.K., Gregorio G.B., Ismail A.M. Characterizing the Saltol quantitative trait locus for salinity tolerance in rice. Rice, 2010, 3(2-3): 148-160 (doi: 10.1007/s12284-010-9053-8).
- Тюрин В.В., Щеглов С.Н. Дискриминантный анализ в биологии. Краснодар, 2015.
- Драгавцев В.А., Цильке P.А., Рейтер В.Г., Воробьев В.А., Дубровская А.Г., Коробейников Н.И., Новохатин В.В., Максименко В.П., Бабакишиев А.Г., Илющенко В.Г., Калашник Н.А., Зуйков Ю.П., Федотов А.М. Генетика признаков продуктивности яровых пшениц в Западной Сибири. Новосибирск, 1984.
- Gramene: A comparative resource for plants. Режим доступа: http://www.gramene.org. Дата обращения: 20.10.2018.
- Zhang S., Zheng J., Liu B., Peng S., Leung H., Zhao J., Wang X., Yang T., Huang Z. Identification of QTLs for cold tolerance at seedling stage in rice (Oryza sativa L.) using two distinct methods of cold treatment. Euphytica, 2014, 195(1): 95-104 (doi: 10.1007/s10681-013-0977-0).
- Verma S.K., Xalxo M.S., Saxena R.R., Verulkar S.B. Identification of QTLs for cold tolerance at seedling stage in rice (Oryza sativa L.). Indian Journal of Genetics and Plant Breeding, 2014, 74(1): 86-89 (doi: 10.5958/j.0975-6906.74.1.012).
- Xie L., Tan Z., Zhou Y., Xu R., Feng L., Xing Y., Qi X. Identification and fine mapping of quantitative trait loci for seed vigor in germination and seedling establishment in rice. Journal of Integrative Plant Biology, 2014, 56(8): 749-759 (doi: 10.1111/jipb.12190).
- Singh B.K., Singh A.K., Meetei Ng.T., Mukherjee A., Mandal N. QTL mapping for cold tolerance at the seedling stage in rice. International Journal of Bio-resource and Stress Management, 2016, 7(5): 1214-1224 (doi: 10.23910/IJBSM/2016.7.5.1615).
- Goncharova J.K., Gontcharov S.V., Chicharova E.E. Localization of chromosome regions controlling high photosynthetic potential in Russian rice cultivars. Russian Journal of Genetics, 2018, 54(7): 796-804 (doi: 10.1134/S1022795418070037).