УДК 632.938:577.27
РОЛЬ РАСТИТЕЛЬНЫХ ДЕФЕНЗИНОВ В МНОГОКОМПОНЕНТНОЙ СИСТЕМЕ ЗАЩИТЫ РАСТЕНИЙ (обзор иностранной литературы)
Ф.М. КОМАЛЕТДИНОВА
Рассмотрены свойства группы растительных белков — дефензинов, обладающих фунгицидной, антимикробной и инсектицидной активностью. Обсуждается структура, характер экспрессии и локализация в тканях растения различных классов этих белков, различающихся по воздействию на патогены и первичной структуре, позиционирование аминокислотных остатков, существенных для проявления защитного действия, предполагаемый механизм действия трансгенных растений, несущих гены растительных дефензинов. Представленные данные свидетельствуют об участии дефензинов в системной защите растений от биотического и абиотического стресса.
Ключевые слова: дефензины растений, антимикробные белки, системный ответ.
В процессе эволюции растения создали эффективную многокомпонентную систему защиты в ответ на биотический и абиотический стресс. Одна из групп веществ, входящих в эту систему, представлена белками широкого спектра действия — дефензинами. Эти белки впервые были выделены из семян пшеницы и ячменя в 1992 году E. Mendez с соавт. (1). Сначала они получили название γ-тионины из-за сходства по размеру (5 кДа) и числу дисульфидных мостиков (четыре) с γ-, α- и β-тионинами. Однако затем было выявлено структурное и функциональное подобие этих белков антимикробным дефензинам насекомых и млекопитающих, на основании чего предложено название «растительные дефензины» (2, 3).
F.R.G. Terras с соавт. (4) показали, что растительные дефензины подавляют рост 20 видов грибов и бактериальных патогенов. G.H. Chen с соавт. (5) выделили дефензины, обладающие инсектицидной и фунгицидной активностью. Дефензины растений могут экспрессироваться в ответ на абиотический стресс: засуху (6), засоление (7) и пониженные температуры (8). Принципиальное отличие растительных дефензинов от других антимикробных белков растений заключается в нетоксичности для клеток млекопитающих и растений (3, 4, 9, 10).
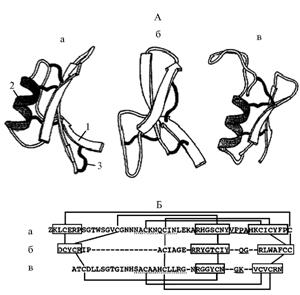
С т р у к т у р а р а с т и т е л ь н ы х д е ф е н з и н о в. Трехмерное строение молекулы дефензинов растений было определено ЯМР-спектроскопией. Молекула образует структуру, состоящую из трех слоев, соединенных четырьмя дисульфидными мостиками: двух антипараллельных b-спиралей и одной α-спирали, расположенной параллельно β-слоям. Cys-XXX-Cys сегмент α-спирали связан двумя дисульфидными мостиками с Cys-X-Cys сегментом третьего β-слоя (это структурный мотив, известный как цистеин-стабилизированная α-спираль) (2). В этом отношении дефензины растений и насекомых сходны: у вторых они содержат a-спираль и два b-слоя, стабилизированных тремя дисульфидными мостиками, формирующими цистеин-стабилизированный αβ-мотив (У дефензинов млекопитающих отсутствует a-спираль, однако сохраняется трехслойный антипараллельный β-слой (12), который по структуре и пространственной организации подобен наблюдаемому у дефензинов растений (рис. 1) (2).
У дефензинов из лепестков петунии Petunia hybrida (PhD1 и PhD2), F.T. Lay с соавт. (13), кроме восьми канонических цистеиновых остатков, характерных для семейства растительных дефензинов, обнаружили пару дополнительных, формирующих пятый дисульфидный мостик, то есть выделенные пептиды представляют собой новый подкласс этого семейства. Возможно, что еще один S-S-мостик придает белкам PhD1 и PhD2 повышенную термостабильность (13).
|
Рис. 1. Схематическое представление трехслойной пространственной (А) и первичной (Б) структуры молекулы дефензина растений Rs-AFP1 (а), млекопитающих HNP-3 (б) и насекомых Insect Defensin A (в): 1, 2 и 3 — соответственно β-слои (стрелки отражают направление β-спирали), α-спираль и дисульфидные мостики. При сравнении аминокислотных последовательностей пропуски, сделанные для максимального соответствия позиций аминокислотных остатков, показаны пунктиром; последовательности, выделенные прямоугольником, формируют β-слои, подчеркнутые пунктирной линией — α-спирали, сплошной — соответствуют β-изломам; дисульфидные мостики изображены линиями, связывающими Cys-пары (цит. по 2). |
F.T. Lay с соавт. при сравнении аминокислотных последовательностей известных дефензинов обнаружили, что некоторые аминокислотные остатки консервативны и наблюдаемое на уровне структур более высокого порядка сходство растительных дефензинов не распространяется на первичную структуру белка (14).
С т р у к т у р а б е л к о в - п р е д ш е с т в е н н и к о в
р а
с т и т е л ь н ы х д е ф е н з и н о в. Формирование зрелых белков дефензинов происходит посредством процессинга белков-предшественников. Растительные дефензины различаются по структуре белков-предшествен-ников, которые могут быть разделены на два класса. Первый представлен молекулами, состоящими из сигнальной последовательности и зрелого домена дефензинов. Эти белки обнаружены внеклеточно, причем к ним относится большая часть дефензинов, в том числе дефензины семян (13, 14). У второго белок-предшественник имеет дополнительный С-концевой продомен, содержащий около 33 аминокислотных остатков (13). Такие дефензины обнаружены только у видов пасленовых, они экспрессируются конститутивно в цветочных тканях и плодах, локализованы в вакуоли. Следует отметить, что в цветках пасленовых синтезируются оба класса дефензинов. Дефензин цветков табака Nicotiana alta (NaD1) обнаружен в двух формах: в виде предшественника (7 кДа) с С-концевым продоменом в молодых тканях и зрелого белка (5 кДа) на более поздних стадиях развития цветка. Содержание формы проNaD1 (7 кДа) относительно NaD1 (5 кДа) убывает по мере созревания цветков (вероятно, в результате процессинга). Экспрессия этих дефензинов в листьях некоторых видов Nicotiana индуцируется солевым стрессом. Отметим, что у предшественников дефензинов млекопитающих и насекомых также присутствуют продомены, однако (в отличие от дефензинов растений) они локализуются на N-конце пептида. Возможно, С-концевой продомен дефензинов растений играет роль сигнальной последовательности при внутриклеточной сортировке. В то же время различие электростатического заряда дефензина и его продомена предполагает, что продомен, вероятно, способен участвовать в созревании дефензина и определять его цитопротекторную функцию до секреции (14).
Э к с п р е с с и я и л о к а л и з а ц и я р а с т и т е л ь н ы х
д е ф е н з и н о в. Иммунологический анализ и гибридизация in situ подтверждают, что растительные дефензины накапливаются преимущественно в периферических клеточных слоях, семядолях, гипокотилях, цветковых структурах, устьичных клетках и клеточных стенках субустьичных структур (3, 15). Исследования показывают, что гены растительных дефензинов могут экспрессироваться конститутивно и индуцибельно. Индуцибельная экспрессия наблюдается под воздействием патогенов или абиотического стресса (14). Так, по данным L. Press с соавт., гены дефензинов растений гороха при инокуляции грибными патогенами Fusarium solani f. sp. pisi, F. solani f. sp. phaseoli экспрессируются в стручках и других вегетативных тканях (16). Конститутивная экспрессия растительных дефензинов специфична для органов и тканей. Например, гены дефензинов гороха конститутивно экспрессируются в эпидермисе листа (16). Количество продуктов генов, кодирующих антимикробные растительные дефензины из клубней картофеля (Pth-St1), выше в эпидермальных клеточных слоях и листовых примордиях клубня. Дефензины табака (FST) найдены только в нераспустившихся цветковых почках (3).
Д е й с т в и е р а с т и т е л ь н ы х д е ф е н з и н о в н а г р и б ы, б а к т е р и и и д р у г и е о р г а н и з м ы. По структуре и оказываемому действию на грибные патогены дефензины растений были разделены на четыре класса: морфогенные, неморфогенные, ингибиторы a-амилазы; отдельную группу представляли дефензины, выделенные из шпината.
Морфогенные дефензины вызывают редукцию роста гифов с сопутствующим усилением их ветвления. К ним относятся дефензины растений семейства Brassicaceae (например, Rs-AFP1 и RS-AFP2 из семян редьки) и Saxifragaceae (в частности, Hs-AFP1 из семян Heuchera sanguinea). Неморфогенные дефензины, подавляя рост гифов, не вызывают заметных морфологических изменений. В эту группу включены дефензины растений семейств Asteraceae, Fabaceae и Hippocastanacae (в том числе соответственно DM-AMP1 из семян георгина, Ct-AMP2 из семян Clitoria ternatea и Ah-AMP1 из семян конского каштана).
Растительные дефензины различаются по спектру фунгицидного действия. Например, на среде с высокой ионной силой неморфогенные дефензины более активны против Leptosphaeria maculans, морфогенные — по отношению к Penicillium digitatum (10). Морфогенные растительные дефензины семян Rs-AFP1 и Rs-AFP2 защищают растения от грибного патогена Pyreno-phora tritici-repentis при нарушении семенной оболочки и прорастании. На грамположительные бактерии дефензины действуют слабо, против Escherichia coli и агробактерий они неактивны. Исключение составляют Ct-AMP1 (10), подавляющий Bacillus subtilis,и Pth-St1 из клубней картофеля (9), к которому чувствительны Pseudomonas solanacearum и Clavibacter michiganisis.
Самостоятельную группу составляют дефензины, изолированные из листьев шпината (Spinacia oleracea cv. Matador) — So-D1-7. Они выделены в группу на основании сравнения аминокислотных последовательностей шести белков с дефензинами остальных известных групп и по действию на патогены. В отличие от морфогенных и неморфогенных дефензинов они активны в отношении как грамотрицательных, так и грамположительных бактерий — эффект проявляется при концентрациях менее 20 мкM для первых (Ralstonia solanacearum) и вторых (Clavibacter michiganensis), а также против грибов (Fusarium culmorum, F. solani, Bipolaris maydis и Colletotrichum lagenarium). Дефензины So-D1-7 не оказывают морфогенного воздействия на грибные гифы (17).
Влияние растительных дефензинов на клетки млекопитающих сравнивали с действинем антимикробного белка растений β-пуротионина (18). Инкубация с изолированными белками редьки Raphanus sativus Rs-AFP в концентрации до 500 мкг/мл не выявила токсического эффекта и снижения жизнеспособности клеток эндотелия кровеносных сосудов и фибробластов человека, тогда как для β-пуротионина полулетальная концентрация (IC50) составляла 25 мкг/мл. При добавлении очищенных дефензинов редьки Rs-AFP, антимикробного пептида из Mirabilis jalapa (Mj-AMP2) или Amaranthus caudatus (Ac-AMP2) в концентрации 500 мкг/мл к эритроцитам человека не наблюдается гемолиз, при том что в присутствии β-пуротионинов в концентрации 5 мкг/мл 50 % эритроцитов разрушается (4).
Дефензины — ингибиторы a-амилазы обнаружены у представителей семейства Poaceae (соответственно γ-1-P, γ-1H и Sia-3 из семян пшеницы, ячменя и сорго). Они активны в отношении a-амилазы насекомых и человека, причем их известные представители не обладают антигрибным действием (4).
Относительно недавно выяснилось, что дефензины способны подавлять не только рост грибных и бактериальных патогенов, но и развитие насекомых. На дефензине VrD1 из семян растений маша (Vigna radiata L.), устойчивых к зерновке (Callosobruchus chinensis), изучали влияние его содержания на развитие личинок, используя синтетическую конструкцию с сигнальной последовательностью — VrD1-TSP. VrD1-TSP вызывал гибель личинок C. chinensis на I стадии развития при содержании в семенах, равном 0,80 %, и задерживал его — при 0,06 %. VrD1-TSP также останавливал развитие клеток насекомых Spodoptera frugiperda в культуре (линия Sf21) в концентрации 3,42 мкM. То есть рекомбинантный VrD1, экспрессированный в Pichiapastoris, ингибирует рост грибов F. oxysporum и Rhizoctoniasolani, а также личинок C. chinensis и клеток Sf21 (5, 19).
М е х а н и з м д е й с т в и я р а с т и т е л ь н ы х д е ф е н з и- н о в. Пока что недостаточно ясно, каким образом растительные дефензины ингибируют рост грибов. Предполагается, что их действие обусловлено способностью связывать гликолипиды мембраны, выполняющие в этом случае роль рецепторов. Взаимодействие дефензинов с гликолипидами приводит к изменению структуры мембраны с формированием поры и поглощением/выделением ионов (20-23). P.B. Pelegrini с соавт. (24) описали предполагаемый механизм действия дефензинов растений (g-тионинов), согласно которому глюкозилцерамиды мембраны выступают в роли рецепторов для встраивания дефензинов (рис. 2). Известно, что наиболее хорошо изученный морфогенный дефензин Rs-AFP2 взаимодействует с глюкозилцерамидами (GlcCer) Candida albicans и Pichia pastoris, неморфогенный Dm-AMP1 из семян георгина (Dahlia merckii) — со сфинголипидом дрожжей Saccharomyces сerevisiae маннозилдиинозитолфосфорилцерамидом М(IP)2C (23, 25). Мутанты S. cerevisiae по генам, контролирующим биосинтез фосфолипидов, — структурному гену M(IP)2C и IPT1 (связан с метаболизмом сфинголипидов), а также гену SKN1, вовлеченному в биосинтез β-1,6-глюканов, становятся нечувствительными к действию растительных дефензинов. Оверэкспрессия IPT1 или SKN1, комплементирующая мутацию skn1, приводит к восстановлению продукции M(IP)2C на уровне дикого типа и чувствительности к DmAMP1 (26, 27). Возможно, подавление развития насекомых дефензинами обусловлено их взаимодействием с компонентами поверхностных структур клеток по аналогичному механизму.
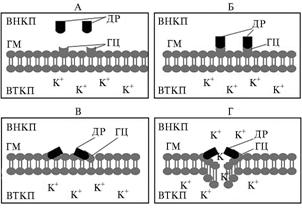 |
Рис. 2. Схема дестабилизации дефензинами растений (ДР) двуслойной клеточной мембраны гриба (МГ) с использованием поверхностных глюкозилцерамидов (ГЦ) в качестве рецепторов для встраивания (в соответствии с предполагаемым механизмом фунгицидного действия): A — молекулы ГЦ расположены на мембране, молекулы ДР — во внеклеточном пространстве (ВНКП); Б — взаимодействие между ДР и ГЦ; В — проникновение положительно заряженных молекул |
ДР в мембрану, дестабилизирующее ее; Г — нарушение структуры мембраны и выход ионов K+ из внутриклеточного пространства (ВТКП) во внеклеточное (цит. по 24). |
|
И н д у к ц и я с и н т е з а р а с т и т е л ь н ы х д е ф е н з и н о в в о т в е т н а б и о т и ч е с к и й и а б и о т и ч е с к и й с т р е с с. При инвазии патогена как стрессорном воздействии у растения индуцируется системная реакция, которая выражается в экспрессии генов, кодирующих защитные белки и пептиды, в том числе растительные дефензины (28, 29). В результате стрессорного воздействия на клетку происходит выход ионов, алкалинизация внеклеточного пространства, накопление активных форм кислорода и азотсодержащих продуктов, транскрипционное перепрограммирование. Последнее приводит к другим защитным ответам, включая синтез сигнальных интермедиатов — салициловой кислоты (SA), этилена (ET) и жасмоновой кислоты (JA), антимикробных компонентов, изменение клеточной стенки, активацию генов защиты, которые кодируют антимикробные белки, в том числе дефензины (28).
I.A. Penninckx с соавт. обнаружили, что в ответ на обработку грибом Alternaria brassicocola в листьях Arabidopsis наблюдается индуцибельная экспрессия генов растительного дефензина, обладающего антигрибным действием in vitro (29). Описывают разные механизмы сигналинга, вовлеченные в индуцированную патогеном системную активацию дефензина Arabidopsis PDF1.2, и участие в этом процессе растительных гормонов — салициловой, жасмоновой кислоты (а также ее аналога метилжасмоната) и этилена. У мутантов Arabidopsis с заблокированным ответом на этилен (ein2-1) и метилжасмонат (coi1-1) такая экспрессия PDF1.2 значительно ограничена и не зависит от салициловой кислоты.
Сообщалось (14), что оба сигнальных механизма (с участием этилена и жасмоновой кислоты) должны действовать одновременно, чтобы активировать экспрессию PDF1.2 при инфекции патогена. Необходимость функциональных компонентов сигнала трансдукции этилена (EIN2) в системной индукции PDF1.2 продемонстрировали B.P.H.J. Thomma с соавт. (30). Они обнаружили, что мутанты ein2-1 более чувствительны к грибной инфекции, чем растения дикого типа. Сходные результаты получены для дефензинов Rs-AFP3 и Rs-AFP4 из листьев редьки (31).
Аккумуляция растительных дефензинов также может быть вызвана абиотическими факторами. Так, P. Epple с соавт. выявили экспрессию дефензинов при обработке растений нитратом серебра (32). Выделен дефензин соевых бобов (Dhn8), который индуцируется в условиях засухи (6). Экспрессия дефензинов из Nicotiana excelsior (NeThio1 и NeThio2) и N. рa-niculata (NpThio1) усиливается в ответ на солевой стресс (250 мM NaCl) (7). M. Koike с соавт. (8) сообщили о регуляции активности генов дефензинов у озимой пшеницы холодом (синтез разных транскриптов). После дифференциального скрининга генов озимой пшеницы, индуцируемых холодовым стрессом, авторами получен новый клон кДНК — Tad1, кодирующий полипептид (23 кДа) с N-концевой сигнальной последовательностью. В молодых проростках под воздействием низких температур высокое содержание мРНК Tad1 достигалось в течение суток и сохранялось 14 сут. Эти гены не активировались экзогенной абсцизовой кислотой. В отличие от дефензинов растений других видов, экспрессию Tad1 не индуцировали салициловая кислота и метилжасмонат. Рекомбинантный зрелый полипептид TAD1, как было обнаружено, ингибирует рост фитопатогенной бактерии Pseudomonas cichorii, однако не проявляет антихолодовых свойств. То есть под действием низких температур ген Tad1 экспрессируется в растениях холодоустойчивых форм озимой пшеницы независимо от основного дефенсивного сигналинга, а зрелый пептид обладает антигрибной активностью (8). Представленные данные свидетельствуют о близких (возможно, пересекающихся) механизмах ответной реакции растений на биотический и абиотический стресс (6, 8, 14).
В з а и м о с в я з ь с т р у к т у р ы и а к т и в н о с т и д е ф е н- з и н о в. Антигрибные свойства дефензинов зависят от первичной и вторичной структуры белков. Аминокислотные последовательности, влияющие на антимикробную активность, можно выявить методом сайт-специфического мутагенеза. G.W. de Samblanx с соавт. (33) локализовали аминокислотные остатки, характерные для дефензинов Rs-AFP2, обладающих антигрибной активностью в отношении F. culmorum. Дефензин SIa2 Sorghum bicolor (ингибитор 2 a-амилаз) подобные свойства не проявляет. Была создана серия мутантов-аналогов, у которых в молекуле Rs-AFP2 аминокислотные остатки по ряду положений заменены на соответствующие аминокислотные остатки SIa2. В результате таких замещений получаются белки с редуцированными антимикробными свойствами. Идея создания другой серии мутантов основана на том, что дефензины с большим положительным зарядом молекулы обладают большей антимикробной активностью. Для его увеличения синтезировали аналоги антигрибного белка Rs-AFP2 с заменой одной аминокислоты в разных неконсервативных позициях на аргинин. Оказалось, что белки, в которых вместо Гли9 или Вал39 присутствует аргинин, действительно активнее, чем Rs-AFP2 дикого типа. Эффект наиболее выражен на средах с высокой ионной силой и связан с поглощением кальция. В то же время замена Лиз44 глутамином (нейтральный остаток) приводила к снижению антигрибной активности (33).
Выявлены аминокислотные остатки, необходимые и достаточные для проявления защитных свойств Rs-AFP2: синтезированный пептид, состоящий из слоев b2 и b3 и связывающей их петли (остатки в положениях 31-49 в Rs-AFP2), по способности подавлять развитие грибов оказался сходным с полноразмерной молекулой дефензина (14). Для определения аминокислотных последовательностей, отвечающих за фунгицидную активность, изучали также дефензины близкородственных видов Medicago sativa и M. truncatula (соответственно MsDef1 и MtDef2) с различными антигрибными свойствами: MsDef1 в отличие от MtDef2 активен против F. graminearum. Использовав созданные химерные белки, состоящие из фрагментов MsDef1 и MtDef2, показали, что последовательности, которые отвечают за антигрибные свойства MsDef1, расположены в С-концевом домене (остатки в позициях 31-45), причем Арг38 — критическая аминокислота для их проявления (34). Таким образом, проведенные исследования позволяют идентифицировать аминокислотные последовательности, влияющие на фунгицидные свойства растительных дефензинов, и синтезировать аналоги, обладающие повышенной антигрибной активностью.
В в е д е н и е г е н о в д е ф е н з и н о в в р а с т е н и я. Генетическая модификация растений посредством переноса генов устойчивости, как известно, представляет собой один из важнейших инструментов получения устойчивых форм. Растительные дефензины, обладая фунгицидными, антибактериальными и инсектицидными свойствами, как отмечалось выше, нетоксичны для клеток млекопитающих, что делает их привлекательными для создания трансгенных растений, способных синтезировать эти белки. Например, при трансформации Agrobacterium tumefaciens LGV3850/pH22kneoAc77 получены растения картофеля, несущие гены морфогенных дефензинов из Amaranthus сaudatus, и репортерный ген NPTII (35). Показано, что продукция дефензинов в трансгенных растениях защищает вегетативные ткани от патогенов. Так, конститутивный синтез дефензина редьки в трансгенных растениях табака значительно увеличивает их резистентность к Alternaria longipes (3), в растениях томата — к A. solani (36), дефензина гороха в растениях Brassica napus — к возбудителю черной ножки (Leptosphaeria maculans) (37), дефензина люцерны в растениях картофеля — к Verticillium dahliae в полевых условиях (38). В настоящее время получено большое число подобных трансгенных растений (список соответствующих генов растительных дефензинов частично приведен в цитируемом обзоре, см. ссылку 14).
Особый интерес представляет трансформация растений, исходно не имеющих дефензинов. В частности, у риса (Oryza sativa L.) растительные дефензины не обнаружены. Трансгенные растения риса, конститутивно экспрессирующие ген растительного дефензина из Brassica oleracea и B. campestris, обладали высокой устойчивостью к пирикуляриозу и бактериальному ожогу (возбудители — соответственно Piricularia oryzae и Xanthomonas campestris pv. oryzae). Высокая устойчивость к пирикуляриозу риса сохранялась в потомстве (39).
Изменение нуклеотидной последовательности генов позволяет создавать аналоги дефензинов со значительно большей фунгицидной активностью, чем у белков дикого типа (14, 33, 34). Так, при модификации генов растительных дефензинов из B. oleracea и B. campestris замена одного аминокислотного остатка приводила к повышению устойчивости трансгенных растений к патогенам (39). Предполагают, что добавление 3¢-фланкирующей последовательности к генам растительных дефензинов коррелирует со стабильной экспрессией их зрелой мРНК и большей устойчивостью к патогенам. Например, у трансгенных растений риса, содержащих такую последовательность, степень устойчивости к пирикуляриозу и бактериальному ожогу оказалась значительно выше по сравнению с растениями, трансформированными генами дефензинов дикого типа (39).
Итак, широко распространенные белки — растительные дефензины представляют собой важный компонент общей системы защиты. Их синтез может индуцироваться биотическим и абиотическим стрессом. Они обладают широким антимикробным, фунгицидным и инсектицидным спектром действия в микромолярных концентрациях, нетоксичны для растений и клеток млекопитающих, экспрессируются как тканеспецифически конститутивно, так и индуцибельно в ответ на инвазию патогена и абиотический стресс. Механизм действия растительных дефензинов на грибные клетки исследован недостаточно, однако известно, что они взаимодействуют со специфическими липидными комплексами мембраны. Изучение структуры и функции растительных дефензинов позволяет определять аминокислотные последовательности, отвечающие за их фунгицидные свойства, и создавать аналоги, обладающие большей активностью, чем белок дикого типа. Проведенные эксперименты делают возможным получение трансгенных растений с генами дефензинов, устойчивых к биотическим и абиотическим стрессам.
Автор выражает искреннюю благодарность Н.В. Мироненко, Г.П. Пинаеву, В.Г. Лунину за обсуждение статьи и замечания при подготовке рукописи.
Л И Т Е Р А Т У Р А
1. M e n d e z E., M o r e n o A., C o l i l l a F. e.a. Primary structure and inhibition of protein synthesis in eukaryotic cell-free system of a novel thionin, g-hordothionin, from barley endosperm. Eur. J. Biochem., 1990, 194: 533-539.
2. B r o e k a e r t W.F., T e r r a s F.R.G., C a m m u e B.P.A. e.a. Plant defensins: novel antimicrobial peptides as components of the host defense system. Plant Physiol., 1995, 108: 1353-1358.
3. T e r r a s F.R., E g g e r m o n t K., K o v a l e v a V. e.a. Small cysteine-rich antifungal proteins from radish: their role in host defense. Plant Cell., 1995, 7(5): 573-588.
4. T e r r a s F.R.G., S c h y o o f s H.M.E., De B o l l e M.F.C. e.a. Analysis of two novel classes of plant antifungal proteins from radish (Raphanus sativus L.) seeds. J. Biol. Chem., 1992, 267(22): 15301-15309.
5. C h e n G.H., H s u M.P., T a n C.H. e.a. Cloning and characterization of a plant defensin VrD1 from azuki bean. J. Agr. Food Chem., 2005, 53: 982-988.
6. M a i t r a N., C u s h m a n J.C. Characterization of a drought-induced soybean cDNA encoding a plant defensin. Plant Physiol., 1998, 118: 1536.
7. Y a m a d a S., K o m o r i T., I m a s e k i H. cDNA cloning of g-thionin from Nicotiana excelsior(accession no. AB005266; PGR97–131). Plant Physiol., 1997, 115: 314.
8. K o i k e M., O k a m o t o T., T s u d a S. e.a. A novel plant defensin-like gene of winter wheat is specifically induced during cold acclimation. Biochem. Biophys. Res. Commun., 2002, 298(1): 46-53.
9. M o r e n o M., S e g u r a A., G a r c l a - O l m e d o F. Pseudothionin St1, a potato peptide active against potato pathogens. Eur. J. Biochem., 1994, 223: 135-139.
10. O s b o r n R.W., De S a m b l a n x G.W., T h e v i s s e n K. e.a. Isolation and characterisation of plant defensins of Asteraceae, Fabaceae, Hippocastanaceae and Saxifragaceae. FEBS Letters, 1995, 368: 257-262.
11. B o n m a t i n J.M., B o n n a t J.L., G a l l e t X. e.a. Two-dimensional 1H NMR study of recombinant insect defensin A in water: resonance assignments, secondary structure and global folding. J. Biomol. NMR, 1992, 2(3): 235-256.
12. H i l l C.P., Y e e J., S e l s t e d M.E. e.a. Crystal structure of defensin HNP-3, an amphiphilic dimer: mechanisms of membrane permeabilization. Science, 1991, 251(5000): 1481-1485.
13. L a y F.T., B r u g l i e r a F., A n d e r s o n A.A. Isolation and properties of floral defensins from ornamental tobacco and petunia. Plant Physiol., 2003, 131: 1283-1293.
14. L a y F.T., A n d e r s o n M.A. Defensins — сomponents of the innate immune system in plants. Cur. Prot. Pept. Sci., 2005, 6(1): 1389-2037.
15. B r o e k a e r t W.F., C a m m u e B.P.A., De B o l l e M.F.C. e.a. Antimicrobial peptides from plants. Crit. Rev. Plant Sci., 1997, 16(3): 297-323.
16. C h i a n g C.C., H a d w i g e r L.A. The Fusarium solani-induced expression of a pea gene family encoding high cysteine content proteins. Mol. Plant Microbe Interact., 1991, 4: 324-331.
17. S e g u r a A., M o r e n o M., M o l i n a A. e.a. Novel defensin subfamily from spinach (Spinacia oleracea).FEBS Letters, 1998, 435(13): 159-162.
18. B o h l m a n n H. The role of thionins in plant protection. Crit. Rev. Plant Sci., 1994, 13: 1-16.
19. C h a n L., C h i n g - S a n C., S h w u - B i n H. Characterization of resistance to Callosobruchus maculatus (Coleoptera: Bruchidae)in mungbean variety VC6089A and its resistance-associated protein VrD1. J. Econom. Entomol., 2005, 98(4): 1369-1373.
20. T h e v i s s e n K., O s b o r n R.W., A c l a n d D.P. e.a. Specific, high affinity binding sites for an antifungal plant defensin on Neurosppora crassa hyphae and microsomal membranes. J. Biol. Chem., 1997, 272(51): 32176-32181.
21. T h e v i s s e n K., G h a z i A., De S a m b l a n x G.W. e.a. Fungal membrane responses induced by plant defensins and thionins. J. Biol. Chem., 1996, 271(25): 15018-15025.
22. T h e v i s s e n K., T e r r a s F.T., B o k e t W.F. Permeabilization of fungal membranes by plant defensins inhibits fungal growth. Appl. Environ. Microbiol., 1999, 65: 5451-5458.
23. T h e v i s s e n K., O s b o r n R.W., A c l a n d D.P. e.a. Specific binding sites for an antifungal plant defensin from dahlia (Dahlia merckii) on fungal cells are required for antifungal activity. Mol. Plant Microbe Interact., 2000, 13: 54-61.
24. P e l e g r i n i P.B., F r a n c o O.L. Plant gamma-thionins: novel insights on the mechanism of action of a multi-functional class of defense proteins. Int. J. Biochem. Cell Biol., 2005, 37(11): 2239-2253.
25. T h e v i s s e n K., W a r n e c k e D.C., F r a n c o i s I.E.J.A. e.a. Defensins from insects and plants interact with fungal glucosylceramides. J. Biol. Chem., 2004, 279(6): 3900-3905.
26. T h e v i s s e n K., I d k o w i a k - B a l d y s J., I m Y.J. e.a. SKN1, a novel plant defensin-sensitivity gene in Saccharomyces cerevisiae, is implicated in sphingolipid biosynthesis. FEBS Letters, 2005, 579(9): 1973-1977.
27. A e r t s A.M., F r a n c o i s I.E., B a m m e n s L. e.a. Level of M(IP)(2)C sphingolipid affects plant defensin sensitivity, oxidative stress resistance and chronological life-span in yeast. FEBS Letters, 2006,580(7): 1903-1907.
28. V e r o n e s e P., R u i z M.T., C o c a M.A. e.a. In defense against pathogens: both plant sentinels and foot soldiers need to know the enemy. Plant Physiol., 2003, 131: 1580-1590.
29. P e n n i n c k x I.A.M.A., E g g e r m o n t K., T e r r a s F.R.G. e.a. Pathogen-induced systemic activation of a plant defensin gene in Arabidopsis follows a salicylic acid-independent pathway. Plant Cell., 1996, 8: 2309-2323.
30. T h o m m a B.P.H.J., E g g e r m o n t K., P e n n i n c k x I.A.M.A. e.a. Separate jasmonate-dependent and salicylate-dependent defense-response pathways in Arabidopsis are essential for resistance to distinct microbial pathogens. PNAS USA, 1998, 95: 15107-15111.
31. T e r r a s F.R., P e n n i n c k x I.A.M.A., G o d e r i s I.J. e.a. Evidence that the role of plant defensins in radish defense responses is independent of salicylic acid. Planta, 1998, 206: 117-124.
32. E p p l e P., A p e l K., B o h l m a n n H. ESTs reveal a multigene family for plant defensins in Arabidopsis thaliana. FEBS Letters, 1997, 400: 168-172.
33. D e S a m b l a n x G.W., G o d e r i s I.J., T h e v i s s e n K. e.a. Mutational analysis of a plant defensin from radish (Raphanus sativus L.) reveals two adjacent sites important for antifungal activity. J. Biol. Chem., 1997, 272: 1171-1179.
34. S c h a a p e r W.M.M., P o s t h u m a G.A., P l a s m a n H.H. e.a. Synthetic peptides derived from the β2-β3 loop of Raphanus sativus antifungal protein 2 that mimic the active site. J. Peptide Res., 2001, 57: 409-418.
35. К о м а л е т д и н о в а Ф.М. Методы генетической трансформации растений картофеля штаммами Agrobacterium, содержащими гены устойчивости к болезням и вредителям растений. Автореф. канд. дис. СПб, 1997.
36. P a r a s h i n a E.V., S e r d o b i n s k i i L.A., K a l l e E.G. e.a. Genetic engineering of oilseed rape and tomato plants expressing a radish defensin gene. Rus J. Plant Physiol., 2000, 47: 417-423.
37. W a n g Y.P., N o w a k G., C u l l e y D. e.a. Constitutive expression of pea defense gene DRR206 confers resistance to blackleg (Leptosphaeria maculans) disease in transgenic canola (Brassica napus). Mol. Plant Microbe Interact., 1999, 12: 410-418.
38. G a o A.G., H a k i m i S.M., M i t t a n c k C.A. e.a. Fungal pathogen protection in potato by expression of a plant defensin peptide. Nat. Biotechnol., 2000, 18(12): 1307-1310.
39. K a w a t a M., N a k a j i m a T., Y a m a m o t o T. e.a. Genetic engineering for disease resistance in rice (Oryza sativa L.) using antimicrobial peptides. Jarq., 2003, 37(2): 71-76.
ROLE OF PLANT DEFENSINS IN COMPLEX SYSTEM OF PLANT PROTECTION (a review)
F.M. Komaletdinova
The properties of plant proteins — defensins, possessing fungicidal, antimicrobial and in-secticidal activity, were considered. The author discusses the structure, expression and localization in plant tissues of different classes of these proteins, varied in their action on pathogens and primary structure, the positioning of aminoacids, important for protective action, the supposed mechanism of action of transgenic plants with genes of plant defensins. The presented data suggest about defensins participation in system plant protection against biotic and abiotic stress.
Key words: antifungal peptides, plant defensins, defense responses.
Институт цитологии РАН, |
Поступила в редакцию
|