УДК 635.925:581.143.6
О ПРИМЕНЕНИИ КУЛЬТУРЫ ИЗОЛИРОВАННЫХ ЗАРОДЫШЕЙ ПРИ ПОЛУЧЕНИИ ГИБРИДНЫХ ФОРМ ТЮЛЬПАНА
А.Ш. АХМЕТОВА, Р.К. БАЙБУРИНА, Л.Н. МИРОНОВА
Выявляли перспективность культуры изолированных зародышей для получения и ускоренного размножения гибридных форм тюльпана. Подбирали условия стерилизации исходного растительного материала и сроки изоляции зародышей, наиболее благоприятные для их успешного развития in vitro. Определяли оптимальные условия культивирования зародышей (состав питательной среды, регуляторы роста, световой и температурный режим) для обеспечения интенсивной пролиферации побегов и формирования микролуковиц.
Ключевые слова: гибридные формы тюльпана, культивирование зародышей in vitro, размножение цветочных культур.
Цветочные культуры как высокодекоративные растения широко применяются в практике озеленения, ландшафтного дизайна и т.д., в связи с чем с ними проводится большая селекционная работа (1). Процесс сортосмены часто сдерживается ввиду низкого коэффициента вегетативного размножения, который не позволяет получать достаточное число экземпляров растений новых сортов и форм. Поэтому при селекции и размножении традиционными методами для выведения нового сорта требуется 8-10 лет (2). В настоящее время с целью повышения эффективности селекции многих растений, в том числе тюльпанов, используют биотехнологические методы размножения. При разработке этих методов предпочтение отдают тому типу экспланта, который характеризуется большой регенерационной способностью.
Необходимость получения новых гибридных форм для селекции тюльпанов и ускоренного размножения ценных генотипов стимулирует ученых ряда стран вести разработку усовершенствованных методик микроклонального размножения тюльпанов в культуре ткани. Так, в Японии разработан метод образования адвентивных почек и пролиферации луковичек на вырезанных сегментах чешуй тюльпана лесного (Tulipа silvestris L.) и сорта Apeldoorn (3, 4). Г.П. Выхристовой и С.С. Копыловым разработана методика культивирования меристем из пазушных почек сортовых тюльпанов (5). Удачная попытка ускорить размножение тюльпанов в культуре ткани с использованием в качестве первичных эксплантов сегментов цветоноса (из луковиц, начинающих прорастать при хранении) осуществлена английскими учеными (6-8). Некоторые авторы применяют и другие части растения для получения культурыin vitro — главным образом сегменты листьев, тычиночные нити, незрелые завязи генеративного происхождения (9). Генеративные органы, характеризующиеся высоким содержанием фитогормонов, обладают наибольшей регенерационной способностью (10).
Для растений рода Tulipa при разработке способов регенерации и размножения in vitro в качестве эксплантов используют изолированные зародыши. При помощи метода культуры зародышей удалось создать ряд гибридных форм тюльпанов от пяти комбинаций скрещивания (11, 12). Культура зародышей in vitro — один из приемов, позволяющих при отдаленном скрещивании получать жизнеспособное потомство. Известны работы А.И. Здруйковской-Рихтер, в которых эмбриокультура применяется при селекции плодовых, косточковых и цветочных культур (13-15).
Цель наших исследований — оценить перспективность метода культуры изолированных зародышей для обеспечения интенсивной пролиферации побегов и формирования микролуковиц у гибридных форм тюльпана, в частности подобрать условия стерилизации исходного растительного материала, определить сроки изоляции зародышей, наиболее благоприятные для их успешного развития in vitro, и оптимальные условия культивирования (состав питательной среды, регуляторы роста, световой и температурный режимы).
Методика. Исходным материалом служили зародыши семян гибридных форм тюльпана, полученных от пяти комбинаций скрещивания с участием девяти сортов зарубежной селекции: Uncle Tom х Klaudia, New Look х Marietta, Blue Heron х Queen of Night, Alladin х Blue Heron и Sherley х Angelique. Согласно международной классификации 1987 года, использованные сорта принадлежат к четырем классам: Махровые поздние, Лилиецветные, Бахромчатые и Простые поздние. Всего за период исследований было введено в культуру in vitro 140 зародышей.
Стерилизацию питательных сред, посадочного материала и работу в асептических условиях проводили согласно общепринятым методикам (16). При подготовке растительного материала к дезинфицированию невскрывшиеся коробочки промывали в мыльном растворе в течение 20 мин, затем в концентрированном растворе перманганата калия 15 мин и в проточной воде 15-20 мин. Семена стерилизовали в 70 % растворе этанола в течение 0,5 мин, затем последовательно в растворах диацида и хлорамина Б в концентрации соответственно 0,1 и 0,2 % в течение 2 и 4 мин.
С целью выявления оптимальных сроков изоляции зародыши отбирали на 40-70-е сут после опыления. Экспланты высаживали на безгормональную среду Мурасиге-Скуга (МS) (17) с добавлением тиамина, пиридоксина, никотиновой и аскорбиновой кислот (по 1,00 мг/л), сахарозы (50,00 г/л), агара (5,50 г/л) и 10 сут культивировали в темноте при 25 °С. Для стимуляции органогенеза в питательную среду МS добавляли 6-бензил-аминопурин (6-БАП) и a-нафтилуксусную кислоту (НУК) (оптимальное содержание установили в серии экспериментов, позволивших определить эффективную комбинацию 3,00 мг/л БАП + 0,15 мг/л НУК) и культивировали при температуре 25 °С, 16-часовом фотопериоде, освещенности 3 тыс. лк.
Микролуковицы получали, помещая образовавшиеся побеги на питательную среду, из которой исключали регуляторы роста цитокининовой природы, а НУК заменяли на индолилмасляную кислоту (ИМК) в количестве 0,50 мг/л.
Данные обрабатывали статистически по методу Г.Н. Зайцева (18).
Результаты. Создание гибридных форм тюльпанов — сложный и трудоемкий процесс, причем многие эксперименты оказываются неудачными, поскольку из-за несовместимости эндоспермов и зародышей последние погибают (19). В 2004 году мы выполнили 57 принудительных скрещиваний тюльпанов различных сортов. В результате только в пяти комбинациях получили семена. Часть семян использовали для культивирования in vitro, остальные высеяли в открытый грунт под зиму. Однако в обоих вариантах прорастание семян не наблюдали, поэтому был апробирован метод культивирования изолированных зародышей.
Все испытанные варианты дезинфекции семян тюльпана оказались перспективными для использования (табл. 1). Максимальное число жизнеспособных (96,8 %), минимальное — инфицированных (12,5 %) и некротизированных (3,2 %) семян удалось получить при последовательном выдерживании в 70 % этаноле (0,5 мин) и 0,2 % растворе диацида (4 мин).
| 1. Показатели стерильности и жизнеспособности семян тюльпанов, введенных в культуру in vitro, при разных вариантах обработки дезинфицирующими растворами | ||||||
Вариант обработки |
Введено в культуру, шт. |
Доля, % |
||||
раствор (концент- |
время обработ- |
инфици- |
стериль- |
некроти- |
жизне- |
|
Этанол (70,0) |
0,5 |
30 |
24,4 |
75,6 |
8,6 |
91,4 |
Этанол (70,0) |
0,5 |
30 |
21,6 |
78,4 |
10,4 |
88,0 |
Этанол (70,0) |
0,5 |
30 |
19,8 |
80,2 |
11,8 |
86,6 |
Этанол (70,0) |
0,5 |
30 |
12,5 |
87,5 |
3,2 |
96,8 |
Этанол (70,0) |
0,5 |
30 |
28,3 |
71,7 |
5,6 |
94,4 |
Этанол (70,0) |
0,5 |
30 |
22,9 |
77,1 |
5,1 |
94,3 |
Этанол (70,0) |
0,5 |
30 |
22,0 |
78,0 |
7,9 |
91,4 |
Этанол (70,0) |
0,5 |
30 |
21,9 |
78,1 |
28,8 |
71,2 |
Результаты получения полноценных растений из изолированных зародышей на искусственной питательной среде зависят от многих факторов, в том числе от фазы развития и сроков изоляции. Для тюльпанов характерно замедленное развитие и дифференциация зародыша. Даже на 30-е сут после опыления зародыши тюльпанов плохо просматривались и попытки извлечь их не дали положительных результатов. Лишь на 40-е и 50-е сут сформировались зародыши длиной до 1,0 мм, однако вычленение их из семян также было затруднено. Оптимальный срок изоляции зародышей — с 53-х по 56-е сут после опыления, когда размер большей части семян достигает 1,5-3,0 мм (табл. 2).
| 2. Жизнеспособность зародышей тюльпанов in vitro в зависимости от сроков изоляции (на примере варианта скрещивания New Look x Marietta) | ||
| Время после опыления, сут | Длина зародыша, мм | Приживаемость in vitro, % (Х±х) |
| 40-е | До 1,0 | 15,40±1,63 |
| 50-е | До 1,0 | 21,90±2,81 |
| 53-е | До 1,0 1,5-3,0 |
39,60±4,53 45,60±4,87 |
| 55-е | До 1,0 1,5-3,0 |
53,20±8,31 85,50±8,95 |
| 56-е | До 1,0 1,5-3,0 |
47,90±50,40 91,00±10,37 |
| 60-е | 3,0-5,0 | 30,80±3,26 |
| 70-е | 3,0-6,0 | 33,40±3,82 |
Так, в варианте скрещивания New Look x Marietta у зародышей длиной до 1,0 мм приживаемость в культуре in vitro оказалась ниже (39,6-53,2 %), чем у более крупных (1,5-3,0 мм), у которых показатель составлял 45,6-91,0 %. Зародыши размером от 3,0 до 6,0 мм были менее жизнеспособными — 30,8-33,4 %.
Обнаружено, что даже в зрелых семенах тюльпана встречались зародыши разной величины. В частности, на 70-е сут изоляции их размеры колебались от 3,0 до 6,0 мм (см. табл. 2).
Во всех вариантах скрещивания у 53-56-суточных зародышей длиной 1,5-3,0 мм доля прижившихся варьировала от 34,3 до 89,8 %, а к 5-му мес они достигали длины 7,0-23,0 мм (табл. 3). Наиболее интенсивный рост отмечался у зародышей, полученных от комбинаций скрещивания New Look x Marietta, Alladin x Blue Heron и Blue Heron x Queen of Night, то есть на приживаемость и рост зародышей оказывал влияние генотип родительских пар.
| 3. Рост и развитие зародышей тюльпанов in vitro, полученных в разных комбинациях скрещиваний | |||
| Комбинация скрещивания |
Всего зародышей |
Длина зародыша через 5 мес, мм |
|
введено в культуру, шт. |
прижилось, % |
||
Uncle Tom x Klaudia |
30 |
51,40±6,08 |
12,0±1,3 |
| New Look x Marietta | 25 |
89,80±9,60 |
23,0±2,9 |
| Blue Heron x Queen of Night | 35 |
46,90±5,31 |
7,0±0,9 |
| Alladin x Blue Heron | 30 |
66,70±6,23 |
21,0±2,6 |
Sherley x Angelique |
25 |
34,30±3,87 |
18,0±1,5 |
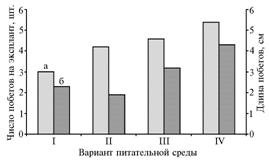
Наиболее активную пролиферацию побегов наблюдали у эксплантов на среде, содержащей 6-БАП и НУК (соответственно 3,00 и 0,15 мг/л), которые были добавлены для стимуляции органогенеза (рис. 1).
В среднем число побегов на эксплант к 7-му мес культивирования составляло 5,4 шт. при длине побегов 4,3 см (рис. 2).
 |
|
|
Рис. 1. Органогенез, наблюдаемый у зародышей тюльпана in vitro на питательной среде Mурасиге-Скуга, содержащей 6-бензилами-нопурин (3,00 мг/л) и a-нафтилуксусную кислоту (0,15 мг/л) (на примере комбинации скрещивания New Look ´ Marietta). |
||
В результате последующего 4-6-кратного субкультивирования регенерантов на питательной среде с добавлением 6-БАП и НУК происходила элонгация побегов, к 10-му мес они достигали высоты 5,0-5,5 см. Для стимуляции процесса формирования микролуковиц из питательной среды исключили цитокинины, НУК заменили на ИМК.
Выращивание растений-регенерантов на питательной среде с 0,50 мг/л ИМК и повышенным содержанием сахарозы (50 г/л) при пониженной температуре (4 °С) в течение 12 нед в темноте способствовало формированию бульбообразующих побегов. Затем регенеранты переносили на свет и выдерживали при температуре 26 °С до полного формирования микролуковиц, которое при указанном режиме завершалось за 30-120 сут (рис. 3).
|
Рис. 2. Развитие побегов на изолированных зародышах тюльпанов в зависимости от содержания 6-бензиламинопурина (6-БАП) и a-нафтилуксусной кислоты (НУК) в среде культивирования (на примере гибридного материала, полученного от скрещивания New Look x Marietta): I, II, III и IV — варианты питательной среды с содержанием 6-БАП и НУК соответственно 0,50 и 0,15; 1,00 и 0,05; 2,00 и 0,10; 3,00 и 0,15 мг/л; а — число побегов на эксплант, б — длина побегов. |
Максимальный выход микролуковиц получили в комбинации скрещивания Alladin x Blue Heron (39,9 %). В комбинациях New Look x Marietta, Blue Heron x Queen of Night, Uncle Tom x Klaudia и Sherley x Angelique этот показатель составлял соответственно 16,1; 15,4; 12,1 и 10,9 % от числа высаженных зародышей.
Сформировавшиеся микролуковицы высаживали в почвенный субстрат, состоящий из дерновой почвы и песка в соотношении 2:1 (приживаемость микролуковиц достигала 70-85 %).
 |
|
| Рис. 3. Формирование микролуковиц тюльпана на побегах, полученных из зародышей при использовании питательной сре- | |
ды Мурасиге-Скуга, содержащей индолилмасляную кислоту (ИМК, 0,50 мг/л). |
|
Таким образом, в лесостепной зоне Башкирского Предуралья получение гибридных форм тюльпана затруднено в связи с низкой завязываемостью семян и невысокой всхожестью как в лабораторных, так и в полевых условиях. При обработке семян все испытанные варианты стерилизующих растворов были эффективными, однако незначительные преимущества давал следующий режим: 70 % этанол в течение 0,5 мин и 0,2 % раствор диацида в течение 4 мин. В наших опытах эмбриокультура оказалась перспективным способом получения межсортовых гибридов тюльпана. Оптимальный срок изоляции зародышей семян — 53-56-е сут после опыления; для получения жизнеспособных эксплантов и повышения их приживаемости в культуре in vitro рекомендуется использовать дифференцированные зародыши длиной 1,5-3,0 мм. Период от опыления до получения микролуковиц из изолированных зародышей тюльпана составляет 17-19 мес и зависит от сортовых особенностей родительских форм и условий культивирования in vitro. Выход микролуковиц с одного экспланта в среднем составляет 6-8 шт. Следовательно, использование метода эмбриокультуры позволяет не только получать гибридные формы тюльпана, но и одновременно размножать их.
Л И Т Е Р А Т У Р А
1. Р ы н д и н А.В., К р а в ц о в И.А., М о х н о В.С. Состояние и перспективы селекционных исследований по субтропическим и цветочным культурам на юге России. Мат. науч.-практ. конф. «Инновационные подходы в селекции цветочно-декоративных, субтропических и плодовых культур». Сочи, 2005: 3-19.
2. В е ч е р н и н а Н.А., Т а в р т к и л а д з е О.К., К л е м е н т ь е в а Л.А. и др. Особенности регенерации и размножения растений рода Iris (Irididaceae) in vitro. Растительные ресурсы, 2004, 40(4): 56-64.
3. N i s h i u s h i Y. Studies on vegetative propagation of tulips. II. Formation and development of adventitions buds in the excised bulb scale cultured in vitro. Soc. Hort. Sci., 1979, 48(1): 92-105.
4. N i s h i u s h i Y. Studies on vegetative propagation of tulips. IV. Regeneratin of bulblets in bulb scale segments cultured in vitro. Soc. Hort. Sci., 1980, 49(2): 235-240.
5. В ы х р и с т о в а Г.И., Д а м е р И.Ф. Индукция органогенеза в культуре ткани тюльпанов. Науч. тр. НИИ горного садоводства и цветоводства.1986, вып. 33: 108-114.
6. W r i g h t N.A., A l d e r s o n P.G. The grouth of tulip tissies in vitro. Acta Hort., 1980, 19(1): 263-270.
7. R i c e R.D., A l d e r s o n P.G. , W r i g h t N.A. Induction of bulbling of tulip shoots in vitro. Sci. Hort., 1983, 20(1): 377-390.
8. A l d e r s o n P.G., R i c e R.D., W r i g h t N.A. The potential for propagating tulips through tissue culture. The Plant Propagator, 1983, 29(4): 10-13.
9. C u s t e r s J.B.M., E i k e l b o o m W., B e r g e r v o e t J.H.W. e.a. Sci. Hort., 1992, 51(1-2): 111-122.
10. Б а й б у р и н а Р.К., М у х а м е т в а ф и н А.А., М и р о н о в а Л.Н. Особенности регенерации гибридов азиатских лилий из фрагментов соцветий в культуре in vitro. С.-х. биол., 2006, 1: 80-85.
11. К о л о м и е ц Т.М. Использование культуры изолированных зародышей в селекции тюльпанов. Изв. ТСХА, 1997, 1: 91-96.
12. Б р а т у х и н а В.В., М о х н о В.С. Возможности получения новых форм тюльпанов путем экспериментального мутагенеза. В сб. науч. тр.: Биоресурсы, биотехнологии, экологически безопасное развитие АПК. Сочи, 2007, вып. 40: 48-62.
13. З д р у й к о в с к а я - Р и х т е р А.И. Культура изолированных зародышей и генеративных органов как метод селекции плодовых растений. В сб. науч. тр. ВАСХНИЛ: Тканевые и клеточные культуры в селекции растений. М., 1979: 57-70.
14. З д р у й к о в с к а я - Р и х т е р А.И. Культура зародышей in vitro и получение новых форм растений. Докт. дис. М., 1981.
15. З д р у й к о в с к а я - Р и х т е р А.И. Культура in vitro зародышей хурмы от межвидовой гибридизации. Бюл. Гл. бот. сада. М., 1981, вып. 121: 84-86.
16. Б у т е н к о Р.Г. Культура изолированных тканей и физиология морфогенеза растений. М., 1964.
17. M u r a s h i g e T., S k o o g F. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant., 1962, 15(13): 473-497.
18. З а й ц е в Г.Н. Математическая статистика экспериментальной ботаники. М., 1984.
19. К у д р я в ц е в а В.М. Селекция тюльпанов. Минск, 1978.
ABOUT THE USE OF ISOLATED EMBRYO CULTURE FOR OBTAINING OF TULIP HYBRID FORMS
A.Sh. Akhmetova, R.K. Baiburina, L.N. Mironova
The authors detected the perspective isolated embryo culture for obtaining and accelerated propagation of tulip hybrid forms. The conditions of sterilization of initial plant material and the terms of embryo isolation favorable for their successful development in vitro were selected. Optimal conditions of embryo cultivation (the composition of nutrient medium, growth regulators, and light and temperature regimes) were determined for intensive short proliferation and microbulb formation.
Key words: tulip hybrid forms, embryo in vitro culturing, propagation of flower cultures.
Ботанический сад-институт Уфимского научного
центра РАН, |
Поступила в редакцию
|