УДК 636.2:636.082.13:575.174
ДИФФЕРЕНЦИАЦИЯ ПОРОД КРУПНОГО РОГАТОГО СКОТА С ИСПОЛЬЗОВАНИЕМ МУЛЬТИЛОКУСНОГО МЕЖМИКРОСАТЕЛЛИТНОГО АНАЛИЗА (ISSR-PCR) (обзор)
Ю.А. СТОЛПОВСКИЙ1, M. АХАНИ АЗАРИ1, 2, А.Н. ЕВСЮКОВ1, Н.В. КОЛ1, М.Н. РУЗИНА1, Л.Н. ВОРОНКОВА1, Г.Е. CУЛИМОВА1
Исследовали животных 19 пород и одного селекционного типа (всего 21 популяция) крупного рогатого скота европейского, азиатского и африканского происхождения. Выявлено 66 амплифицируемых фрагментов ДНК разной длины. Методами многомерного шкалирования и главных компонент показано, что обнаруженное сходство и различия по частоте встречаемости фрагментов ДНК позволяют дифференцировать виды Bos taurus и B. indicus, исследованные породы, а также выявлять филогенетические взаимоотношения между ними. Полученное распределение согласуется с историей селекции и разведения, что указывает на перспективность применения полилокусных маркеров для изучения генетических связей этих пород.
Ключевые слова: межмикросателлитный анализ, ДНК-маркеры, породы крупного рогато скота, дифференциация, филогенез.
В XX веке считалось, что одомашнивание крупного рогатого скота (КРС) (в том числе зебу) происходило в трех основных центрах — Индийском (современная территория Индии и Пакистана), Средиземноморском (побережье Средиземного моря), Юго-западном азиатском (Малая Азия, Кавказ, Иран) (1), и если его происхождение от тура сомнений не вызывало, то относительно места и времени одомашнивания мнения расходились. Внести ясность помогло применение современных методов анализа ДНК. Оказалось, что были два центра доместикации и два диких предка современного КРС, различия между которыми достигали видового ранга (2). Первый из центров располагался на Ближнем Востоке между Черным, Каспийским, Средиземным морями и Персидским заливом (здесь был одомашнен предок европейского скота Bostaurus), второй — на территории нынешнего Пакистана (отсюда происходит горбатый рогатый скот зебу — B. indicus). По данным анализа нуклеотидных последовательностей D-петли митохондриальной ДНК, дикие предки двух групп пород КРС дивергировали 200-1000 тыс. лет назад, то есть задолго до доместикации, происходившей 8-10 тыс. лет назад (2).
В распространении домашних животных важную роль сыграло переселение народов с Востока на Запад. Так, народы Азии, переместившись в Европу (4-5 тыс. лет до н.э.), привели с собой уже одомашненный скот. Изучая геномный полиморфизм доместицированных видов с использованием ДНК-маркеров, можно получить аргументы для опровержения или подтверждения гипотез, выдвинутых на основе данных археологии, палеонтологии, истории и других наук
К сожалению, в Восточной Европе и России подобный анализ в достаточном объеме пока не проводился. В связи с этим исследования генофондов на основе ISSR-фингерпринтинга (ISSR — inter simple sequence repeats, оценка мультилокусного межмикросателлитного полиморфизма), несомненно, представляют интерес для определения филогении пород и уточнения происхождения современных популяций КРС, прежде всего в Российской Федерации.
Целью настоящей работы было сравнительное исследование генетической структуры в популяциях пород крупного рогатого скота европейского, азиатского и африканского происхождения с использованием мультилокусного межмикросателлитного анализа.
Методика. Исследовали ДНК 761 особи КРС 19 пород и одного селекционного типа (кавказский тип бурой швицкой породы из Республики Дагестан), представленного двумя популяциями — СПК «Дружба» (n = 48) и ГУП «Дылымское» (n = 56). Из шести изученных отечественных пород в бывшем СССР созданы бестужевская (n = 54) и костромская (n = 60), более древнее происхождение имеют красная эстонская (n = 50), калмыцкая (n = 29), ярославская (n = 62), якутская (n = 30) и серый украинский скот (n = 45). Образцы ДНК от животных иностранных пород — африканской н’дама (n = 30), новозеландской фризской (n = 29), голштино-фризской (n = 25), норвежской красной (n = 30), французских нормандской (n = 23) и монбельярдской (n = 29), индийских (B. indicus) хариана (n = 9), тарпаркар (n = 9) и cахивал (n = 7) были любезно предоставлены д-ром K. Meade и д-ром D. MacHugh из Сельскохозяйственного университетского колледжа г. Дублина (Ирландия). Образцы ДНК немецкой черно-пестрой породы (n = 42) получены от д-ра V. Reiharat и д-ра E. Gernand из Научно-иссле-довательского центра животноводства Академии сельскохозяйственных наук (г. Думерсторф, Германия). Образцы крови скота хогорого (n = 47) и Южной Гоби (n = 47) из Монголии были получены совместной российско-монгольской экспедицией.
В ISSR-PCR (inter simple sequence repeats—polymerase chain reaction) использовали праймеры (AG)9C и (GA)9C (3). При ПЦР амплификацию проводили в следующем режиме: начальная денатурация — 2 мин при 94-95 °С, денатурация — 30 c при 94 °С, отжиг — 30 с при 55 °С, синтез — 2 мин при 72 °С, заключительный синтез — 7-10 мин при 72 °С; число циклов амплификации — 35-37 (подробнее методика описана нами ранее) (4). Продукты амплификации фракционировали в 2 % агарозном геле при напряжении 120 В в течение 100-110 мин. В качестве маркера молекулярных масс использовали GeneRulerTM 100 bp DNA Ladder Plus («MBI Fermentas», Латвия). После электрофореза гели окрашивали бромистым этидием и фотографировали в коротковолновом УФ-свете.
Статистическую обработку данных осуществляли с помощью стандартных компьютерных программ Microsoft Office, многомерное шкалирование и анализ главных компонент — в программе Statistica 8.0.
Результаты. Сравнительное исследование пород КРС европейского, азиатского и африканского происхождения позволило полнее рассмотреть филогенетические взаимоотношения между ними. Всего выявили 66 ПЦР-продуктов по двум типам ISSR-маркеров, из которых 64 оказались полиморфными. С праймером (AG)9C синтезировалось 37 продуктов амплификации, в том числе 34 полиморфных, с праймером (GA)9C — 29 (все были полиморфные); размер фрагментов — от 2500 до 160 п.н. Частоты встречаемости фрагментов для AG- и GA-ISSR маркерных систем для 19 пород КРС и одного селекционного типа представлены в таблице.
Как правило, породы отличались друг от друга по спектру полученных ISSR-фрагментов, их частоте (см. табл.), а также по интенсивности свечения зон фрагментов на электрофореграммах, что, по-видимому, обусловлено разной представленностью участков амплифицируемой ДНК в геномах.
Так, по праймеру (AG)9C наиболее крупный фрагмент с молекулярной массой 2500-2300 п.н. (A1) встречался только в пяти популяциях КРС — монгольского скота из Южной Гоби (0,256), норвежской красной (0,225), тарпаркар (0,184), хариана (0,118) и якутской (0,051) пород. Были выявлены фрагменты, частота которых по породам достоверно различалась (P < 0,05). Например, фрагмент с молекулярной массой 1550-1500 п.н. (A6) обнаружили у всех пород (частота — от 0,408 до 1), кроме серого украинского и калмыцкого скота. По частоте фрагмента A20 длиной 670-640 п.н. большинство европейских пород достоверно отличались от пород азиатского происхождения, в частности от зебувидного скота из Индии (B. indicus). Аналогичное распределение ISSR-фрагментов наблюдали при использовании праймера (GA)9C (см. табл.). Полученные результаты позволяют заключить, что по выявленному сходству и различиям в распределении ISSR-фрагментов можно дифференцировать как спектры ПЦР-про-дуктов, так и собственно породы КРС.
Стоит отметить, что c праймером (GA)9C полученные спектры ампликонов были консервативнее, выявлялось больше породоспецифичных фрагментов, а разделение популяций по селекционному и географическому критерию оказалось более четким. Например, фрагмент A20 встречался только у животных красной эстонской породы, а фрагмент A24 — исключительно у животных породы тарпаркар. Другими словами, с помощью праймера (GA)9C можно выявить полиморфизм, отражающий межпородное и межпопуляционное разделение/сходство, а с праймером (AG)9C — провести более детальную кластеризацию и анализ пород, то есть исследовать их внутрипопуляционный полиморфизм. Об этом свидетельствуют показатели разнообразия: доля межпопуляционного (межпородного) разнообразия суммарно по всем исследованным популяциям (GST) по праймеру (GA)9С составила 69,9 %, по (AG)9С — 46,2 %, внутрипородное разнообразие (HS) равнялось соответственно 0,0343 и 0,0916, общее разнообразие (HT) — 0,1139 и 0,1704.
Применение методов многомерного шкалирования и главных компонент позволило, с одной стороны, детализировать генетические взаимоотношения между породами, с другой — графически визуализировать пространственное распределение анализируемых групп животных (рис. 1, 2). Подчеркнем, что интерпретация полученных данных по внутривидовой и межпородной дифференциации может измениться при увеличении числа изученных пород.
История селекции, классификация и регионы разведения известны для большей части исследованных нами пород. Так, породы хариана, тарпаркар и сахивал, а также н’дама относятся к группе афро-азиатского происхождения B.indicus, остальные в основном принадлежат к виду собственно рогатого скота B. taurus, причем монгольскую, калмыцкую и якутскую породы некоторые авторы считают отдельным подвидом B.taurus turano-mongolicus (5, 6). Среди анализируемых популяций есть породы, относящиеся по классификации ФАО к трансграничным международным (породы, которые разводят во многих странах, например голштино-фриз-ская и черно-пестрая), трансграничным региональным (распространены в нескольких странах, но в одном регионе — н’дама, красная эстонская) и местным, которых среди изучаемых большинство (калмыцкая, ярославская, костромская и т.д.).
Местные породы представляют несомненный интерес при изучении эволюции рода Bos, так как многие из них сохранили в своих генофондах генные комплексы (ассоциации) предковой формы КРС.
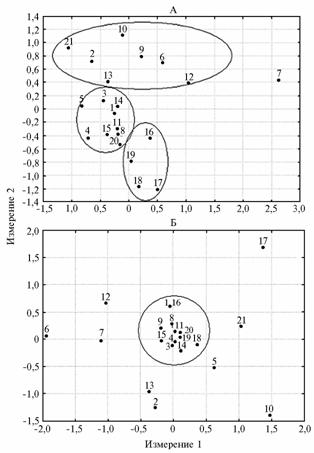 |
Рис. 1. Результаты многомерного шкалирования на плоскости, выполненного на основе данных по праймерам (AG)9C (AG-ISSR маркеры, А) и (GA)9C (GA-ISSR маркеры, Б): 1-21 — соответственно породы (популяции) фризская, калмыцкая, черно-пестрая, н’дама, бестужевская, бурая швицкая (СПК «Дружба», Республика Дагестан), бурая швицкая (ГУП «Дылымское», Республика Дагестан), голштино-фризская, костромская, красная эстонская, монбельярдская, скот Южной Гоби (Монголия), скот хогорого (Монголия), норвежская красная, нормандская, сахивал, тарпаркар, хариана, якутская, ярославская, серый украинский скот. |
При использовании метода многомерного шкалирования рас-пределение, которое полу-чили по AG-ISSR и GA-ISSR маркерам, оказалось неодинаковым (рис. 1). Было продемонстрировано, что изменчивость по AG-ISSR маркерам позволяет дифференцировать популяции, принадлежащие к видам B. ta-urusи B. indicus (см. рис. 1). Так, по этим маркерам образовались три группы. Первая из них («среднее облако», расположенное в центральной части рисунка) — ос-новная (включает большинство пород), во вторую («верхнее облако») вошли две популяции монгольского скота, серый украинский и калмыцкий скот, красная эстонская и костромская породы, а также популяция кавказского типа бурой швицкой породы (СПК «Дружба»), третью группу («нижнее облако») образовали породы сахивал, тарпаркар, хариана и якутский скот. Можно предположить, что такое распределение отражает определенное филогенетическое родство или, наоборот, отсутствие связей между породами. Основное ядро образовали породы европейского происхождения преимущественно черно-пестрого корня, отдельно от них расположились породы из Индии, Монголии, породы бурого и красного корня, а также якутский скот и степные породы (калмыцкая и серая степная). Местоположение популяции кавказского типа бурого швицкого скота (ГУП «Дылымское») (см. рис. 1) указывает на значительное отличие его генофонда (по всей видимости, он в большей степени представлен генофондом местного дагестанского скота) от всех исследованных в настоящей работе.
Заслуживает внимания тот факт, что самая северная для ареала вида B.taurus якутская популяция на схеме приближена к породам из Индии. Такой результат был получен методом многомерного шкалирования при разных условиях (компонентах), и в большинстве случаев породы хариана, тарпаркар и якутский скот располагались рядом друг с другом. В этой связи можно высказать два предположения: первое — якутская порода много раз проходила через так называемое «бутылочное горлышко», в процессе чего дрейф генов случайным образом значительно изменил частоты ISSR-маркеров, второе — предки якутского скота произошли от предка зебу, а не от монгольского скота.
По GA-ISSR маркерам у пород прослеживалось более однородное распределение, отражающее как родственные связи, так и их отсутствие. В основном образовался единый пул, от которого отдалились породы тарпаркар (Индия), красная эстонская (Россия), калмыцкая (Россия), серый степной скот (Россия), скот хогорого и Южной Гоби (Монголия), а также кавказский тип бурой швицкой породы. Именно перечисленные генофонды ассоциировались в нашем исследовании с краевыми популяциями, селекционная история которых в меньшей степени связана с преобладающей частью исследуемых пород.
Формирование групп оказалось достаточно адекватным историческим событиям и зоотехнической практике, что указывает на перспективность использования полилокусных маркеров для изучения филогенеза КРС. Нельзя не отметить, что в основном исследованные популяции имеют смешанное происхождение, поэтому большинство пород при многомерном шкалировании приближались друг к другу (см. рис. 1). Связующим звеном при этом служат голштино-фризская и черно-пестрая породы, генофонд которых активно использовали и используют в межпородных скрещиваниях не только на территории бывшего СССР, но и в мире.
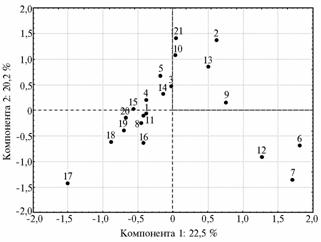 |
Рис. 2. Распределение изученных популяций отечественных и иностранных пород крупного рогатого скота в пространстве главных компонент по общему набору маркеров, полученных с помощью праймеров (AG)9C и (GA)9C: 1-21 — соответственно породы (популяции) фризская, калмыцкая, черно-пестрая, н’дама, бестужевская, бурая швицкая (СПК «Дружба», Республика Дагестан), бурая швицкая (ГУП «Дылымское», Республика Дагестан), голштино-фризская, костромская, красная эстонская, монбельярдская, скот Южной Гоби (Монголия), скот хогорого (Монголия), норвежская красная, нормандская, сахивал, тарпаркар, хариана, якутская, ярославская, серый украинский скот. |
Для более об-общенного анализа вза-имоотношений между исследуемыми породами мы объединили ISSR-маркеры (AG и GA) и получили проек-цию на плоскости глав-ных компонент (рис. 2). Наблюдаемое распределение в основном под-твердило результаты многомерного шкалирования. От большинства пород, расположившихся компактно, отделились восемь, которые условно можно разбить на три группы: первая — порода тарпаркар, вторая — хогорого из Монголии и серый украинский скот, а также калмыцкая, красная эстонская и костромская породы, третья — две популяции кавказского типа бурой швицкой породы и монгольский скот из Южной Гоби. Порода тарпаркар, серый степной скот и кавказский тип бурого швицкого скота занимали крайние положения, следовательно, их генофонды отличаются от генофондов большинства изученных популяций КРС, которые представлены преимущественно европейскими породами. Можно предположить, что три эти популяции произошли не от европейского предка, а от двух видов азиатского прародителя или имеют полифилетическое происхождение.
Таким образом, обнаружено сходство и различия по частоте ISSR-фрагментов у ряда пород крупного рогатого скота разного происхождения, которые позволяют дифференцировать виды Bostaurus и B. indicus. Дифференциация и характеристика генетических взаимоотношений между породами на основе ISSR-фингерпринтинга (в том числе наши данные) могут использоваться как при выборе селекционной стратегии (например, при межпородных скрещиваниях), так и для дальнейшего исследования филогенеза видов B. taurus и B. indicus. Более того, поскольку результаты ISSR-маркирования достаточно точно отражают историю селекции пород, предоставляется возможность изучать с их помощью эволюцию не только рода Bos, но и вида Homo sapiens. Сведения, полученные при сравнительных исследованиях полных геномов или отдельных участков ДНК сельскохозяйственных животных, позволяют реконструировать процесс расселения человека по Земле, формирования популяций, представляющих разные этнические группы, а также появления культурных и технологических инноваций, в частности возникновения и распространения скотоводства в мире.
Авторы благодарят Цэндсурэна Цэдева (Монголия), Г.С. Караева (Россия, Дагестанское племобъединение) за предоставленную возможность получить образцы крови крупного рогатого скота.
Л И Т Е Р А Т У Р А
1. К р а с о т а В.Ф., Л о б а н о в В.Т., Д ж а п а р и д з е Т.Г. Разведение сельскохозяйственных животных. М., 1983.
2. L o f t u s R.T., M a c H u g h D.E., B r a d l e y D.G. e.a. Evidence for two independent domestications of cattle. PNAS US, 1994, 91: 2757-2761.
3. Z i e t k i e w i c z E., R a f a l s k i A., L a b u d a D. Genome fingerprinting by sequence repeat (SSR)-anchored polymerase chain reaction amplification. Genomics, 1994, 20: 176-183.
4. С т о л п о в с к и й Ю.А., Ш и м и и т Л.В., К о л Н.В., Е в с ю к о в А.Н., Р у з и
н а М.Н., Ч у р г у й - о о л О.И., С у л и м о в а Г.Е. Анализ генетической изменчивости и филогенетических связей у популяций тувинской короткожирнохвостой овцы с использованием ISSR-маркеров. С.-х. биол., 2009, 6: 34-43.
5. К о л е с н и к Н.Н. Эволюция крупного рогатого скота. Сталинабад, 1949.
6. Д м и т р и е в Н.Г. Породы скота по странам мира. Справочная книга. Л., 1978.
DIFFERENTIATION OF CATTLE BREEDS WITH THE USE OF MULTILOCUS INTERMICROSATELLITE ANALYSIS (ISSR-PCR)
Yu.A. Stolpovskii1, M. Akhani Azari1, 2, A.N. Evsyukov1, N.V. Kol1, M.N. Ruzina1, L.N. Voronkova1, G.E. Sulimova1
The authors discussed the prospects in application of transgenic technologies for commodity production of fish in commercial aquarium, for the use of fish as bioindikator organism with clear determinate pathological symptoms (for instance, for ecological monitoring, valuation of risk, influence of acute exposure of high doses and chronic effect of small doses of chemical compounds), and also the creation of DNA-vaccines of new generation, raising the safety of fish in aquaculture. The authors marked the necessity of fundamental genetic, biochemical, physiological investigations both mechanisms and consequence of expression of incorporated gene construction, as far as on genetically modified (GM) fish such works are carried out in extremely limited volume. The problem of support of biosafety of GM fish species for natural cenosis was considered. The special attention the author devoted to the application of GM in artificial fish food, that result in the involvement of GM organisms (GMO) in food chain, and to the problems of food security in connection with globalization and monopolization of GMO market.
Keywords: inter simple sequence repeats (ISSR), DNA-markers, breed of cattle, differentiation, phylogenesis.
1Учреждение Российской академии наук |
Поступилавредакцию |













