УДК 636.034:575.174:575.113
ПОЛИМОРФИЗМ ГЕНОВ ГОРМОНА РОСТА bGH И ПРОЛАКТИНА
bPRL И ИЗУЧЕНИЕ ЕГО СВЯЗИ С ПРОЦЕНТНЫМ СОДЕРЖАНИЕМ
ЖИРА В МОЛОКЕ У КОРОВ КОСТРОМСКОЙ ПОРОДЫ
И.В. ЛАЗЕБНАЯ1, О.Е. ЛАЗЕБНЫЙ2, М.Н. РУЗИНА1, Г.А. БАДИН3, Г.Е. СУЛИМОВА1
В трех стадах коров костромской породы с использованием метода ПЦР-ПДФР (полиморфизм длин рестрикционных фрагментов) исследовали генетическую структуру по генам гормона роста (bGH-AluI) и пролактина (bPRL-RsaI). Установлено преобладание аллелей L гена bGH (0,87-0,98) и A— гена bPRL (0,67-0,87) во всех выборках. Для генов bGH и bPRL значения наблюдаемой гетерозиготности (НO) составляют соответственно 0,05-0,07 и 0,26-0,43. Две из исследованных популяций достоверно различаются по обоим использованным ДНК-маркерам (P £ 0,05). По гену гормона роста bGH генотип VV не обнаружен. У генотипа VL в отличие от генотипа LL проявилась тенденция к связи с более высоким содержанием (%) жира в молоке.
Ключевые слова: костромская порода, ПЦР-ПДРФ, гены bPRL и bGH, молочная продуктивность.
Перспективность использования ДНК-маркеров молочной продуктивности у крупного рогатого скота, основанная на полиморфизме генов пролактина bPRL и гормона роста bGH, определяется спектром их функций в организме млекопитающих: эти гормоны регулируют рост и развитие, инициируют и поддерживают лактацию, влияют на обменные процессы (1-3). Многолетние исследования доказали связь между некоторыми однонуклеотидными заменами (SNP) в генах bPRLи bGH и показателями молочной продуктивности — удоем, выходом жира и белка, их процентным содержанием. Так, сообщалось о трансверсии C-G в третьем экзоне гена гормона роста bGH (2141-я нуклеотидная позиция), которая сопровождается исчезновением сайта рестрикции для эндонуклеазы AluI. Описанная SNP приводит к замене лейцина на валин в позиции 127 в белковом продукте гена bGH и известна как Leu-Val полиморфизм. У ряда пород этот полиморфизм коррелирует с показателями молочной продуктивности (4-7). Существует также ассоциация количественных и качественных признаков молочной продуктивности с синонимичной A-G транзицией в третьем экзоне гена пролактина (103-й кодон), сопровождаемой появлением сайта рестрикции для эндонуклеазы RsaI (4-7). Кроме того, полиморфизм названных локусов используют для оценки общей внутри- и межпородной изменчивости с целью коррекции негативного влияния селекционного процесса, нередко приводящего к инбридингу (8).
Костромская порода крупного рогатого скота относится к одной из трех пород бурого скота, разводимых в России. Ее особенности — высокая энергия роста, крепость конституции, стойкая передача признаков потомству, высокое качество молока. Костромская порода считается одной из наиболее продуктивных пород комбинированного направления селекции. Традиционно эту породу разводят в Костромской, Владимирской и Ивановской областях Российской Федерации, в Республике Беларусь. Последние десятилетия наблюдается неблагоприятная тенденция к сокращению ее численности. Так, с 1980 по 2004 годы поголовье костромского скота снизилось в 4,3 раза и составило 193 200 гол. (9).
Генетическую структуру костромской породы исследовали с использованием различных типов маркеров, в том числе маркеров белков крови, генов белков молока — лактальбумина и казеинов и т.д. (10-14). Данные по полиморфизму генов bPRL и bGH практически отсутствуют (14).
Учитывая снижение численности животных костромской породы, недостаточную изученность ее генетического потенциала по селекционно значимым маркерам, мы ставили задачу оценить внутрипородную изменчивость у костромского скота с использованием полиморфизма генов гормона роста bGH (AluI) и пролактина bPRL (RsaI) и выявить связь между ним и содержанием жира в молоке.
Методика. Методом ПЦР-ПДРФ (полиморфизм длин рестрикционных фрагментов) у коров костромской породы из племенных хозяйств ОПХ «Минское» (Костромской муниципальный р-н) (n = 20, 2008 год), СПК «Гридино» (Красносельский р-н, Костромская обл.) (n = 42, 2008 год) и ГОУП ПЗ «Лужки» (Нерехтский р-н, Костромская обл.) (n = 62, 2006 год) исследовали полиморфизм генов bPRL и bGH. ДНК выделяли из цельной крови (200 мкл; набор реагентов DIAtomTM DNA Prep, «Лаборатория Изоген», Россия). Амплификацию фрагментов генов bPRL (156 п.н.) и bGH (223 п.н.) проводили по стандартным методикам, как описано нами ранее (15), с применением набора GenePakTM PCR Core («Лаборатория Изоген», Россия) в термоциклере Терцик («ДНК-Технология», Россия). Использовали эндонуклеазы рестрикции RsaI и AluI в соответствии с рекомендациями фирмы-производителя («MBI Fermentas», Литва).
Статистический анализ выполняли с помощью программ Popgene v.1.31 и Statistica 6.0. (16, 17).
Результаты. Генотип BB по гену пролактина bPRL в ОПХ «Минское» выявлен не был, в ГОУП ПЗ «Лужки» встречался с низкой частотой, равной 3,2 %, в СПК «Гридино» его частота была примерно в 4 раза выше (табл. 1).
| 1. Частота генотипов и аллелей генов пролактина bPRL и гормона роста bGHв исследованных выборках крупного рогатого скота костромской породы из животноводческих хозяйств (Костромская обл.) | ||||
Хозяйство |
Генотип по гену |
Частота генотипа±se |
Аллель гена |
Частота аллеля±se |
Г е н bPRL |
||||
ГОУП ПЗ «Лужки» |
AA |
0,581±0,063 |
A |
0,774±0,043 |
AB |
0,387±0,062 |
B |
0,226±0,079 |
|
BB |
0,032±0,022 |
|
|
|
СПК «Гридино» |
AA |
0,452±0,077 |
A |
0,667±0,063 |
AB |
0,429±0,076 |
B |
0,333±0,089 |
|
BB |
0,119±0,050 |
|
|
|
ОПХ «Минское» |
AA |
0,737±0,101 |
A |
0,868±0,059 |
AB |
0,263±0,101 |
B |
0,132±0,151 |
|
BB |
0 |
|
|
|
Г е н bGH |
||||
ГОУП ПЗ «Лужки» |
VV |
0 |
V |
0,081±0,086 |
VL |
0,161±0,047 |
L |
0,919±0,026 |
|
LL |
0,839±0,047 |
|
|
|
СПК «Гридино» |
VV |
0 |
V |
0,131±0,102 |
VL |
0,262±0,068 |
L |
0,869±0,039 |
|
LL |
0,738±0,068 |
|
|
|
ОПХ «Минское» |
VV |
0 |
V |
0,025±0,156 |
VL |
0,050±0,049 |
L |
0,975±0,025 |
|
LL |
0,950±0,049 |
|
|
|
П р и м е ч а н и е. se — стандартная ошибка значений частоты генотипа и аллеля. |
||||
Соотношение AA и AB генотипов в исследованных выборках также различалось (см. табл. 1). Так, в СПК «Гридино» они были представлены с равной частотой, в двух других выборках преобладал AA генотип, причем в ОПХ «Минское» его частота достигала примерно 74 %, в ГОУП ПЗ «Лужки» — 58 %. Неодинаковое соотношение генотипов отразилось и на распределении частот аллелей. Как следствие, аллель A преобладал во всех выборках, и его частота в ряду ОПХ «Минское», ГОУП ПЗ «Лужки» и СПК «Гридино» уменьшалась, составляя соответственно 87, 77 и 67 %.
Изученные выборки характеризовались отсутствием животных с генотипом VV по гену bGH, низкой долей гетерозигот и высокой частотой гомозигот LL. Наиболее контрастное соотношение генотипов VLиLL выявили в ОПХ «Минское» (соответственно 5 и 95 %). Меньшими были различия между этими генотипами вГОУП ПЗ «Лужки» (соответственно 16 и 84 %) и в СПК «Гридино» (соответственно 26 и 74 %). В обследованных хозяйствах наблюдалось сходное распределение аллелей, а именно высокая частота аллеля L (см. табл. 1).
Проверка соответствия выявленной частоты генотипов распределению Харди-Вайнберга показала, что все анализируемые выборки по каждому из генов находятся в равновесном состоянии. Для гена bGH в ОПХ «Минское» G = 0, d.f. = 1, P = 1,000; в СПК «Гридино» G = 1,513, d.f. = 1, P = 0,219; в ГОУП ПЗ «Лужки» G = 0,791, d.f. = 1, P = 0,374. Для гена bPRL в ОПХ «Минское» G = 0,888, d.f. = 1, P = 0,346; в СПК «Гридино» G = 0,096, d.f. = 1, P = 0,757; в ГОУП ПЗ «Лужки» G = 0,664, d.f. = 1, P = 0,415.
| 2. Значения наблюдаемой (HO) и ожидаемой (HE) гетерозиготности по генам пролактина bPRL и гормона роста bGHв исследованных выборках крупного рогатого скота костромской породы из животноводческих хозяйств (Костромская обл.) | |||
Хозяйство |
Ген |
HO |
HE |
ГОУП ПЗ «Лужки» (n = 62, 2006 год) |
bPRL |
0,387±0,060 |
0,353±0,161 |
СПК «Гридино» (n = 42, 2008 год) |
bPRL |
0,429±0,076 |
0,444±0,073 |
ОПХ «Минское» (n = 20, 2008 год) |
bPRL |
0,263±0,101 |
0,229±0,170 |
ГОУП ПЗ «Лужки» (n = 62, 2006 год) |
bGH |
0,161±0,047 |
0,150±0,152 |
СПК «Гридино» (n = 42, 2008 год) |
bGH |
0,262±0,068 |
0,228±0,173 |
ОПХ «Минское» (n = 20, 2008 год) |
bGH |
0,050±0,049 |
0,049±0,060 |
В группах обследованных животных значения наблюдаемой (HO) и ожидаемой (HE) гетерозиготности (табл. 2) по каждому из маркеров достоверно не различались. В целом для гена пролактина bPRL величина HO оказалась выше, чем для гена гормона роста bGH. Стоит отметить уменьшение этих показателей по обоим маркерам в ряду СПК «Гридино», ГОУП ПЗ «Лужки», ОПХ «Минское».
Результаты G-теста (значения вероятности) (табл. 3) свидетельствуют о достоверности различий по обоим использованным маркерам между выборками из ОПХ «Минское» и СПК «Гридино», в то время как ни одна из этих выборок не отличалась от выборки из ГОУП ПЗ «Лужки».
| 3. Достоверность различий в распределении частот генотипов по генам пролактина bPRL и гормона роста bGHв исследованных выборках крупного рогатого скота костромской породы из животноводческих хозяйств (Костромская обл.) | |||
Хозяйство |
СПК «Гридино» |
ОПХ «Минское» |
ГОУП ПЗ «Лужки» |
СПК «Гридино» (n = 42, 2008 год) |
|
0,047 |
0,174 |
ОПХ «Минское» (n = 20, 2008 год) |
0,035 |
|
0,387 |
ГОУП ПЗ «Лужки» (n = 62, 2006 год) |
0,219 |
0,180 |
|
П р и м е ч а н и е. Значения вероятности (G-тест) для генотипов по генам bPRL и bGH расположены соответственно выше и ниже диагонали. |
|||
Для исследованных выборок межпопуляционная изменчивость (FST = 0,026) по генуbGHоказалась значительно ниже внутрипопуляционной (0,050; 0,161 и 0,262 соответственно в СПК «Гридино», ГОУП ПЗ «Лужки» и ОПХ «Минское»). Величина FST для гена bPRL составила 0,031, что также значительно ниже значений внутрипопуляционной изменчивости в рассматриваемых выборках (0,263; 0,387 и 0,429 соответственно в СПК «Гридино», ГОУП ПЗ «Лужки» и ОПХ «Минское»).
При оценке структуры данных общей выборки на ее сбалансированность с использованием многофакторного дисперсионного анализа полученный результат свидетельствовал о невозможности одновременного учета четырех факторов (генотипы по генам bGH и bPRL, принадлежность к линии и стаду). Поэтому из анализа были исключены линии, представленные в одном стаде или одной особью, и не рассматривалось стадо из ОПХ «Минское», поскольку оно имело только одну общую со стадами двух других хозяйств линию. Результаты проведенного трехфакторного дисперсионного анализа с учетом влияния каждого гена по отдельности, а также линии и хозяйства в качестве факторов оказались следующими: по гену bPRL фактор гена — P = 0,816, фактор линии — P = 0,364 и фактор стада — P = 0,001; по гену bGH фактор гена — P = 0,086, фактор линии — P = 0,236 и фактор стада — P = 0,001.
Приведенные значения вероятности свидетельствуют о влиянии на процентное содержание жира в молоке у костромских коров только одного фактора — принадлежности к стаду (рис.). Более высокие значения рассматриваемого признака наблюдаются у животных из стада СПК «Гридино» (см. рис.).
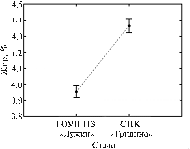 |
Среднее содержание жира в молоке у коров костромской породы из двух обследованных хозяйств (вертикальные линии — 95 % доверительный интервал) (Костромская обл., 2006, 2008 годы). |
Хотя достоверной корреляции между генотипом по исследованным генам и содержанием жира в молоке не обнаружили, сравнение значений вероятности влияния обоих генов на рассматриваемый признак указывает на намечающуюся слабо выраженную тенденцию связи между геном bGH и этим признаком. В то же время другим авторам удалось определить специфику эффекта определенных генотипов на количество жира в молоке у коров различных пород. Так, по данным H. Yardibi с соавт. (18), у восточной анатолийской красной (Eastern Anatolian Red) и южной анатолийской красной (South Anatolian Red) пород LL генотип (в отличие от генотипов VL и VV) четко ассоциирован с более высоким содержанием жира в молоке. Что касается гена bPRL, то у ряда пород крупного рогатого скота (в отличие от исследованной нами) описан характер влияния генотипов, выявляемых RsaI эндонуклеазой рестрикции, на жирность молока. Так, голштино-фризские коровы с генотипом AA продуцируют молоко с большим содержанием жира по сравнению с коровами, имеющими генотип BB (6). Напротив, у российской черно-пестрой и красно-пестрой пород наибольшей долей жира в молоке характеризуются коровы соответственно с BB- и гетерозиготным генотипом (19, 20).
Проведенный нами анализ bPRL(RsaI)- и bGH(AluI)-изменчивости у костромского скота выявил сходство в распределении аллелей гена пролактина в исследованных выборках с таковым у ряда европейских красных пород (8). Например, частота A-аллеля у чешской, польской и немецкой красных пород составляет соответственно 0,559; 0,869 и 0,909. Что касается частоты V-аллеля гена гормона роста у костромских коров, то в ОПХ «Минское» она весьма низкая (0,025), в ГОУП ПЗ «Лужки» — несколько выше (0,080), что соответствует значениям для датской джерсейской породы (0,070) (21). Лишь в СПК «Гридино» этот показатель (0,130) соизмерим с частотой соответствующего аллеля у немецкой красной породы (0,150) (8), но ниже, чем у литовских черно-пестрой и красной пород, у которых V-аллель гена гормона роста встречается с частотой соответственно 0,300 и 0,230 (22). Следует отметить, что необычно высокая частота V-аллеля наблюдается у чешской красной породы (0,510) (8).
Таким образом, у двух из трех исследованных выборок костромского крупного рогатого скота, а именно у выборок из СПК «Гридино» и ОПХ «Минское» частота аллелей и генотипов по обоим использованным ДНК-маркерам генов bPRL и bGH достоверно различается. Степень внутрипородного разнообразия, оцененная по значениям гетерозиготности по гену bGH, низкая, по гену bPRL — средняя по сравнению с таковой у ряда отечественных пород (15, 23). При этом по обоим маркерам изменчивость снижается в последовательности СПК «Гридино», ГОУП ПЗ «Лужки» и ОПХ «Минское». Анализ зависимости процентного содержания жира в молоке у костромских коров от полиморфизма генов bGH и bPRL с учетом принадлежности к стаду и линии (по отцу) выявил достоверное влияние только принадлежности к стаду. В то же время многие отечественные и зарубежные авторы указывают на ассоциацию генотипов по этим генам у некоторых пород с признаками молочной продуктивности и предлагают применять их в практической селекции. Наши данные свидетельствуют, что для внедрения подобного опыта требуется обстоятельное изучение генофонда отечественных пород.
Л и т е р а т у р а
1. B u r t o n J.L., M c B r i d e B.W., B l o c k E. e.a. A review of bovine growth hormone. Can. J. Anim. Sci., 1994, 74: 167-201.
2. O h l s s o n C., B e n g t s s o n B., I s a k s s o n O. e.a. Growth hormone and bone. Endocr. Rev., 1998, 19: 55-79.
3. L e p r o v o s t F., L e r o u x C., M a r t i n P. e.a. Prolactin gene expression in ovine and caprine mammary gland. Neuroendocrinology, 1994, 60: 305-313.
4. C h r e n e k P., H u b a J., O r a v c o v a M. e.a. Genotypes of Bgh and Bprl genes in relationships to milk production. Proc. EAAP 50th Annual Meeting (Book of Abstracts). Zurich, 1999: 40.
5. M i t r a A., S c h l e e P., B a l a k r i s h n a n C.R.e.a. Polymorphisms at growth hormone and prolactin loci in Indian cattle and buffalo. J. Anim. Breed. Genet., 1995, 112: 71-74.
6. C h u n g E.R., R h i m T.J., H a n S.K. Associations between PCR-RFLP markers of growth hormone and prolactin genes and production traits in dairy cattle. Korean J. Anim. Sci., 1996, 38: 321-336.
7. D y b u s A., G r z e s i a k W., S z a t k o w s k a I. e.a. Association between the growth hormone combined genotypes and dairy traits in Polish Black-and-White cows. Anim. Sci. Pap. Rep., 2004, 22(2): 185-194.
8. Z a t o - D o b r o w o l s k a M., C i t e k J., F i l i s t o w i c z A. e.a. Genetic distance between the Polish Red, Czech Red and German Red cattle estimated based on selected loci of protein coding genes and DNA microsatellite sequences. Anim. Sci. Pap. Rep., 2007, 25(1): 45-54.
9. С и д о р е н к о В.А., Б а р а н о в а Н.С. Костромичи и «костромичка»: к 60-летию создания костромской породы крупного рогатого скота (1944-2004). Кострома, 2004.
10. Е м е л ь я н о в Е.Г. Генофонд популяций костромской породы по типам белков молока. Науч. тр. Ленинградского СХИ, 1979, т. 379: 70-74.
11. Я н ч е в а Р.С. Группы крови, типы гемоглобина и трансферина у костромского скота и возможности использованиия в селекции. Автореф. канд. дис. Дубровицы, 1970.
12. Б а р а н о в А.В. Генетическое маркирование и его использование при совершенствовании системы разведения молочного скота. Автореф. докт. дис. М., 1997.
13. Г л у щ е н к о М.А. Использование генетических методов при оценке заводских семейств костромской породы. Автореф. канд. дис. Лесные Поляны (Московская обл.), 1999.
14. С у л и м о в а Г.Е., Л а з е б н а я И.В., Ш т ы ф у р к о Т.А., Р я б и н и н а О.М., У х а н о в С.В., Б а д и н Г.А. Анализ генофонда костромской породы крупного рогатого скота с использованием ДНК-маркеров для генов каппа-казеина, пролактина, гормона роста и BoLA-DRB3. Мат. межвуз. науч.-практ. конф. «Актуальные проблемы науки в АПК». Кострома, 2008, т. 3: 183-185.
15. Л а з е б н а я И.В., Л а з е б н ы й О.Е., С у л и м о в а Г.Е. Исследование генетической изменчивости якутской породы (Bos taurus L.) крупного рогатого скота с использованием генов пролактина bPRL, гормона роста bGH и транскрипционного фактора bPit-1. Генетика, 2010, 46(3): 425-428.
16. Y e h F.C., B o y l e T.J.B. Population genetic analysis of co-dominant and dominant markers and quantitative traits. Belgian J. Bot., 1997, 129: 157.
17. StatSoft, Inc. STATISTICA for Windows (Computer program manual). Tulsa, OK: StatSoft, Inc., 1999. WEB: http://www.statsoft.com.
18. Y a r d i b i H., H o s t u r k G.T., P a y a I. e.a. Associations of growth hormone gene polymorphisms with milk production traits in South Anatolian and East Anatolian Red Cattle. J. Anim. Vet., 2009, 8(5): 1040-1044.
19. A l i p a n a h M., K a l a s h n i k o v a L., R o d i o n o v G. Association of prolactin gene variants with milk production traits in Russian Red Pied cattle. Iranian J. Biotechnol., 2007, 5(3): 158-161.
20. Г о р я ч е в а Т.С., Г о н ч а р е н к о Г.М. Генетические варианты κ-казеина и пролактина в связи с молочной продуктивностью коров черно-пестрой породы. С.-х. биол., 2010, 4: 51-54.
21. S ø r e n s e n P., G r o c h o w s k a R., H o l m L. e.a. Polymorphism in the bovine growth hormone gene affects endocrine release in dairy calves. J. Dairy Sci., 2002, 85: 1887-1893.
22. S k i n k y t è R., Z w i e r z c h o w s k i L., R i a u b a i t è L. e.a. Distribution of allele frequencies important to milk production traits in Lithuanian Black-and-White and Lithuanian Red cattle. Veterinarija ir Zootechnika, 2005, 31(53): 93-97.
23. L a z e b n a y a I.V., L a z e b n y O., K h a t a m i S. e.a. Investigation of bPRL, bPitI, and bGH polimorphisms in four native Russian cattle breeds. Proc. XX International Congress of Genetics «Genetics: understanding living systems». Berlin, German Genetics Society, 2008: 82.
I.V. Lazebnaya1, O.E. Lazebnyi2, M.N. Ruzina1, G.A. Badin3, G.E. Sulimova1
In three herds of cows of the Kostromskaya breed the authors investigated the genetic structure of the somatotropin (bGH-AluI) and prolactin (bPRL-RsaI) genes with the use of PCR-RFLP (restriction fragment length polymorphism) method. The predominance of L allele of bGH gene (0.87-0.98) and A — of bPRL gene (0.67-0.87) was established in all samples. For the bGH and bPRL genes the values of observed heterozygosity (НO) are 0.05-0.07 и 0.26-0.43, respectively. Two of investigated populations differ reliably in both used DNA-markers (P £ 0.05). On the somatotropin bGH gene the VV genotype did not detected. The VL genotype, as opposed to LL genotype, reveals correlation with higher content (%) of the fat in milk.
Keywords: Kostroma cattle breed, PCR-RFLP, bPRL and bGH genes, milk production.
1Учреждение Российской академии наук |
Поступилавредакцию |













