УДК 636/639:614.31
МЕТОДЫ САНИТАРНОГО КОНТРОЛЯ ЖИВОТНОВОДЧЕСКОЙ ПРОДУКЦИИ. СООБЩЕНИЕ I. ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ ТЕТРАЦИКЛИНОВ
А.А. БУРКИН1, Г.П. КОНОНЕНКО1, М.А. БУРКИН2
Конъюгаты тетрациклина с альбуминами и желатином, синтезированные методом формальдегидной конденсации, использовали для получения кроличьих антител и оптимизации условий непрямого твердофазного конкурентного иммуноферментного анализа (ИФА). Антитела обладали групповой специфичностью в отношении тетрациклина, хлортетрациклина, миноциклина, доксициклина, метациклина и окситетрациклина. Чувствительность использованного варианта ИФА при определении тетрациклина в растворах составила 1 нг/мл. Обсуждается возможность применения предложенной тест-системы в токсикологических экспериментах, для контроля за дозами введения антибиотиков в кормовые рационы и определения их остатков в животноводческой продукции.
Ключевые слова: тетрациклины, корма, мясо, молоко, иммуноанализ.
Антибиотики тетрациклинового ряда как эффективные бактериостатики широко применяются в ветеринарной практике. Для определения их остатков в животноводческой продукции предложены разнообразные хроматографические методы (1-3), но в последние годы все чаще появляются сообщения об использовании иммунохимических подходов (4, 5).
Нашей целью было получение специфических иммунореагентов на основе тетрациклина (ТЦ) и разработка тест-системы для непрямого твердофазного конкурентного иммуноферментного анализа (ИФА) тетрациклинов.
Методика. В работе использовали гидрохлориды тетрациклина (Т3258) и хлортетрациклина (С4881) («Sigma», США), гидрохлориды миноциклина, окситетрациклина, доксициклина и метациклина, выделенные из фармацевтических препаратов; формальдегид и органические растворители («Fluka», Германия); бычий сывороточный альбумин (БСА), яичный альбумин (ЯА) и желатин (Жел) отечественного производства. Антивидовой ферментный конъюгат получали из пероксидазы хрена (КФ 1.11.1.7) и антисыворотки осла к иммуноглобулинам кролика по описанной методике (6). ИФА выполняли на высокосвязывающих полистирольных планшетах («Costar», США), оптическую плотность измеряли на фотометре АКИ-Ц-01 (Россия), УФ-спектры записывали на спектрофотометре Hitachi-557 (Япония).
В реакциях по синтезу белковых конъюгатов применяли раствор гидрохлорида ТЦ в диметилформамиде в концентрации 10 мг/мл. Продукты реакции диализовали против трех смен 1000-кратного объема 0,5 % раствора хлористого натрия. К диализатам добавляли равный объем глицерина и хранили при температуре -10 °С…-15 °С.
Для получения БСА-ТЦ(10), БСА-ТЦ(25), БСА-ТЦ(50) и БСА-ТЦ(100) к растворам, содержащим 5 мг БСА (0,07 мкмоль) в 1,5 мл воды, добавляли аликвоты исходного раствора гидрохлорида ТЦ, соответствующие его 10-, 25-, 50- и 100-кратным мольным избыткам по отношению к белку, и 100 мкл 37 % формальдегида (1230 мкмоль). Затем проводили перемешивание (48 ч при 30 °С) и диализ реакционных смесей.
Для получения БСА-ТЦ(30), БСА-ТЦ(90), БСА-ТЦ(150), ЯА-ТЦ(2), ЯА-ТЦ(6), ЯА-ТЦ(20), Жел-ТЦ(4), Жел-ТЦ(12), Жел-ТЦ(40) и Жел-ТЦ(120) к растворам, содержащим 5 мг БСА (0,07 мкмоль), 4 мг ЯА (0,1 мкмоль) или 8 мг Жел (0,05 мкмоль) в 1,5 мл воды, добавляли аликвоты исходного раствора гидрохлорида ТЦ, соответствующие необходимым мольным избыткам вещества по отношению к белкам, и по 300 мкл 37 % формальдегида (3690 мкмоль). Далее выполняли перемешивание (3 ч при 30 °С) и диализ.
Кроликов-самцов серой масти (масса — 2-3 кг) иммунизировали конъюгатом БСА-ТЦ(90). В 1-ю инъекцию животные получали 100 мкг иммуногена в полном адъюванте Фрейнда подкожно в 10-15 точек в области спины, во 2-ю и последующие (все выполнялись с интервалом 1 мес) — по 100 мкг в физиологическом растворе. Через 7 сут после каждой повторной инъекции из ушной краевой вены отбирали кровь, к отделенной сыворотке добавляли равный объем глицерина и хранили при -10 °С…-15 °С.
Тестирование каждой антисыворотки начинали с неконкурентного ИФА для определения рабочего титра антител и выбора концентрации иммобилизованного на твердой фазе антигена (0,05 или 0,15 мкг/мл в 0,05 М карбонат-бикарбонатном буфере, рН 9,5), обеспечивающих интенсивность аналитического сигнала (оптическая плотность) 0,8-1,2 опт. ед. Затем для каждой комбинации антител и антигена осуществляли конкурентный анализ с растворами ТЦ.
При выполнении ИФА ячейки планшета заполняли 0,2 мл растворов иммобилизуемых антигенов в 0,05 М карбонат-бикарбонатном буфере (рН 9,5), инкубировали 16 ч при 4 °С, после чего отмывали 4-5 раз 0,15 М фосфатно-солевым буфером (рН 7,5), состоящим из 0,01 М Na2HPO4, 0,14 М NaCl и 0,05 % Твин 20 (ФСБ-т). Далее вносили по 0,1 мл растворов антител в ФСБ-т с 1 % БСА и 0,1 мл этого же буфера (неконкурентный анализ) либо 0,1 мл рабочих растворов ТЦ в ФСБ-т (конкурентный анализ), инкубировали 1 ч при комнатной температуре, отмывали и добавляли 0,2 мл раствора ферментного конъюгата. Через 1 ч отмывали и вносили в ячейки 0,2 мл субстратного раствора (0,4 мг/мл о-фенилендиамина и 0,005 % Н2О2 в 0,15 М цитрат-фосфатном буфере, рН 5,0), выдерживали 45 мин, добавляли по 50 мкл 4 М серной кислоты, содержащей 0,1 М Na2SO3, и проводили фотометрию при λ= 492 нм. По усредненным значениям оптической плотности в ячейках-дублях рассчитывали степень связывания антител с иммобилизованным антигеном как отношение А/А0 и выражали в процентах.
Для оценки специфичности анализа рабочие растворы ТЦ, хлортетрациклина, миноциклина, окситетрациклина, доксициклина и метациклина в ФСБ-т готовили из исходных растворов в 0,1 н. HCl, концентрации которых уточняли спектрофотометрически по значениям молярных экстинкций (e), приведенным в литературе (7, 8). Перекрестную реактивность антител определяли как отношение концентрации раствора ТЦ, ингибирующей связывание антител с иммобилизованным антигеном на 50 % (ИК50), к такой же концентрации другого антибиотика и выражали в процентах.
С помощью оптимизированного для целей санитарного контроля варианта тест-системы анализировали 8 образцов мышечной ткани и внутренних органов кур-молодок (масса — 1,5 кг), которым в специальном эксперименте зондом в желудок дважды (с суточным интервалом) вводили по 150 мг гидрохлорида ТЦ, растворенного в 12,5 мл воды (контроль — то же количество воды). Кур декапитировали через 5 ч после 2-го введения, отбирали пробы тканей (мышцы, сердце и печень), образцы гомогенизировали и хранили при -18 °С. Перед анализом навески высушивали 3-4 ч при 20-40 °С с помощью термовентилятора. Кроме этого, использовали образцы муки животного происхождения (мясная, рыбная), белково-вита-минно-минеральных добавок (БВМД) и комбикормов, полученные из животноводческих хозяйств, а также пробы молока из торговой сети г. Москвы.
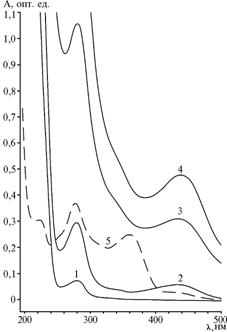
Результаты. Гидрохлорид ТЦ, взятый для конъюгирования с белками в качестве гаптена, в воде имел максимумы поглощения при 275 и 358 нм, в 0,1 н. растворе HCl — при 269 нм (ε = 20 280) и 355 нм (ε = 15 140), что соответствовало данным литературы — ε = 20 054 при 270 нм, ε = 18 000 при 268 нм и ε = 13 300 при 355 нм (8). Коротковолновый максимум поглощения вещества практически совпадал с пиком поглощения, характерным для всех белковых носителей (280 нм), поэтому присутствие гаптена в конъюгатах можно было обнаруживать по поглощению при λ > 340 нм.
В соответствии с типовой процедурой формальдегидной конденсации (реакция Манниха) рекомендуется использовать соотношение 25 мкл 37 % раствора формальдегида на 1 мг БСА и нагревание реакционной смеси при температуре от 37 до 57 °С в течение 3-24 ч (9). Полученные нами продукты реакции с таким избытком формальдегида и нагреванием при 30 °С в течение 48 ч по УФ-спектру не отличались от БСА. При увеличении количества формальдегида (60 мкл на 1 мг БСА) через 3 ч при той же температуре удалось получить конъюгаты с явными спектральными отличиями от белкового носителя. Однако у этих продуктов пик поглощения отмечали при 435 нм (у ТЦ при 358 нм) (рис. 1). Батохромное смещение на 77 нм указывало на глубокие изменения в хромофорной системе молекулы ТЦ, которые могли произойти в результате связывания с белками. Интенсивность УФ-поглощения закономерно возрастала с увеличением избытка гаптена в реакции и при нагрузках 90 и 150 моль/моль БСА достигала соответственно 0,32 и 0,49 опт. ед. В спектрах конъюгатов ТЦ с Жел присутствовал тот же отчетливый максимум поглощения при 435 нм. Это несоответствие в спектрах белковых конъюгатов ТЦ не позволило в дальнейшем использовать спектрофотометрический метод для расчетов эпитопной плотности.
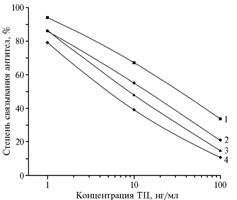
Ранее с помощью радиометрии было показано, что при 120-кратном мольном избытке ТЦ в реакции формальдегидной конденсации достигается высокая степень нагрузки гаптеном — до 30-40 молей на 1 моль БСА (10), в связи с чем для иммунизации мы выбрали конъюгат БСА-ТЦ(90). Уже после его 2-го введения животным (то есть при 1-м отборе крови) удалось получить специфичные антитела с рабочим титром 1:25 000, которые позволяли выявлять ТЦ в растворах при концентрации 10 нг/мл с использованием гомологичного по белковому носителю твердофазного антигена БСА-ТЦ(30). Продолжение процедуры иммунизации (вплоть до 4-го получения сыворотки крови) сопровождалось увеличением чувствительности анализа на порядок при сохранении высокого рабочего титра антител (рис. 2). Далее (до 8-го получения антисыворотки) перечисленные показатели практически не изменялись. Таким образом, несмотря на глубокую перестройку хромофорной системы молекулы гаптена в составе иммуногена, антитела к нему оказались способными достаточно эффективно связываться с ТЦ.
При иммобилизации на твердой фазе все четыре продукта конъюгирования БСА и ТЦ, полученные с малым количеством формальдегида, дали отрицательные результаты в конкурентном ИФА. Из 9 конъюгатов, гетерологичных иммуногену по типу носителя и/или гаптенной нагрузке, два — Жел-ТЦ(40) и Жел-ТЦ(120) в наибольшей степени обеспечивали линейный шаг аналитического сигнала (степень связывания антител, %) в интервале 10-90 % для концентраций ТЦ от 1 до 100 нг/мл (табл. 1). Остальные несколько уступали им, сохраняя при этом иммунореактивность (см. табл. 1).
| 1. Степень связывания (%) антисыворотки к БСА-ТЦ(90) с различными иммобилизованными антигенами в присутствии ТЦ | ||||
Иммобилизованный |
ТЦ, нг/мл |
|||
100 |
10 |
1 |
0,1 |
|
БСА-ТЦ(30) |
12 |
27 |
74 |
92 |
БСА-ТЦ(90) |
27 |
53 |
84 |
97 |
БСА-ТЦ(150) |
49 |
67 |
93 |
99 |
Жел-ТЦ(4) |
31 |
50 |
91 |
94 |
Жел-ТЦ(12) |
23 |
56 |
93 |
94 |
Жел-ТЦ(40) |
13 |
38 |
81 |
94 |
Жел-ТЦ(120) |
15 |
23 |
70 |
89 |
ЯА-ТЦ(2) |
12 |
35 |
92 |
98 |
ЯА-ТЦ(6) |
24 |
50 |
82 |
94 |
ЯА-ТЦ(20) |
21 |
49 |
84 |
92 |
П р и м е ч а н и е. БСА, Жел, ТЦ, ЯА — соответственно бычий сывороточный альбумин, желатин, тетрациклин, яичный альбумин. Кроличья антисыворотка получена после 9-й иммунизации (8-й отбор крови). |
||||
При конкурентном анализе с иммобилизованным Жел-ТЦ(40) обнаружилось сходное узнавание этими антителами тетрациклина и хлортетрациклина, миноциклина и доксициклина, метациклина и окситетрациклина с постепенным снижением значений перекрестной реактивности от 100 до 20 % (табл. 2).
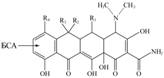
Использованные вещества тетрациклинового ряда (см. табл. 2) различаются заместителями R1-4:
 ,
,
которые расположены в трех конденсированных кольцах молекулы и способны повлиять на специфичность анализа. По-видимому, узнавание в основном определяется природой заместителя R1, удаленного от места связывания с белком, поскольку ТЦ и окситетрациклин показали крайние
| 2. Перекрестная реактивность антител к БСА-ТЦ(90) в отношении веществ тетрациклинового ряда с разными заместителями | ||||||
Вещество |
Заместитель |
ИК50, нг/мл |
Реактивность, % |
|||
R1 |
R2 |
R3 |
R4 |
|||
Тетрациклин |
H |
OH |
CH3 |
H |
6,8 |
100 |
Хлортетрациклин |
H |
OH |
CH3 |
Cl |
8,3 |
81 |
Миноциклин |
H |
H |
H |
N(CH3)2 |
14,1 |
48 |
Доксициклин |
OH |
H |
CH3 |
H |
16,6 |
41 |
Метациклин |
OH |
=CH2 |
=CH2 |
H |
28,2 |
24 |
Окситетрациклин |
OH |
OH |
CH3 |
H |
33,9 |
20 |
П р и м е ч а н и е. ИК50 — концентрация, приводящая к 50 % ингибированию связывания антител с твердофазным антигеном. |
||||||
значения перекрестной реактивности. Вклад заместителя R2 несколько меньше, так как отсутствие гидроксильной группы в молекуле миноциклина снижало взаимодействие с ним почти вдвое. Характер заместителя R4 (атомы Н и Cl) у ТЦ и хлортетрациклина практически не влиял на узнавание, возможно, из-за его близости к месту соединения гаптена с белком. Отношение наибольшего и наименьшего значений ИК50 в этом ряду составило 4,7, что вполне удовлетворяет предложенному недавно критерию групповой специфичности (11).
В отношении антимикробных веществ с другим химическим строе-
|
Рис. 1. Спектры УФ-поглощения бычьего сывороточного альбумина (БСА) (1), его конъюгатов БСА-ТЦ(30) (2), БСА-ТЦ(90) (3), БСА-ТЦ(150) (4) и тетрациклина (ТЦ) (5). |
нием — левомицетина, стрептомицина, пенициллина, бацитрацина, гентамицина и фторхинолонов в концентрациях до 100 мкг/мл торможение связывания антител с твердой фазой не наблюдали. Это указывает на принципиальную возможность применения тест-системы для избирательной индикации тетрациклинов в тканях, органах и биологических жидкостях животных.
Для практического использования иммуноферментных тест-систем необходимо адаптировать их к обследуемым объектам, подбирая оптимальный способ извлечения анализируемого вещества. В сочетании с ИФА часто используется экстракция низкомолекулярных соединений ацетонитрилом и водно-аце-тонитрильными смесями, но при этом всегда следует учитывать тот факт, что присутствие органического растворителя может влиять на аналитические показатели тест-сис-темы, главным образом на характер зависимости регистрируемого сигнала от концентрации вещества, а также на чувствительность определения.
|
Рис. 2. Степень связывания антител к БСА-ТЦ(90), полученных при 1-4-м отборах крови (1-4), с твердофазным антигеном Жел-ТЦ(40) в присутствии тетрациклина. БСА, Жел, ТЦ — соответственно бычий сывороточный альбумин, желатин, тетрациклин. |
Принцип абсолютной кали-бровки, положенный в основу ИФА, требует строгого соблюдения идентичности условий проведения реакций для всех вариантов, включая калибровочные растворы. В целях стандартизации приготовления растворов ТЦ для выполнения анализа мы определили величину молярной экстинкции для максимума поглощения раствора вещества в ацетонитриле при 365 нм. По результатам измерения оптической плотности пяти растворов ТЦ с концентрацией 20 мкг/мл, приготовленных из отдельно взятых навесок, значение e составило 12 900±400. Эталонные растворы далее готовили разбавлением этого раствора смесью ацетонитрила и воды (84:16, объем:объем) до концентрации 1 мкг/мл.
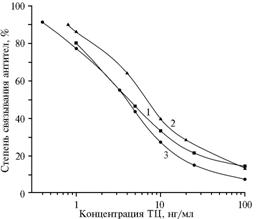
Аналитические характеристики разработанной тест-системы слабо зависели от присутствия ацетонитрила: калибровочные графики, полученные в растворах, содержащих ацетонитрил, и в буферном растворе, практически не различались и обеспечивали диапазон измерения ТЦ от 1 до 100 нг/мл (рис. 3). В промежуточных условиях прецизионности с изменяющимися факторами (оборудование, оператор, время — ежедневно или с интервалом 1-2 сут) относительное стандартное отклонение показателей степени связывания антител (n= 10) для калибровочных растворов не превышало 0,05. Это указывает на стабильное функционирование тест-системы в лабораторных условиях при обычных колебаниях внешних факторов.
|
Рис. 3. Калибровочные графики ИФА ТЦ с антисывороткой к БСА-ТЦ(90) от 8-го отбора крови и твердофазным антигеном Жел-ТЦ(40) (n = 10) в буфере ФСБ-т (1), смеси ацетонитрила с водой при 10-кратном разбавлении ФСБ-т (2), а также в молоке при 3-кратном разбавлении ФСБ-т (3). БСА, Жел, ТЦ — соответственно бычий сывороточный альбумин, желатин, тетрациклин. |
Экстракты тканей птицы из контрольной группы, полученные при соотношении объема экстрагента и сырой массы навески 1:1, не вызывали фоновых эффектов после 10-кратного разведения буферным раствором. В опыте показатели загрязненности антибиотиком мы-шечных тканей, печени и сердца составили соответственно 645±15, 1250 и 1260 мкг/кг. Это значит, что через 5 ч после 2-кратного введения ТЦ (общая доза 200 мг/кг живой массы) его остаточное количество в мышцах и внутренних органах равнялось примерно 1 мг/кг, то есть 0,5 % от введенного. Согласно действующим нормам, остатки антибиотиков тетрациклиновой группы в мясной продукции не должны превышать 10 мкг/кг (12). В этой связи понятно, почему их применение в лечебных и профилактических целях рекомендовано прекращать за 3 сут до убоя птицы (13, 14).
Экстракты кормов получали при 5-кратном объеме экстрагента по сравнению с массой навески. В этом варианте диапазон измерения составил от 0,05 до 5 мг/кг. Большинство исследованных экстрактов оказались «нулевыми»: степень связывания антител была равна или превышала 90 %, что указывало на отсутствие значимого влияния на результаты измерения со стороны сопутствующих экстрактивных веществ (табл. 3).
| 3. Содержание антибиотиков группы тетрациклина в кормовом сырье и комбикормах по результатам ИФА | ||||
Объект анализа |
Число образцов, шт. |
Содержание (в эквивалентах ТЦ), мг/кг |
||
всего |
со степенью связывания |
|||
> 90 % |
< 90 % |
|||
Мясная мука |
4 |
4 |
0 |
Не обнаружено |
Рыбная мука |
4 |
4 |
0 |
Не обнаружено |
БВМД |
10 |
9 |
1 |
0,1 |
Комбикорма |
48 |
31 (от 90 до 106 %) |
17 |
0,05-0,3 (среднее 0,1) |
П р и м е ч а н и е. БВМД — белково-витаминно-минеральные добавки. |
||||
Отрицательные результаты для муки животного происхождения можно объяснить тем, что антибиотики обычно вводят в смешанные корма. Из 10 проб БВМД только для одной удалось подтвердить их присутствие, равное в эквивалентах ТЦ 0,1 мг/кг. Из 48 проб комбикормов положительными были 17, при этом содержание антибиотиков в среднем по выборке составило 0,1 мг/кг. В начале 1950-х годов в СССР было обычным применение хлортетрациклина и окситетрациклина в суббактериостатических концентрациях (в 100-1000 раз ниже лечебных, которые равнялись 5-150 мг/кг) в связи с их положительным влиянием на рост и продуктивность (13, 14). Низкое содержание тетрациклинов (0,05-0,30 мг/кг), выявленное нами в значительной части проб комбикормов, очевидно, свидетельствует о сохранении подобной практики.
Анализ сырого, пастеризованного и стерилизованного коровьего молока показал, что его разбавление ФСБ-т в 3 раза позволяет определять тетрациклины в исходном продукте вплоть до концентрации 3 нг/мл (см. рис. 3), то есть обеспечить чувствительность 3 мкг/кг. Такой способ проверки загрязненности молока антибиотиками удобен для применения в производственных условиях.
Итак, разработанная иммуноферментная тест-система перспективна для использования не только в токсикологических экспериментах по изучению трансмиссии антибиотиков тетрациклиновой группы в ткани и биологические жидкости животных, но и для целей контроля безопасности кормов и животноводческой продукции.
Л И Т Е Р А Т У Р А
1. K e n n e d y D.G., M c C r a c k e n R.J., C a n n a v a n A., H e w i t t S.A. Use of liquid chromatography-mass spectrometry in the analysis of residues of antibiotics in meat and milk. Journa of Chromatography A, 1998, 812: 77-98.
2. K a w a t a S., S a t o K., N i s h i k a w a Y., I w a m a K. Liquid chromatographic determination of oxytetracycline in swine tissues. J. of AOAC International, 1996, 79(6): 1463-1465.
3. A s h w o r t h R.B. Liquid chromatographic assay of tetracyclines in tissues of food-producing animals. J. of the AOAC, 1985, 68(5): 1013-1018.
4. Z h a n g Y., L u S., L i u W., Z h a o C., X i R. Preparation of anti-tetracycline antibodies and development of an indirect heterologous competitive enzyme-linked immunosorbent assay to detect residues of tetracycline in milk. J. Agric. Food Chem., 2007, 55(2): 211-218.
5. M o o n s u n J e o n a, J i s u n K i m a, K i - J u n g P a e n g h, S u n g - W o o P a r-
k e, I n s o o k R h e e P a e n g a. Biotin-avidin mediated competitive enzyme-linked immunosorbent assay to detect residues of tetracyclines in milk. Microchemical J., 2008, 88(1): 26-31.
6. N a k a n e P.K., K a w a o i A. Peroxidase-labeled antibody. A new method of conjugation. J. Histochem. Cytochem., 1974, 22(2): 1084-1091.
7. C l a r k E.G.C. Isolation and identification of drugs. London, 1986.
8. К о ж ы б с к и Т., К о в ш ы к - Г и н д и ф е р З., К у р ы л о в и ч В. Антибиотики. Происхождение, природа и свойства. Т. 1. Варшава, 1969.
9. H e r m a n s o n G.T. Bioconjugate techniques. San Diego-New York-Boston-London-Sydney-Tokyo-Toronto, Academic Press, 1996: 785.
10. F a r a j B.A., A l i F.M. Development and application of a radioimmunoassay for tetracycline. J. Pharmacol. Exp. Ther., 1981, 217(1): 10-14.
11. B u r k i n M.A., G a l v i d i s I.A. Improved group determination of tetracycline antibiotics in competitive enzyme-linked immunosorbent assay. Food and Agricult. Immunol., 2009, 20(3): 245-252.
13. Гигиенические требования безопасности и пищевой ценности пищевых продуктов. Санитарно-эпидемиологические правила и нормативы. СанПиН 2.3.2.1078-01. М., 2002.
14. Л е о н о в Н.И., С к р я б и н Г.Н., С о л н ц е в К.М. Антибиотики в животноводстве. М., 1962.
15. Методические указания по применению антибиотиков в ветеринарии. М., 1974.
METHODS OF SANITARY CONTROL OF LIVESTOCK PRODUCTS. I. ENZYMOIMMUNOASSAY (ELISA) OF TETRACYCLINES
A.A. Burkin1, G.P. Kononenko1, M.A. Burkin2
The conjugates of tetracycline with albumins and gelatin, synthesized by the method of formaldehyde condensation, were used for isolation of the rabbit antibodies and optimization of the conditions of indirect solid-phase competitive enzymoimmunoassay (ELISA). The antibodies had group specificity to tetracycline, chlortetracycline, minocycline, doxycycline, metacycline and oxytetracycline. The sensitivity of used variant of ELISA during detection of tetracycline in solution was of 1ng/ml. The authors discuss the application of proposed test-system in toxicological experiments for the control of the antibiotic doses supplemented to feed rations and the determination of residual quantity in animal produce.
Key words: tetracyclines, feeds, milk, meat, immunoassay.
1ГНУ Всероссийский НИИ ветеринарной |
Поступила в редакцию |