doi: 10.15389/agrobiology.2020.3.499rus
УДК 635.21:575.174.015.3
Работа выполнена при поддержке РФФИ (грант 18-29-07007) и ФНТП развития сельского хозяйства РФ на 2017-2025 гг. (подпрограмма «Развитие селекции и семеноводства картофеля в Российской Федерации»). Растения выращивали с использованием экспериментальной установки искусственного климата ЭУИК (Институт биоинженерии ФИЦ Биотехнологии РАН).
ВАРИАБЕЛЬНОСТЬ ГЕНОМА ОТЕЧЕСТВЕННЫХ СОРТОВ КАРТОФЕЛЯ: ДАННЫЕ AFLP-АНАЛИЗА
Е.А. ДЬЯЧЕНКО, А.В. КУЛАКОВА, А.В. ЩЕННИКОВА, Е.З. КОЧИЕВА
Успех селекционных программ во многом зависит от знания генетического разнообразия и родословных сортов растений, что важно для определения родительских пар для скрещивания, генотипов ― доноров ценных признаков, внутрисортовой гомогенности. AFLP (amplified fragment length polymorphism) ― один из популярных методов детекции геномного полиморфизма и генотипирования образцов, сортов и линий растений. Помимо решения таксономических и филогенетических проблем, метод AFLP широко используется для определения вариабельности, гомогенности и степени интрогрессии и гибридности сортов Solanum tuberosum, реконструкции их родословных, а также для поиска маркеров, сцепленных с различными признаками. Несмотря на важность сортовой паспортизации и оценки межсортовой геномной вариабельности, в Российской Федерации научно-исследовательских работ по молекулярному маркированию генотипов сортов картофеля отечественной и зарубежной селекции, возделываемых на территории России, известно немного. В представленном исследовании с использованием мультилокусного AFLP-маркирования проведен анализ вариабельности ядерного генома у 60 сортов и пяти перспективных селекционных клонов картофеля. С помощью праймерных комбинаций Е35/М40 и Е41/М35 было детектировано 218 AFLP-фрагментов, 189 (86,7 %) из которых оказались полиморфными и 19 ― уникальными для некоторых сортов. Каждый из 65 анализируемых образцов картофеля был охарактеризован специфичным AFLP-спектром. Значения генетических расстояний между анализируемыми сортами варьировали в широких пределах ― от 0,37 до 0,77 при среднем значении GD = 0,61. Вид Solanumstoloniferum, используемый в качестве образца внешней группы, имел наибольшее сходство с cортом Фиолетовый (GD = 0,59), а наибольшее различие ― с сортом Аврора (GD = 0,80). Был проведен статистический анализ результатов AFLP-маркирования и показано отсутствие статистически достоверной кластеризации. На дендрограммах, построенных с помощью программ PAST и Structure v. 2.3.4, наблюдалась тенденция кластеризации (с низкой бутстрэп-поддержкой) сортов селекции Всероссийского НИИ картофельного хозяйства им. А.Г. Лорха, сортов с устойчивостью к фитофторозу, нематоде или Y вирусу картофеля (PVY), а также сортов с желтой окраской кожуры клубней. Высокая степень общего полиморфизма анализируемой выборки сортов, отсутствие четкой кластеризации и «нестабильное» положение образцов могут быть связаны с тем, что в настоящее время идет интенсивный обмен селекционным материалом, а также с возрастающей популярностью использования генофонда дикорастущего картофеля в селекции.
Ключевые слова: Solanum tuberosum, картофель, российские сорта, иностранные сорта, геномный полиморфизм, окраска кожуры, окраска мякоти клубня, устойчивость, фитофтороз, золотистая цистообразующая нематода, PVY, AFLP-кластеризация.
Успех любой селекционной программы во многом зависит от знания генетического разнообразия и родословных сортов растений, что важно для определения родительских пар для скрещивания, генотипов-доноров ценных признаков и внутрисортовой гомогенности. Современные методы молекулярного анализа позволяют дать характеристику генотипа, а также определить степень разнообразия внутри сорта и между сортами разного географического и селекционного происхождения (1).
В настоящее время все более актуальным становится ДНК-генотипирование растений посредством оценки полиморфизма как всего генома, так и его функциональных участков (семейства генов, отдельные локусы и гены). ДНК маркеры, разработанные на основе получаемых с помощью методов молекулярного анализа данных о полиморфных последовательностях ДНК, используются для выявления ценных генотипов, конкретных генов и хромосомных локусов растений, а также для паспортизации сортов и линий. ДНК маркеры не подвержены влиянию окружающей среды и могут быть идентифицированы на любой стадии развития (2, 3), поэтому их использование позволяет преодолеть недостатки белковых маркеров в решении ряда селекционных вопросов, в том числе сертификации сортов.
AFLP (amplified fragment length polymorphism) ― один из популярных методов детекции геномного полиморфизма и генотипирования образцов, сортов и линий растений (4). AFLP-анализ позволяет оценить вариабельность геномов, не определяя последовательности конкретных локусов, а также исследовать обширную, преимущественно селективно нейтральную, часть генома, представленную уникальными и умеренно повторяющимися последовательностями (4). Показана высокая результативность AFLP маркеров при определении генетических расстояний и филогенетических связей на различных таксономических уровнях (5). Об эффективности метода говорит частота его использования. AFLP активно и успешно применяется для оценки межсортовой вариабельности у многих сельскохозяйственных культур, в том числе пшеницы (6), ячменя (7), гороха (8, 9), перца (10, 11).
В исследованиях картофеля этот метод также довольно популярен. С его помощью проведена оценка генетического разнообразия картофеля в существующих мировых коллекциях, например у дикорастущих видов Solanum microdontum (GenBank USDA, США) (12), S. acaule и S. demissum (CGN genebank, Нидерланды) (13). С использованием AFLP была осуществлена ревизия 619 образцов 13 видов дикорастущего картофеля из генбанков CPC (Великобритания) и NRSP6 ― The US Potato Genebank (США) (14). Метод помог определить уровни полиморфизма репрезентативных образцов дикорастущих и культивируемых видов картофеля с различиями в географическом происхождении, плоидности и системе размножения (14). С помощью AFLP-метода решался ряд таксономических вопросов у рода Solanum: было пересмотрено объединение видов картофеля в серии, ранее предложенное J.G. Hawkes (15), показана эффективность применения AFLP для изучения филогении рода Solanum и сортов картофеля (16) и подтверждены различия между таксонами S. americanum и S. nodiflorum (17).
Помимо решения таксономических и филогенетических задач, метод AFLP широко используется для определения вариабельности, гомогенности и степени интрогрессии и гибридности сортов S. tuberosum, реконструкции их родословных, а также для поиска маркеров, сцепленных с различными признаками. Так, было проведено AFLP-генотипирование 20 местных чилийских сортов (18). Анализ 32 культивируемых в странах Скандинавии сортов картофеля из генбанка NGB (Nordic Gene Bank, Швеция) показал, что коллекция состоит из генетически и морфологически различных клонов, без какой-либо группировки по географии происхождения (19). AFLP-анализ 54 сортов картофеля из генбанка SASA (Великобритания) позволил выявить группу из 7 сортов, которые были рекомендованы для использования в селекционных программах на юге Италии (20).
Несмотря на важность сортовой паспортизации и оценки межсортовой геномной вариабельности, для сортов картофеля отечественной и зарубежной селекции, возделываемых на территории России, публикаций, посвященных анализу и созданию систем молекулярного маркирования генотипов (21-24) или определению аллельных вариантов генов устойчивости к патогенам (25-28), известно немного.
В настоящем исследовании был проведен AFLP-анализ вариабельности ядерного генома у 60 сортов и пяти перспективных селекционных клонов картофеля.
Цель работы состояла в оценке геномной вариабельности сортов картофеля отечественной и зарубежной селекции методом AFLP, а также эффективности AFLP-анализа при генотипирования сортов, возделываемых на территории России.
Методика. Для анализа отобрали 60 сортов и пять перспективных селекционных клонов картофеля S. tuberosum отечественной и зарубежной селекции (предоставлены Всероссийским НИИ картофельного хозяйства им. А.Г. Лорха — ВНИИКХ, Московская обл., Россия), а также родственный вид S. stoloniferum в качестве образца внешней группы. Из 60 сортов выборки 59 (или 90,77 %) включены в Государственный реестр селекционных достижений, допущенных к использованию (Госсортреестр) (М., 2020; http://reestr.gossortrf.ru/reestr/culture/159.html). Клубни проращивали в стандартных условиях теплицы (день/ночь ― 23 °С/25 °С, 16 ч/8 ч). Геномную ДНК выделяли из свежесобранных 5-6-суточных проростков СТАВ-методом (21, 29).
AFLP-анализ выполняли по стандартной методике, проводя гидролиз 350 нг геномной ДНК каждого образца рестриктазами EcoRI и MseI с последующим лигированием с EcoRI-и MseI-адаптерами (4). Селективную амплификацию проводили в два этапа: первый ― пре-амплификация (денатурация при 94 °С 30 с, отжиг праймеров при 56 °С 30 с, синтез при 72 °С 1 мин; 24 цикла) с адаптерными праймерами EcoRI+1иMseI+1 (4) с одним селективным нуклеотидом (А) на 3´-конце; второй — амплификация с праймерами EcoRI+3 и MseI+3 с тремя селективными нуклеотидами на 3´-конце. Результаты визуализировали в денатурирующем 6 % полиакриламидном геле с использованием гель-анализатора LI-COR 4300 (LI-COR operator manual, «LI-COR», США).
Для статистическая обработка результатов AFLP-маркирования молекулярные панели AFLP-фрагментов документировали в виде бинарных матриц (программа Excel). На основании построенных спектров и матриц идентифицировали сортоспецифичные ДНК-маркеры, рассчитывали коэффициенты попарного генетического сходства между образцами (GS) и значения генетических расстояний (GD = 1 - GS), проводили кластерный анализ (метод ближайшего соседа Neighbor Joining; метод главных координат) и определяли группы генетически сходных образцов (пакет программ PAST) (30). Геномную структуру исследуемых образцов анализировали с помощью программы Structure v. 2.3.4 (https://web.stanford.edu/group/pritchardlab/ho-me.html), которая позволяет выявлять общие генетические блоки и их соотношение в каждом образце (31, 32).
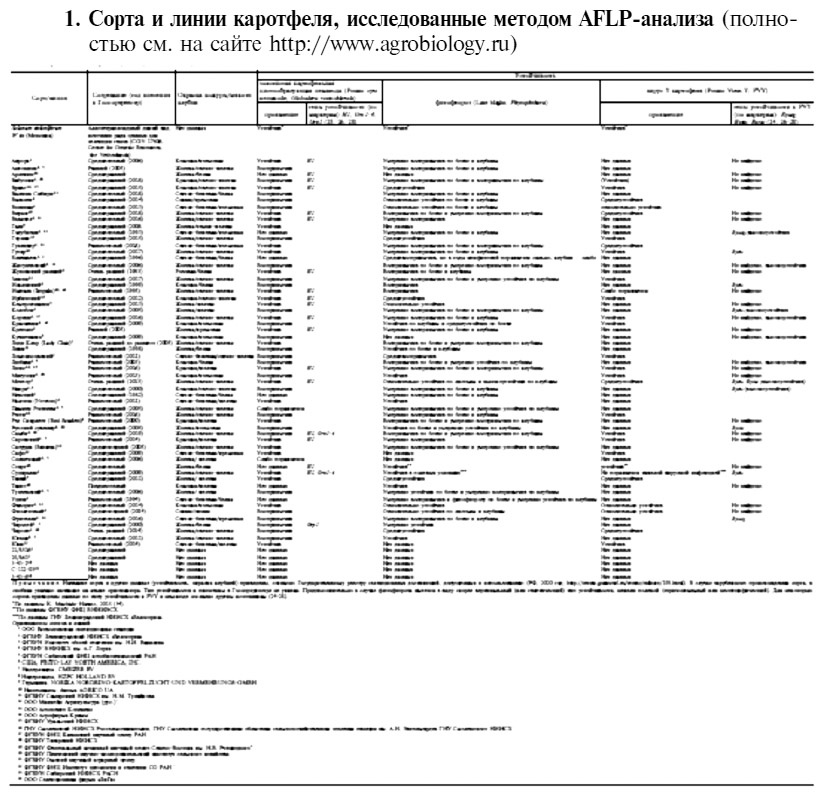
Результаты. Описание отобранных для AFLP-анализа образцов (оригинаторы, сроки созревания, год внесения в Госсортреестр, окраска кожуры и мякоти клубня, устойчивость к золотистой картофельной цистообразующей нематоде, фитофторозу, вирус Y картофеля (PVY), гены устойчивости) приведено в таблице 1 (полностью см. на http://www.agrobiology.ru).
Подбор и тестирование комбинаций праймер/фермент для проведения мультилокусного AFLP анализа генома сортовS. tuberosum. Для гидролиза ДНК исследуемых образцов картофеля использовали эндонуклеазы рестрикции EcoRI и MseI, поскольку ранее было показано, что именно эти ферменты обеспечивают наибольшую эффективность анализа AFLP (10, 13, 18). На втором этапе амплификации на выборке из пяти сортов (из различных селекционных центров) тестировали семь комбинаций праймеровEcoRI+3/MseI+3, различающихся составом селективных нуклеотидов на 3´-конце: E35/M40 (E-ACA/M-AGC); E41/M35 (E-AGG/M-ACA); E41/M48 (E-AGG/M-СAC); E41/M45 (E-AGG/M-ATG); E12/M50 (E-AC/M-CAT); E32/T55 (E-AAC/M-CGA); E32/T61 (E-AAC/M-CTA). В результате только первые две комбинации Е35/М40 и Е41/М35 позволили получить полиморфный, четко дифференцированный спектр с оптимальным числом фрагментов и были в дальнейшем использованы для AFLP-маркирования 60 сортов и пяти селекционных клонов S. tuberosum.
AFLP-маркирование сортов и селекционных клонов картофеля. AFLP-анализ 60 сортов и пяти селекционных клонов S. tuberosumи родственного дикорастущего вида S. stoloniferum, взятого в качестве внешней группы, детектировал 218 фрагментов (размером 80-450 п.н.), 189 (86,7 %) из которых оказались полиморфными (табл. 2). Комбинация праймеров Е41/М35 была наиболее эффективна — вариабельными оказались 122 из 139 полученных фрагментов (см. табл. 2). Для некоторых сортов обнаружили уникальные фрагменты (всего 19).
Комбинации Е35/М40 и Е41/М35 позволили выявить полиморфизм сортов с большей эффективностью, чем в ряде других исследований. К примеру, результатом AFLP-анализа 32 сортов картофеля из генбанка NGB с пятью комбинациями EcoRI+3/MseI+3 стало обнаружение 21-26 фрагмен-тов, из которых только 4-18 были полиморфны (19). Маркирование 22 сортов картофеля (Чили) с пятью комбинациями EcoRI+3/MseI+3 показало присутствие лишь 26-71 полиморфный фрагмент из 34-77 описанных (18). AFLP-генотипирование 25 сортов картофеля, культивируемых в Иране, с 16 праймерными комбинациями PstI+3/MseI+3 идентифицировало всего 16-52 полиморфных фрагмента из 19-53 (33). Ранее сообщалось, что до 80 % стандартного AFLP-спектра могут служить маркерами для выявления генетических полиморфизмов в сайтах рестрикции или внутри вырезанного фрагмента и, как следствие, для определения структуры популяций и реконструкции филогении видов (4). При этом тщательный подбор праймерных комбинаций способен существенно повысить долю обнаруживаемого полиморфизма. Так, в ряде работ (18, 33) процент полиморфных фрагментов при AFLP-анализе образцов картофеля почти везде так же высок, как в нашем исследовании (75-100 %) (см. табл. 2), тогда как в других исследованиях он варьирует от 17,4 до 78,3 % (19).
Таким образом, очевидно, что выявленный с помощью праймерных комбинаций Е35/М40 и Е41/М35 полиморфизм настолько высок, что даже одной из комбинаций было бы достаточно для генотипирования анализируемых образцов картофеля. В результате проведенного молекулярного AFLP-маркирования с использованием праймеров Е35/М40 и Е41/М35 каждый из 60 анализируемых сортов и пяти селекционных клонов картофеля был охарактеризован специфичным спектром AFLP фрагментов.
Статистический анализ данных AFLP. Обработка полученных результатов показала, что значения генетических расстояний между анализируемыми сортами варьируют в широких пределах — от 0,37 (между сортами Танай и Югана) до 0,77 (между сортами Аврора и Накра) при среднем значении 0,61. Вид S. stoloniferum, используемый в качестве внешнего образца, наибольшее сходство имел с сортом Фиолетовый (GD = 0,59), наибольшее различие — с сортом Аврора (GD = 0,80).
По результатам AFLP-анализа в программе PAST была построена дендрограмма, где с низкой бутстрэп-поддержкой обособилась группа 1, включающая 14 сортов, из которых половина — селекции ВНИИКХ, четыре (Леди Клэр, Ред Скарлетт, Импала и Сатурна) — голландской селекции и три сорта (Аврора, Елизавета и Чародей) получены другими селекционными центрами (рис. 1, см. табл. 1). Группа 2 состояла из трех сортов зарубежной (Гала) и отечественной (Жигулевский и Сафо) селекции (см. рис. 1). Сорта ВНИИКХ (Метеор, Голубизна, Памяти Рогачева, Накра и Великан), Уральского НИИСХ (Горняк), Татарского НИИСХ (Регги) и выведенные в США (Ньютон) образовали третий неявный кластер (группа 3). Он был наиболее близок к внешней группе, в которую вместе с S. stoloniferumвошел сорт Фиолетовый (см. рис. 1). Все остальные анализируемые сорта составили единый высокополиморфный кластер без достоверного разделения на субкластеры (см. рис. 1). Интересно, что сорт Фиолетовый имел высокое сходство (GD = 0,54-0,59) с девятью сортами (Фрителла, Красавчик, Люкс, Ирбитский, Лина, Кортни, Вираж, Танай и Саровский), подобное отмеченному с S. stoloniferum, однако сгруппировался именно с этим дикорастущим видом.
При проверке возможность кластеризации анализируемых сортов по отдельным характеристикам, стране происхождения или оригинатору (см. табл. 1) мы не выявили статистически достоверных групп. Однако следует отметить, что выборка состояла в основном из отечественных сортов, и для оценки кластеризации образцов по стране происхождения зарубежных сортов было недостаточно. Внешняя группа (сорт Фиолетовый и S. stoloniferum) оказалось устойчива к фитофторозу и PVY. Сорта Великан, Горняк и Ньютон из группы 3, наиболее близкие к внешней группе, также устойчивы к фитофторозу, а подгруппа, объединяющая сорта Великан и Горняк, — к PVY. Группа 2 целиком неустойчива к фитофторозу. В большом кластере подгруппа, объединяющая сорта Танай, Югана и Лина, устойчива к фитофторозу, а три других подгруппы (первая — сорта Фаворит и Браво, вторая — Колобок, Ирбитский, Старт и Кортни, третья — Ломоносовский и Чароит) устойчива к PVY. Некоторая кластеризация отмечается для сортов, устойчивых к нематоде Globodera rostochiensis. Для остальных подгрупп большого кластера и группы 1 мы не нашли общих признаков из тех, которые анализировали.
Такой высокий межсортовой полиморфизм и отсутствие статистически достоверной кластеризации, возможно, связаны с тем, что в последние десятилетия набирает популярность использование дикорастущего генофонда картофеля. Перспективные селекционные клоны и современные сорта (регистрация в Госсортреестре с 2000 года) — это 57 образцов (большая часть взятой в анализ выборки), представляющие собой сложные межвидовые гибриды, в которых дикорастущие виды картофеля часто выступают в качестве доноров хозяйственно ценных признаков (устойчивость к патогенам, абиотическим факторам и др.) (34). Об этом же свидетельствуют недавние исследования сортов картофеля российской селекции и стран ближнего зарубежья, показавшие связь между постоянным ростом числа сортов с редкими и уникальными аллелями SSR локусов, с одной стороны, и использованием межвидовой гибридизации — с другой (22).
На полученной нами дендрограмме наблюдается некоторая тенденция кластеризации сортов, в число оригинаторов которых входит ВНИИКХ (см. рис. 1). Ранее в результате SSR-анализа 41 сорта отечественной и зарубежной селекции и 26 селекционных образцов картофеля была выявлена совместная кластеризация сортов с родственным происхождением (23). Тем не менее, согласно результатам AFLP-анализа, сорта Удача и Любава, имеющие общее происхождение (22), относятся к разным кластерам (см. рис. 1). В представляемой работе, кроме сортов, мы проанализировали пять линий от трех оригинаторов (см. табл. 1). При этом все линии кластеризовались с сортами не своих оригинаторов (см. рис. 1), что указывает на интенсивный обмен селекционным материалом между центрами, осуществляющими такие исследования.
Ранее SSR-анализ сортов картофеля продемонстрировал возможность их кластеризации по окраске клубней (23), однако в настоящей работе такую кластеризацию (с низкой бутстрэп-поддержкой) отмечали лишь относительно сортов, формирующих клубень с желтой окраской кожуры или мякоти клубня (см. рис. 1, табл. 1). При этом сорта Фиолетовый и Василек с сине-фиолетовой кожурой (у сорта Фиолетовый так же окрашена мякоть) на дендрограмме удалены друг от друга (см. рис. 1).
На графике, построенном методом главных координат, анализируемые сорта формируют единый диффузный пул генотипов, в котором выделяется та же внешняя группа, что и на дендрограмме, однако кластеризация сортов происходит несколько иным образом, хотя заметны сближения образцов по устойчивости к фитофторозу или PVY (рис. 2). Интересно отметить, что характеристики устойчивости анализируемых сортов, взятые из данных Госсортреестра (от оригинаторов сортов), не всегда совпадают с результатами исследований. Примером может служить работа Н.С. Клименко с соавт. (26). По всей вероятности, это связано с трудностями визуального определения симптоматики ответа на заражение (26). Образец S. stoloniferum, взятый в анализ в качестве внешней группы, на графике PCA расположился достаточно близко относительно остальных сортов и образцов S. tuberosum. Это можно объяснить тем, что образцы вида S. stoloniferum достаточно давно и часто используются в селекционных программах в качестве доноров устойчивости к различным стрессам (34).
Довольно высокая степень общего полиморфизма анализируемой выборки сортов, отсутствие четкой кластеризации и «нестабильное» поло-жение образцов, скорее всего, связаны с тем, что в настоящее время идет интенсивный обмен селекционным материалом. При подборе родительских пар селекционеры включают образцы из различных мировых селекционных центров, что подтверждается многими современными исследованиями. Например, SSR-анализ 113 отечественных сортов картофеля (из них 80 российских и 33 — из ближнего зарубежья), в том числе 12 сортов, которые были изучены в нашей работе, показал отсутствие кластеризации по странам (22). Даже морфологически мало полиморфная коллекция из 32 сортов картофеля, выращиваемых в скандинавских странах, по результатам AFLP-анализа не группировалась в соответствии со странами происхождения (19).
Нами также был проведен анализ геномной структуры образцов картофеля с использованием программы Structure v. 2.3.4. Анализ геномной структуры позволяет выявлять общие генетические блоки, а также соотношение таких блоков в каждом образце, что дает возможность распределять анализируемые образцы на подгруппы. Мы проанализировали варианты для числа подгрупп (k) от 2 до 15. Наилучший результат (LnLike = -23219,2) был получен для k = 3.
На полученном графике геномная структура исследуемых 65 сортов и селекционных клонов картофеля представлена в виде различных соотношений трех блоков (рис. 3). Сколь-нибудь четкой корреляции между соотношениями блоков и каким-либо из рассматриваемых признаков (см. табл. 1) выявлено не было. Имеется некоторая слабо выраженная тенденция к кластеризации сортов с устойчивостью к нематоде (группы 1, 2, 3) и PVY (группа 3) и со сходной окраской клубней (клубни с желтой кожурой; это, вероятно, объясняется преобладанием сортов с желтыми клубнями в выборке) (см. рис. 3, табл. 1).
Итак, в результате проведенного AFLP-маркирования селективно-нейтральных участков генома у 65 сортов и перспективных селекционных клонов картофеля, включая современные отечественные сорта, выявлен высокий уровень геномного полиморфизма, отсутствие четкой кластеризации по принадлежности к определенному селекционному центру или морфо-биологическим признакам. Показано, что AFLP-метод с выбранными нами праймерными комбинациями перспективен для генотипирования сортов картофеля при первичном скрининге коллекций и первичном отборе сортов по целевым признакам для последующего углубленного анализа.
2. Результаты AFLP-анализа 65 сортов и селекционных клонов картофеля |
||||
Комбинация праймеров |
Число фрагментов |
|||
общее |
полиморфные |
уникальные |
||
всего |
% |
|||
E35/M40 |
79 |
67 |
84,8 |
7 |
Е41/М35 |
139 |
122 |
87,8 |
12 |
Всего |
218 |
189 |
86,7 |
19 |
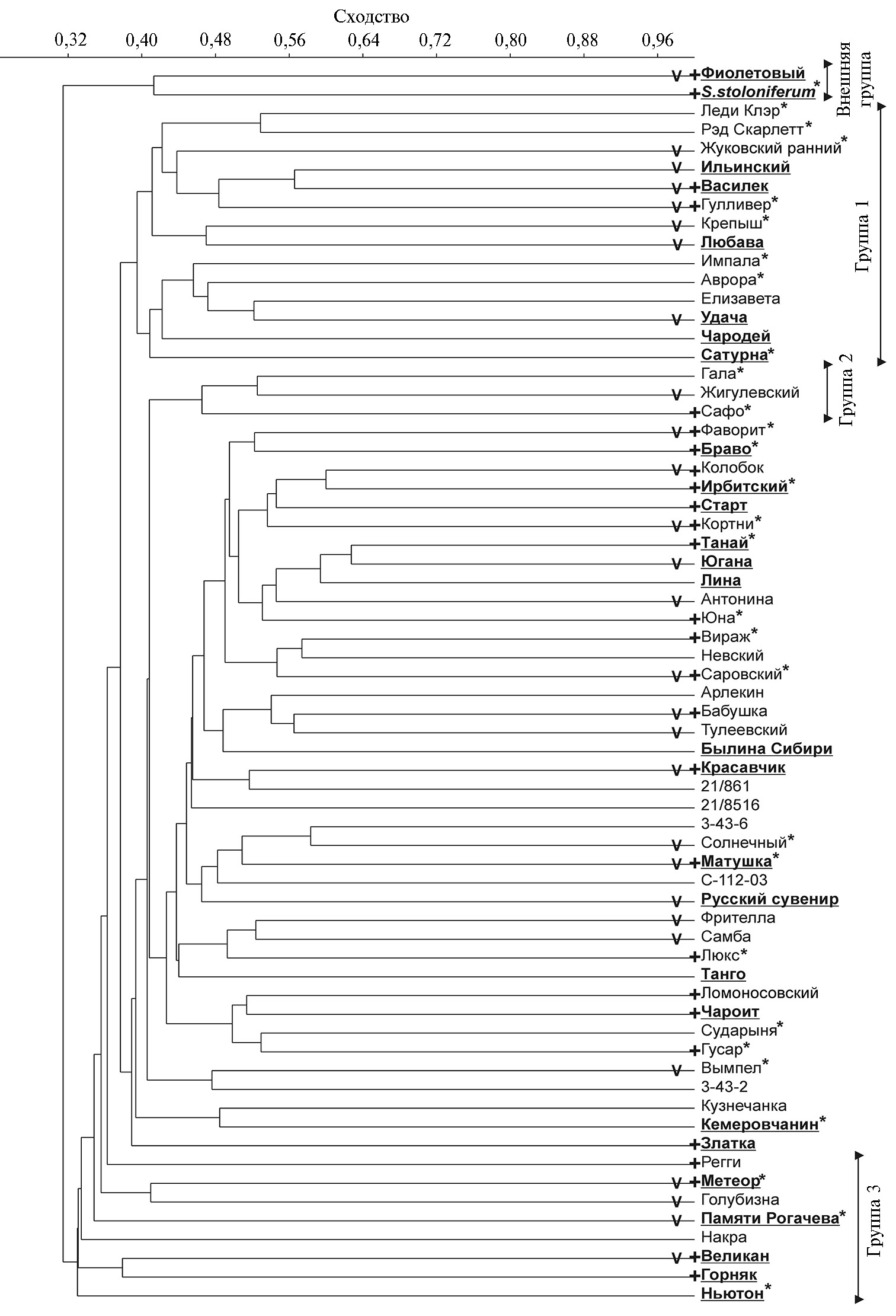
Рис. 1. Дендрограмма генетических различий 60 сортов и пяти селекционных клонов картофеля, построенная по данным AFLP-анализа методом ближайшего соседа (PAST). Названия сортов, устойчивых к фитофторозу, выделены полужирным шрифтом и подчеркиванием, сортов, устойчивых к вирусу Y картофеля, — знаком (+), к золотистой цистообразующей нематоде — звездочкой (*). Знаком (v) отмечены сорта селекции Всероссийкого НИИ картофельного хозяйства им. А.Г. Лорха.
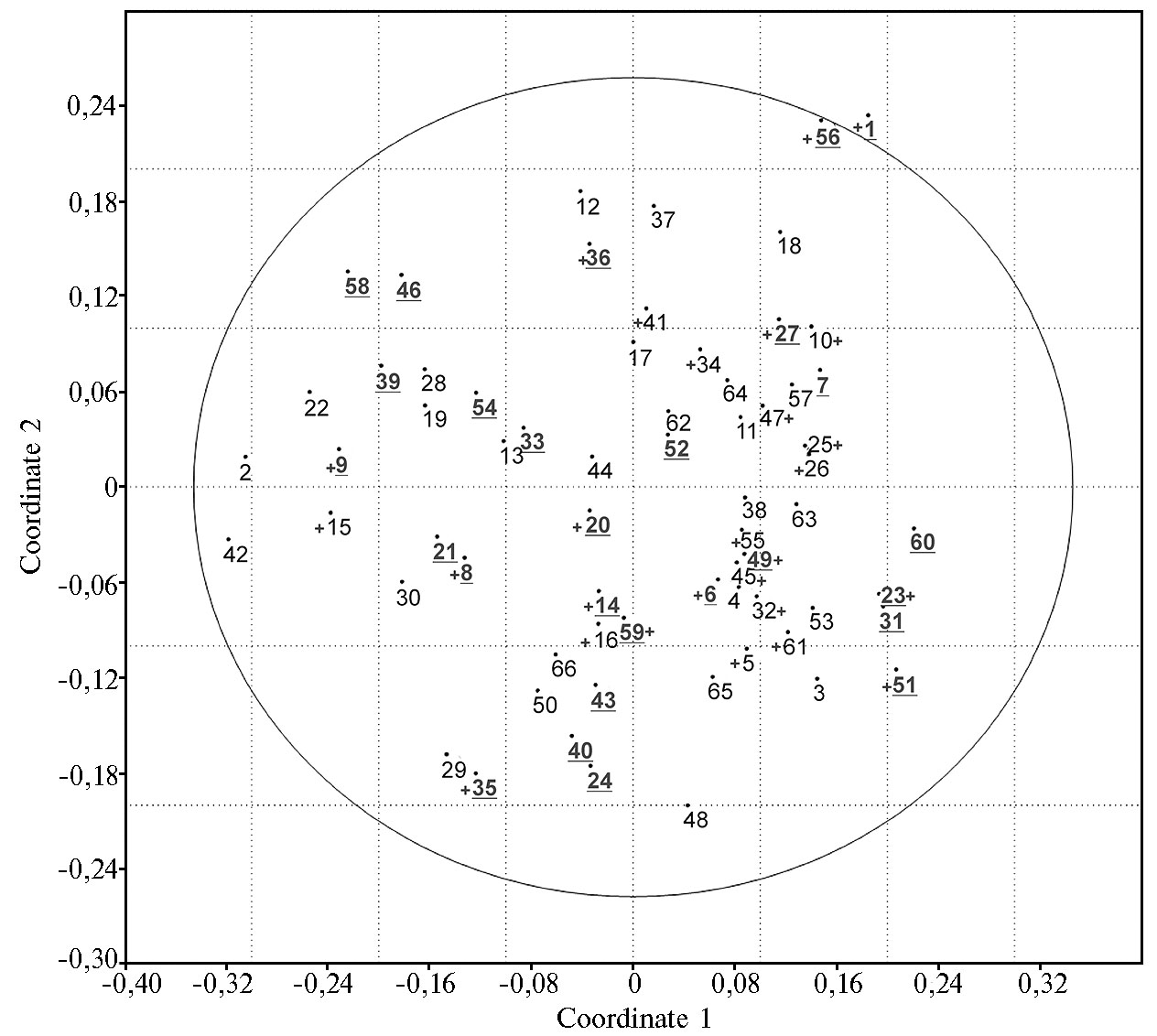
Рис. 2. РСA-анализ данных AFLP-маркирования 60 сортов и пяти селекционных клонов картофеля. Цифры соответствуют нумерации образцов в таблице 1. Внешняя группа представлена номерами 1 (Solanum stoloniferum) и 20 (сорт Фиолетовый). Номера сортов, устойчивых к фитофторозу, выделены полужирным шрифтом и подчеркнуты, устойчивых к вирусу Y кар-тофеля — отмечены знаком (+).
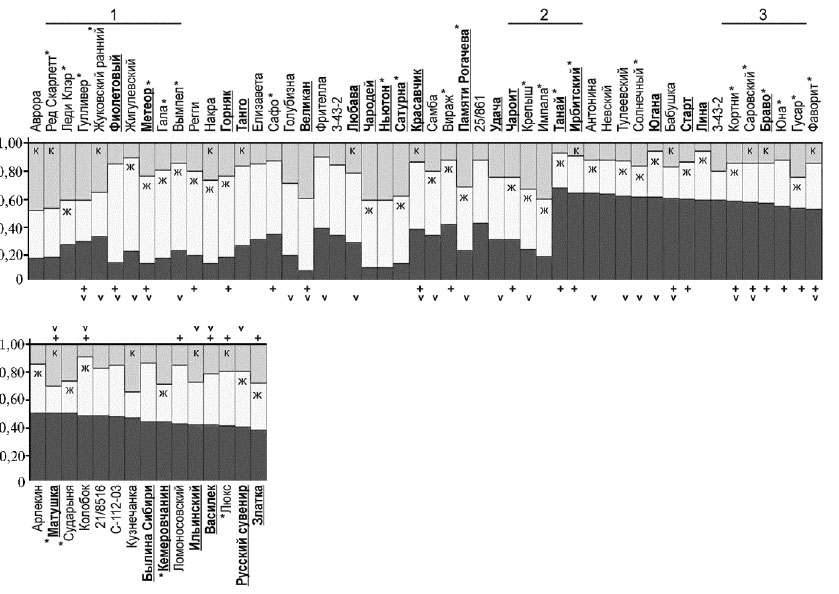
Рис. 3. Анализ геномной структуры 60 сортов и пяти селекционных клонов картофеля для k = 3 по данным AFLP-анализа (программа Structure v. 2.3.4, номера согласно таблице 1). Анализ проводился без данных по виду Solanum stoloniferum. Названия сортов, устойчивых к фитофторозу, выделены полужирным шрифтом и подчеркиванием, названия сортов, устойчивых к вирусу Y картофеля, — знаком (+), к золотистой цистообразующей нематоде — звездочкой (*). Знаком (v) от-мечены сорта селекции Всероссийкого НИИ картофельного хозяйства им. А.Г. Лорха. Окраска кожуры клубней: к — красная, ж — желтая.
ЛИТЕРАТУРА
- Russell J.R., Fuller J.D., Macaulay M., Hatz B.G., Jahoor A., Powell W., Waugh R. Direct comparison of levels of genetic variation among barley accessions detected by RFLPs, AFLPs, SSRs and RAPDs. Theoretical and Applied Genetics, 1997, 95: 714-722 (doi: 10.1007/s001220050617).
- Semagn K., Bjørnstad Å., Ndjiondjop M.N. An overview of molecular marker methods for plants. African Journal of Biotechnology, 2006, 5(25): 2540-2568.
- Хлесткина Е.К. Молекулярные маркеры в генетических исследованиях и в селекции. Вавиловский журнал генетики и селекции, 2013, 17(4/2): 1044-1053.
- Vos P., Hogers R., Bleeker M., Reijans M., van de Lee T., Hornes M., Friters A., Pot J., Paleman J., Kuiper M., Zabeau M. AFLP: a new technique for DNA fingerprinting. Nucleic Acids Research, 1995, 23(21): 4407-4414 (doi: 10.1093/nar/23.21.4407).
- Kardolus J.P., van Eck H.J., van den Berg R.G. The potential of AFLPs in biosystematics: a first application in Solanum taxonomy (Solanaceae). Plant Systematics and Evolution, 1998, 210(1-2): 87-103 (doi: 10.1007/BF00984729).
- Hassan F.S.C., Solouki M., Fakheri B.A., Nezhad N.M., Masoudi B. Mapping QTLs for physiological and biochemical traits related to grain yield under control and terminal heat stress conditions in bread wheat (Triticum aestivum L.). Physiology and Molecular Biology of Plants, 2018, 24(6): 1231-1243 (doi: 10.1007/s12298-018-0590-8 ).
- El-Esawi M.A., Alaraidh I.A., Alsahli A.A., Ali H.M., Alayafi A.A., Witczak J., Ahmad M. Genetic variation and alleviation of salinity stress in barley (Hordeum vulgare L.). Molecules, 2018, 23(10): 2488 (doi: 10.3390/molecules23102488).
- Дьяченко Е.А., Рыжова Н.Н., Вишнякова М.А., Кочиева Е.З. Молекулярно-генетическое разнообразие гороха (Pisumsativum L.) из коллекции ВИР на основе данных AFLP-анализа. Генетика, 2014, 50(9): 1040-1049 (doi: 10.7868/s0016675814090045).
- El-Esawi M.A., Al-Ghamdi A.A., Ali H.M., Alayafi A.A., Witczak J., Ahmad M. Analysis of genetic variation and enhancement of salt tolerance in French pea (Pisum sativum L.). International Journal of Molecular Sciences, 2018, 19(8): 2433 (doi: 10.3390/ijms19082433).
- Кочиева Е.З., Рыжова Н.Н. Молекулярное AFLP-маркирование генотипов сортов перца (Capsicum annuum). Генетика, 2003, 39(12): 1589-1593.
- Кочиева Е.3., Рыжова Н.Н. Анализ вариабельности семейства генов устойчивости у представителей вида перца Capsicumannuum. Доклады Академии наук, 2009, 425(2): 256-258.
- Bamberg J.B., del Rio A.H. Selection and validation of an AFLP marker core collection for the wild potato Solanum microdontum. American Journal of Potato Research, 2014, 91(4): 368-375 (doi: 10.1007/s12230-013-9357-5).
- McGregor C.E., van Treuren R., Hoekstra R., van Hintum T.J. Analysis of the wild potato germplasm of the series Acaulia with AFLPs: implications for ex situ conservation. Theoretical and Applied Genetics, 2002, 104(1): 146-156 (doi: 10.1007/s001220200018).
- Bryan G.J., McLean K., Waugh R., Spooner D.M. Levels of Intra-specific AFLP diversity in tuber-bearing potato species with different breeding systems and ploidy levels. Frontiers in Genetics, 2017, 8: 119 (doi: 10.3389/fgene.2017.00119).
- Hawkes J.G. The potato: evolution, biodiversity and genetic resources. American Potato Journal, 1990, 67(10): 733-735 (doi: 10.1007/BF03044023).
- Jacobs M.M., van den Berg R.G., Vleeshouwers V.G., Visser M., Mank R., Sengers M., Hoekstra R., Vosman B. AFLP analysis reveals a lack of phylogenetic structure within Solanum section Petota. BMC Evolutionary Biology, 2008, 8: 145 (doi: a>10.1186/1471-2148-8-145
- Manoko M.L.K., van den Berg R.G., Feron R.M.C., van der Weerden G.M., Mariani C. AFLP markers support separation of Solanum nodiflorum from Solanum americanum sensu stricto (Solanaceae). Plant Systematics and Evolution, 2007, 267(1-4): 1-11 (doi: 10.1007/s00606-007-0531-4).
- Solis J.S., Ulloa D.M., Rodríguez L.A. Molecular description and similarity relationships among native germplasm potatoes (Solanum tuberosum ssp. tuberosum L.) using morphological data and AFLP markers. Electronic Journal of Biotechnology, 2007, 10(3): 436-443 (doi: 10.2225/vol10-issue3-fulltext-14).
- Vetelainen M., Gammelgard E., Valkonen J.P.T. Diversity of Nordic landrace potatoes (Solanum tuberosum L.) revealed by AFLPs and morphological characters. Genetic Resources and Crop Evolution, 2005, 52(8): 999-1010 (doi: 10.1007/s10722-003-6129-y).
- Cicatelli A., Baldantoni D., Iovieno P., Carotenuto M., Alfani A., De Feis I., Castiglione S. Genetically biodiverse potato cultivars grown on a suitable agricultural soil under compost amendment or mineral fertilization: yield, quality, genetic and epigenetic variations, soil properties. Science of the Total Environment, 2014, 493: 1025-1035 (doi: 10.1016/j.scitotenv.2014.05.122 ).
- Gavrilenko T., Antonova O., Shuvalova A., Krylova E., Alpatyeva N., Spooner D., Novikova L. Genetic diversity and origin of cultivated potatoes based on plastid microsatellite polymorphism. Genetic Resources and Crop Evolution, 2013, 60(7): 1997-2015 (doi: 10.1007/s10722-013-9968-1).
- Антонова О.Ю., Швачко Н.А., Новикова Л.Ю., Шувалов О.Ю., Костина Л.И., Клименко Н.С., Шувалова А.Р., Гавриленко Т.А. Генетическое разнообразие сортов картофеля российской селекции и стран ближнего зарубежья по данным полиморфизма SSR-локусов и маркеров R-генов устойчивости. Вавиловский журнал генетики и селекции, 2016, 20(5): 596-606 (doi: 10.18699/VJ16.181 ).
- Колобова О.С., Малюченко О.П., Шалаева Т.В., Шанина Е.П., Шилов И.А., Алексеев Я.И., Велишаева Н.С. Генетическая паспортизация картофеля на основе мультиплексного анализа 10 микросателлитных маркеров. Вавиловский журнал генетики и селекции, 2017, 21(1): 124-127 (doi: 10.18699/VJ17.230).
- Гавриленко Т.А., Клименко Н.С., Антонова О.Ю., Лебедева В.А., Евдокимова З.З., Гаджиев Н.М., Апаликова О.В., Алпатьева Н.В., Костина Л.И., Зотеева Н.М., Мамадбокирова Ф.Т., Егорова К.В. Молекулярный скрининг сортов и гибридов картофеля северо-западной зоны Российской Федерации. Вавиловский журнал генетики и селекции, 2018, 22(1): 35-45 (doi: 10.18699/VJ18.329).
- Клименко Н.С., Антонова О.Ю., Костина Л.И., Мамадбокирова Ф.Т., Гавриленко Т.А. Маркер-опосредованная селекция отечественных сортов картофеля с маркерами генов устойчивости к золотистой картофельной нематоде (патотип RO1). Труды по прикладной ботанике, генетике и селекции, 2017, 178(4): 66-75 (doi: 10.30901/2227-8834-2017-4-66-75).
- Клименко Н.С., Антонова О.Ю., Желтова В.В., Фомина Н.А., Костина Л.И., Мамадбокирова Ф.Т., Гавриленко Т.А. Скрининг сортов картофеля (Solanum tuberosum L.) российской селекции с помощью маркеров R-генов устойчивости к Y-вирусу картофеля. Сельскохозяйственная биология, 2019, 54(5): 958-969 (doi: 10.15389/agrobiology.2019.5.958rus).
- Бирюкова В.А., Шмыгля И.В., Жарова В.А., Бекетова М.П., Рогозина Е.В., Митюшкин А.В., Мелёшин А.А. Молекулярные маркеры генов экстремальной устойчивости к Y вирусу картофеля в сортах и гибридах Solanum tuberosum L. Российская сельскохозяйственная наука, 2019, 5: 17-22 (doi: 10.31857/S2500-26272019517-22).
- Бирюкова В.А., Шмыгля И.В., Абросимова С.Б., Запекина Т.И., Мелешин А.А., Митюшкин А.В., Мананков В.В. Поиск источников генов устойчивости к патогенам среди образцов селекционно-генетических коллекций ВНИИКХ с использованием молекулярных маркеров. Защита картофеля, 2015, 1: 3-7.
- Puchooa D. A simple, rapid and efficient method for the extraction of genomic DNA from lychee (Litchi chinensis Sonn.). African Journal of Biotechnology, 2004, 3(4): 253-255.
- Hammer O., Harper D.A.T., Ryan P.D. PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica, 2001, 4(1): 1-9.
- Pritchard J.K., Stephens M., Donnelly P. Inference of population structure using multilocus genotype data. Genetics, 2000, 155(2): 945-959.
- Hubisz M.J., Falush D., Stephens M., Pritchard J.K. Inferring weak population structure with the assistance of sample group information. Molecular Ecology Resources, 2009, 9(5): 1322-1332 (doi: 10.1111/j.1755-0998.2009.02591.x).
- Esfahani S.T., Shiran B., Balali G. AFLP markers for the assessment of genetic diversity in European and North American potato varieties cultivated in Iran. Crop Breeding and Applied Biotechnology, 2009, 9(1): 75-86 (doi: 10.12702/1984-7033.v09n01a11).
- Machida-Hirano R. Diversity of potato genetic resources. Breed Science, 2015, 65(1): 26-40 (doi: 10.1270/jsbbs.65.26).