doi: 10.15389/agrobiology.2019.3.538rus
УДК 635.656:581.148.5:575.1::576.3
Работа выполнена в рамках госзадания ИБПК СО РАН на 2017-2020 годы № АААА-А17-117020110056-0.
ЦЕЛОСТНОСТЬ ЯДЕРНОЙ ДНК И ФИЗИОЛОГО-БИОХИМИЧЕСКИЕ ПОКАЗАТЕЛИ СЕМЯН У ГОРОХА ПОСЕВНОГО (Pisum sativum L.) ПРИ УСКОРЕННОМ СТАРЕНИИ
Г.В. ФИЛИППОВА1, Э.В. ФИЛИППОВ1, И.А. ПРОКОПЬЕВ1, А.А. ШЕИН1, А.Н. НЕУСТРОЕВ2
В настоящее время уделяется большое внимание изучению роли повреждений ДНК, а также основным механизмам поддержания стабильности генома в сохранении жизнеспособности семян при старении. Кроме того, формируются представления, согласно которым значительные окислительные повреждения ДНК генерируются во время набухания семени, а активно протекающие процессы восстановления ДНК представляют собой фактор, способствующий инициации репликации ДНК и быстрому прорастанию семян. Вместе с тем сведений по количественной оценке степени повреждения ДНК и влиянии таких повреждений на прорастание семян в научных работах представлено недостаточно, что, вероятно, обусловлено небольшим опытом применения метода ДНК-комет для растений. Оценка генотоксических эффектов, про- и антиоксидантных систем, сопровождающих старение семян, важна для понимания физиолого-биохимических изменений и прогнозирования восстановительных процессов у различных сортов и межсортовых гибридов в условиях долговременного хранения. Представленные нами в настоящем сообщении результаты не только подтвердили факт повреждений ДНК, но и позволили охарактеризовать их количественно, что частично восполняет имеющийся дефицит информации относительно роли, которую играет нарушение целостности ядерной ДНК в старении семян. Цель исследования — определить степень повреждения ДНК, активность про- и антиоксидантов в клетках зародышей и посевные качества семян при ускоренным старении на примере двух сортов и межсортового гибрида гороха посевного (Pisum sativum L.). Мы показали, что у изученных сортов и их гибрида ускоренное старение неодинаково влияло на состояние ядерной ДНК, функцию системы про- и антиоксидантов, прорастание и всхожесть семян. Наименее устойчивым к условиям ускоренного старения был сорт Мелкосемянный 2, средней устойчивостью обладали семена сорта Сарыал. Наибольшую устойчивость проявили семена гибрида этих сортов, что может быть обусловлено эффектом гетерозиса. Старение семян вызывало достоверное увеличение степени повреждения ДНК (процент ДНК в хвосте кометы и/или процент атипичных комет). Чем дольше семена находились в условиях, приводящих к индукции процессов старения, тем выше была степень фрагментации ДНК в клетках зародышей при набухании. Пребывание семян в условиях ускоренного старения в течение 24 нед вызывало повышение доли ДНК в хвосте кометы в 1,6-3,3 раза, а число атипичных комет в клетках зародышей увеличивалось в 17-40 раз относительно контроля, в зависимости от образца. Вероятно, значительное снижение физиологических характеристик у менее устойчивых образцов гороха, вызванное условиями старения, могло быть обусловлено высокой степенью фрагментации ядерной ДНК, снижением активности антиоксидантных ферментов (в частности, пероксидазы), а также нарастающей интенсификацией окислительных процессов в клетках зародышей. Последнее выражалось в 2,5-кратном превышении активности перекисного окисления липидов в клетках зародышей семян у быстро стареющего сорта (относительно контроля) на фоне низкой всхожести. Можно предположить, что увеличение степени повреждения ДНК у изученных сортов гороха происходит вследствие «истощения» энзимных антиоксидантных и репарационных систем и свидетельствует о замедлении или утрате восстановительных процессов в клетках зародышей стареющих семян.
Ключевые слова: Pisum sativum, горох посевной, семена, ускоренное старение, энергия прорастания, всхожесть, перекисное окисление липидов, пероксидаза, низкомолекулярные антиоксиданты, ДНК-кометы.
Свойство семени длительное время находиться в состоянии физиологического покоя, переносить неблагоприятные условия, сохраняя жизнеспособность, и успешно прорастать служит необходимым условием для начала жизненного цикла растения и последующего получения потомства (1, 2). Считается, что сохранение жизнеспособности семян в течение определенного времени во многом зависит от генетических особенностей вида, а также условий хранения. Из факторов, влияющих на скорость старения семян, выделяют прежде всего температуру и влажность (3, 4). Кроме того, долговечность семян обусловлена их качеством, которое, в свою очередь, определяют условия вегетации и созревания, размеры семян и т.д.
Однако длительное хранение неизбежно приводит к задержке прорастания, снижению всхожести или к полной потере жизнеспособности (5, 6). К числу основных причин старения и гибели семян относят избыточное образование активных форм кислорода (АФК), инактивацию ферментов, разрушение белков и липидов, нарушение целостности мембран, деградацию ДНК (6-9).
В настоящее время уделяется большое внимание изучению роли повреждения ДНК, а также основных механизмов поддержания стабильности генома в сохранении жизнеспособности семян при старении. Накапливается экспериментальный материал, подтверждающий усиление процессов окислительного повреждения ДНК во время набухания семян даже при их высоком качестве, а активно протекающие процессы восстановления ДНК рассматривают как фактор, способствующий инициации репликации и быстрому прорастанию семян (10). К наиболее распространенным повреждениям молекулы ДНК относятся одно- и двунитевые разрывы, а также изменения структуры пуриновых и пиримидиновых оснований. Замедление прорастания и снижение всхожести стареющих семян связывают с длительной репарацией ДНК и задержкой репликативного синтеза ДНК (11, 12).
Изучение физиологических и биохимических характеристик семян, прогнозирование их долговечности и способности к хранению в основном проводят с использованием методов ускоренного старения в условиях, способствующих увеличению влажности семян и при действии высокой температуры (13, 14). При воздействии именно этих факторов семена, как правило, теряют жизнеспособность в течение короткого времени.
Большой интерес представляет изучение связей между целостностью генома зародыша и качеством семян. Вместе с тем сведения по количественной оценке степени повреждения ДНК и ее влиянии на способность семян к прорастанию в научной литературе ограничены. Вероятно, это обусловлено небольшим опытом применения метода ДНК-комет на растениях, тогда как он широко и результативно используется в системах in vivo и in vitro для оценки генотоксических эффектов при воздействии различными факторами физической и химической природы на клетки человека, животных и микроорганизмы.
В своем сообщении мы описали генотоксические эффекты и функции про- и антиоксидантных систем, сопровождающих старение семян у двух сортов гороха посевного (Pisum sativum L.) и их межсортового гибрида, что важно для понимания физиолого-биохимических изменений и прогнозирования восстановительных процессов в условиях долговременного хранения. В результате мы не только подтвердили факт повреждений ДНК, но и описали их количественно, что частично восполняет дефицит данных о роли повреждения ДНК в старении семян.
Цель работы — изучить влияние ускоренного старения семян гороха посевного на показатели их жизнеспособности, окислительные процессы и стабильность структуры ядерной ДНК в клетках зародышей при прорастании (в фазу набухания).
Методика. Семена трех образцов (сорта Сарыал, Мелкосемянный 2 и их гибрид Сарыал × Мелкосемянный 2) гороха посевного (Pisum sativum L.) были получены в условиях опытной станции, расположенной на коренном берегу среднего течения р. Лена. Почва участка мерзлотная таежная, палевая, осолоделая, типичная для земледельческой зоны Центральной Якутии. Вегетационный период оценивали, как засушливый (ГТК = 0,76) и наиболее соответствующий среднемноголетним климатическим наблюдениям для Центральной Якутии (ГТК = 0,72).
Семена проращивали в контейнерах, заполненных на 2/3 высоты стерильным кварцевым песком с размером частиц 0,5-2,0 мм и 80 % влагоемкостью. Семена трамбовкой вдавливали в песок на глубину, равную их толщине и проращивали в темноте при 20 °С. Энергию прорастания определяли на 4-е сут, всхожесть — на 8-е сут. Влажность семян оценивали гравиметрически (прибор МB45, «Ohaus», Швейцария). Навеску семян массой 10 г измельчали с использованием ротационной системы помола в течение 60 с и высушивали 20 мин при 150 °С.
Показатели всхожести и влажности семян исходных образцов, определенные перед началом эксперимента, составили соответственно 95-97 % и 7 %. Ускоренное старение семян осуществляли в соответствии с описанием (13). Семена увлажняли в термостате при 37 °С и относительной влажности воздуха 98 %. Значение конечной влажности семян для каждого образца составляло 13,5 %. Контроль влажности семян осуществляли гравиметрически, как описано выше. Образцами сравнения (контроль) служили семена, не подвергавшиеся дополнительному увлажнению.
Для биохимических и молекулярных исследований использовали ткани зародышей. Семена гороха раскладывали в один слой в чашки Петри и на 2/3 заливали дистиллированной водой; после 12-часового набухания семян зародыши изолировали.
Спектрофотометрические измерения выполняли на приборе UV-2600 («Shimadzu», Япония). Суммарное содержание низкомолекулярных антиоксидантов (НМАО) определяли в соответствии с методикой (15), основанной на окислении антиоксидантов хлоридом железа (III) с его восстановлением до хлорида железа (II), количество которого измеряли по изменению интенсивности окрашивания при добавлении о-фенантролина (коэффициент экстинкции ε = 52,8 мМ-1 · см-1 при λ = 510 нм). Активность пероксидазы (ПОК, EC 1.11.1.7) оценивали по увеличению оптической плотности вследствие образования окрашенного продукта окисления о-дианизидина (ε = 30 мМ-1 · см-1 при λ = 460 нм) в течение 1 мин (16), интенсивность перекисного окисления липидов (ПОЛ) — по накоплению окрашенного комплекса малонового диальдегида (МДА) с тиобарбитуровой кислотой (ε = 155 мМ-1 · см-1 при λ = 532 нм) (17).
Степень фрагментации ДНК в изолированных зародышах определяли с помощью щелочной версии метода ДНК-комет (гель-электрофорез одиночных клеток) с некоторыми модификациями (18), позволяющей количественно оценить повреждения ДНК (однонитевые, двунитевые разрывы, щелочелабильные пуриновые и пиримидиновые сайты) (19). После периода набухания семян изолированные зародыши помещали в чашки Петри диаметром 60 мм на льду, заливали 250 мкл холодного натрий-фосфатного буфера (рН 7,5) и острым лезвием бритвы аккуратно делали разрезы. Чашки держали наклоненными во льду таким образом, чтобы ядра, высвобождающиеся из клеток зародыша в буфер, скапливались в нижней части чашки. Суспензию, содержащую ядра, очищали от крупных примесей с помощью нейлонового сетчатого фильтра с величиной отверстий 20 мкм. Затем 60 мкл полученной суспензии помещали в пробирки с 240 мкл 1 % раствора легкоплавкой агарозы и наносили на предварительно покрытые тугоплавкой агарозой предметные стекла. После затвердевания агарозы при температуре 4 °С микропрепараты помещали в щелочной буфер для электрофореза (300 мМ NaOH, 1 мМ EDTA, pH > 13) на 20 мин для денатурации ДНК и однонитевых разрывов по щелочелабильным сайтам. Электрофорез проводили в течение 20 мин при напряженности поля V = 1 В/см и силе тока ~ 300 мА, после чего препараты промывали натрий-фосфатным буфером (рН 7,5), фиксировали в 70 % растворе этанола и высушивали. Непосредственно перед микроскопированием (флуоресцентный микроскопе ЛабМед-2Л, Россия) препараты окрашивали флуоресцирующим красителем SYBR Green I («Sigma-Aldrich», США; концентрация 20 мкг/мл) в течение 30 мин и просматривали при увеличении ×200, используя возбуждающий и отсекающий светофильтры (соответственно 490 и 530 нм). Полученные изображения ДНК-комет анализировали с помощью программного обеспечения CASP 1.2.2 (http://casplab.com/download). За показатель поврежденности ДНК принимали процентное содержание ДНК в хвосте комет (доля ДНК в хвосте от общего количества ДНК в комете, %). Атипичные ДНК-кометы, у которых отсутствовала или практически отсутствовала голова и имелся широкий диффузный хвост, выделяли в отдельную категорию и подсчитывали их число на 100 ДНК-комет (20).
Все измерения выполняли в 4 повторностях. Результаты экспериментов представлены в виде средней арифметической (M) и ее стандартной ошибки (±SEM). Выборки сравнивали методом однофакторного дисперсного анализа (ANOVA), статистическую значимость различий с контролем определяли с использованием критерия Даннета для множественного сравнения при уровне значимости p < 0,05. Расчет проводился с помощью пакета AnalystSoft, StatPlus v.2007 («AnlystSoft Inc.», Германия).
Результаты. Краткое описание использованных в эксперименте сортов и их гибрида представлено в таблице 1. Сорт Мелкосемянный 2 создан в Башкирском НИИ сельского хозяйства (г. Уфа) в 1961 году, c 1963 года включен в Государственный реестр селекционных достижений, допущенных к использованию. Сорт Сарыал выведен в Якутском НИИ сельского хозяйства (г. Якутск) методом индивидуального отбора на неполегаемость и скороспелость из безымянного образца (США) в 2002 году, в 2015 году передан на Государственное сортоиспытание, с 2019 года включен в Государственный реестр селекционных достижений, допущенных к использованию. Гибрид Сарыал × Мелкосемянный 2 получен в этом же институте в 2004 году и в настоящее время проходит станционные испытания в селекционных питомниках Якутского НИИ сельского хозяйства.
Согласно имеющимся представлениям, старение семян, обусловленное процессами окисления в период покоя семян, которое усиливается в период набухания, приводит к метаболическим изменениям, что в зависимости от степени повреждения выражается в замедлении прорастания, снижении жизнеспособности и собственно гибели семян (7).
Сорта и гибрид гороха, используемые в нашем исследовании, исходно (контроль) различались по энергии прорастания семян (табл. 2). Высокий показатель (86 %) имел сорт Сарыал, у двух других образцов она была несколько ниже и составляла соответственно 78 и 62 % для сорта Мелкосемянный 2 и гибрида. Всхожесть исследуемых семян находилась в пределах 95-97 %.
В процессе ускоренного старения после 6-недельного воздействия снижение энергии прорастания на 30 % (p< 0,05) отмечали только у сорта Мелкосемянный 2, что, однако, не отразилось на показателе всхожести, который достоверно не отличался от контроля. Воздействие в течение 12 нед у этого сорта привело к снижению энергии прорастания еще на 18 %, всхожести — на 50 % (p< 0,05). У сорта Сарыалтоже происходило снижение этих показателей относительно контроля (соответственно на 26 и 18 %). Значительные изменения физиологических показателей наблюдались после 24 нед в условиях, определяющих искусственное старение. У сорта Мелкосемянный 2 энергия прорастания и всхожесть снизились до 8 %, у двух других образцов энергия прорастания составила около 24 %, всхожесть у сорта Сарыалпонизилась в 4,4, у гибрида — в 3,0 раза относительно контроля. Таким образом, из изученных образцов быстро стареющими были семена сорта Мелкосемянный 2, средней устойчивостью обладали семена сорта Сарыал, а устойчивость проявили семена гибрида этих сортов, что может быть обусловлено эффектом гетерозиса. Полученные нами данные относительно сортоспецифичности изменения физиологических показателей в процессе старения семян согласуются с результатами других исследований (21, 22).
Семена во время хранения характеризуются низким содержанием влаги, что обусловливает их незначительную метаболическую активность, при этом процессы автоокисления генерируют свободно-радикальные продукты реакций (23). К наиболее критической стадии прорастания семян относят набухание, которое приводит к высвобождению АФК, образовавшихся как во время хранения, так и вследствие усиления дыхательной активности (7). Мы изучили накопление МДА (как конечного продукта ПОЛ) в клетках зародышей стареющих семян гороха после 12-часового набухания (рис. 1, А).
У семян двух образцов, характеризующихся средней и высокой устойчивостью к старению, в клетках зародышей наблюдалось увеличение накопления МДА относительно контроля в 1,5 раза (у сорта Сарыал через 6 нед, у гибрида – через 12 и 24 нед). У сорта Мелкосемянный 2 такого увеличения не отмечали, что (с учетом наибольшей скорости старения у этого образца) не исключает интенсивного ПОЛ в период между 0 и 6 нед. Вместе с тем у этого сорта после 24-недельного воздействия факторов старения интенсивность ПОЛ была в 2,5 раза выше, чем в контроле.
Следует отметить отсутствие линейной зависимости ПОЛ от продолжительности уско-ренного старения.
Считается, что определяющую роль в инактивации АФК в условиях усиливающегося оксидативного стресса играют низкомолекулярные антиоксиданты, что обусловлено в том числе истощением пула и/или активности энзимных антиоксидантов при длительном окислительном воздействии (7, 24). Мы определили содержание НМАО (рис. 2) и активность пероксидазы (см. рис. 1, Б) в клетках зародышей при набухании семян в разные сроки при искусственном старении. Пероксидаза — бифункциональный фермент, участвующий в пероксидазных или оксидазных реакциях и высвобождении АФК. Также этот белок связан с процессами клеточного удлинения и реакциями, ограничивающими рост (25, 26).
Активность ПОК в клетках зародышей быстро стареющего сорта Мелкосемянный 2 с увеличением времени воздействия снижалась в период 6-12 нед в 2 раза, а после 24 нед — в 4 раза относительно контроля (см. рис. 1, Б). Содержание НМАО сначала в 1,5 раза снижалось (6 нед), а к концу 24-й нед увеличивалось в 1,5 раза по сравнению с контролем (см. рис. 2). У сорта Сарыал со средней скоростью старения (среди изученных образцов) за 6-24 нед активность фермента снижалась на 60-65 %. При этом количество НМАО уменьшалось на 23 % (p< 0,05) только на последнем сроке ускоренного старения. Наиболее устойчивый гибрид характеризовался достоверным снижением активности ПОК в 2,5 раза только после 24 нед старения, тогда как содержание НМАО было в 1,4 раза выше, чем в контроле, на протяжении всего периода наблюдения.
Таким образом, старение семян гороха приводило к снижению активности пероксидазы в клетках зародышей набухших семян. Изменение содержания НМАО у исследованных образцов гороха в условиях усиливающегося окислительного стресса имело разнонаправленный характер.
В результате нарушения окислительно-восстановительного равновесия, которое обусловлено избыточной генерацией АФК, снижением ферментативной активности, инициируется нарушение целостности структуры ДНК (7, 10). Использование щелочной версии метода ДНК-комет в нашем исследовании позволило сравнить количественно степень фрагментации ядерной ДНК в клетках зародышей в период набухания у контрольных образцов и семян, подвергшихся ускоренному старению (табл. 3). В контрольных образцах доля ДНК в хвосте кометы составляла 9-22 %. Старение семян приводило к достоверному (p < 0,05) увеличению степени повреждения ДНК по сравнению с контролем: на 13 % у сорта Сарыал с 24-й нед экспозиции, на 2,2-31,2 % у сорта Мелкосемянный 2 — с 12-й нед и на 3,5-20,5 % у гибрида — с 6-й нед. Также были выявлены кометы с отсутствующей или практически отсутствующей головой и широким диффузным хвостом (так называемые ghost cells, или hedgehogs). Появление таких атипичных ДНК-комет считается показателем необратимых процессов — клеточной гибели, связанной с сильным оксидативным стрессом, или формирования апоптотических клеток, находящихся на стадии фрагментации хроматина (27-29).
В эксперименте показано возрастание доли атипичных комет у всех исследуемых образцов гороха при более продолжительном воздействии факторов ускоренного старения семян. При 24-недельном искусственном старении число атипичных комет увеличивалось в зависимости от сорта в 17-40 раз относительно контроля. Сравнение полученных данных показало, что при увеличении доли атипичных комет до 10 % энергия прорастания семян снижалась на 25-30 %, тогда как всхожесть либо не отличалась от контроля, либо снижалась незначительно. Это обстоятельство может свидетельствовать о протекании репарационных процессов в клетках зародышей на стадии проклевывания семян и согласуется с результатами исследований (30, 31), в которых было показано, что при действии перекиси в концентрации, не вызывающей цитотоксического эффекта, возможна репарация поврежденных участков ДНК. Дальнейшее увеличение фрагментации ДНК приводило к снижению энергии прорастания и всхожести семян, что свидетельствовало об определенном критическом уровне повреждений ДНК и значительном снижении влияния процессов репарации ДНК.
Итак, полученные в настоящей работе результаты свидетельствуют о том, что ускоренное старение неодинаково влияет на всхожесть, энергию прорастания семян и биохимические характеристики клеток зародышей исследованных сортов и межсортового гибрида гороха посевного. Наименее устойчивым к условиям искусственного старения был сорт Мелкосемянный 2, средней устойчивостью обладали семена сорта Сарыал. Наибольшую устойчивость проявили семена межсортового гибрида, что, вероятно, является следствием эффекта гетерозиса. Воздействие условий ускоренного старения в течение 24 нед приводило к увеличению доли в ДНК в хвосте кометы в 1,6-3,3 раза, при этом число атипичных комет у разных образцов (сорта и гибрид) увеличивалось в 17-40 раз относительно контроля. Значительное снижение физиологических характеристик у менее устойчивого сорта гороха, вызванное условиями старения, могло быть обусловлено высокой степенью фрагментации ядерной ДНК, снижением активности антиоксидантных ферментов (в частности, пероксидазы), а также нарастающей интенсификацией окислительных процессов (превышение контрольного значения перекисного окисления липидов в 2,5 раза у быстро стареющего сорта на фоне низкой всхожести) в клетках зародышей. На основании полученных данных можно предположить, что увеличение степени повреждения ДНК у изученных сортов гороха происходит вследствие «истощения» энзимных антиоксидантных и репарационных систем и свидетельствует о замедлении или утрате восстановительных процессов в клетках зародышей у стареющих семян.
1. Характеристика изученных форм гороха посевного (Pisum sativum L.) |
|||||
Сорт, гибрид |
Скороспелость |
Масса 1000 семян, г |
Семена |
||
размер |
форма |
окраска |
|||
Мелкосемянный 2 |
Среднеранний |
141±1,4 |
Мелкие |
Шаровидные |
Белые матовые |
Сарыал |
Среднеранний |
277±3,0 |
Крупные |
Округлые |
Белые матовые |
Сарыал × Мелкосемянный 2 |
Среднеранний |
201±2,0 |
Средние |
Округлые |
Белые матовые |
2. Энергия прорастания и всхожесть семян у гороха посевного (Pisum sativum L.) в зависимости от времени воздействия факторов, определяющих ускоренное старение (M±SEM) |
||
Время воздействия, нед |
Энергия прорастания, % |
Всхожесть, % |
Сорт Сарыал |
||
0 (контроль) |
86±6 |
97±3 |
6 |
84±7 |
86±7 |
12 |
60±9* |
82±8* |
24 |
22±8* |
22±8* |
Сорт Мелкосемянный 2 |
||
0 (контроль) |
78±8 |
96±4 |
6 |
48±10* |
94±5 |
12 |
30±9* |
46±10* |
24 |
8±3* |
8±5* |
Гибрид Сарыал × Мелкосемянный 2 |
||
0 (контроль) |
62±9 |
95±4 |
6 |
74±9 |
99±1 |
12 |
66±7 |
84±7 |
24 |
26±8* |
32±9* |
* Различия с контролем статистически значимы при p < 0,05 (ANOVA, критерий Даннета для множественных сравнений). |
||
3. Степень повреждения ядерной ДНК в клетках зародышей семян у гороха посевного Pisum sativum L. в зависимости от времени воздействия факторов, определяющих ускоренное старение (M±SEM) |
||
Время воздействия, нед |
ДНК в хвосте, % |
Атипичные ДНК-кометы, % |
Сорт Сарыал |
||
0 (контроль) |
22,3±1,8 |
1,0±0,3 |
6 |
18,0±2,5 |
4,7±0,5* |
12 |
20,7±2,9 |
10,5±0,5* |
24 |
35,3±0,8* |
17,0±1,7* |
Сорт Мелкосемянный 2 |
||
0 (контроль) |
17,4±0,5 |
1,5±1,0 |
6 |
19,1±2,9 |
10,4±2,0* |
12 |
19,6±0,1* |
10,3±1,9* |
24 |
48,6±2,7* |
60,5±3,0* |
Образец Сарыал × Мелкосемянный 2 |
||
0 (контроль) |
8,7±0,6 |
0,5±0,2 |
6 |
12,2±1,8* |
2,4*±0,6 |
12 |
13,1±1,3* |
7,5*±0,9 |
24 |
29,2±1,8* |
17,0±0,5* |
* Различия с контролем статистически значимы при p < 0,05 (ANOVA, критерий Даннета для множественных сравнений). |
||
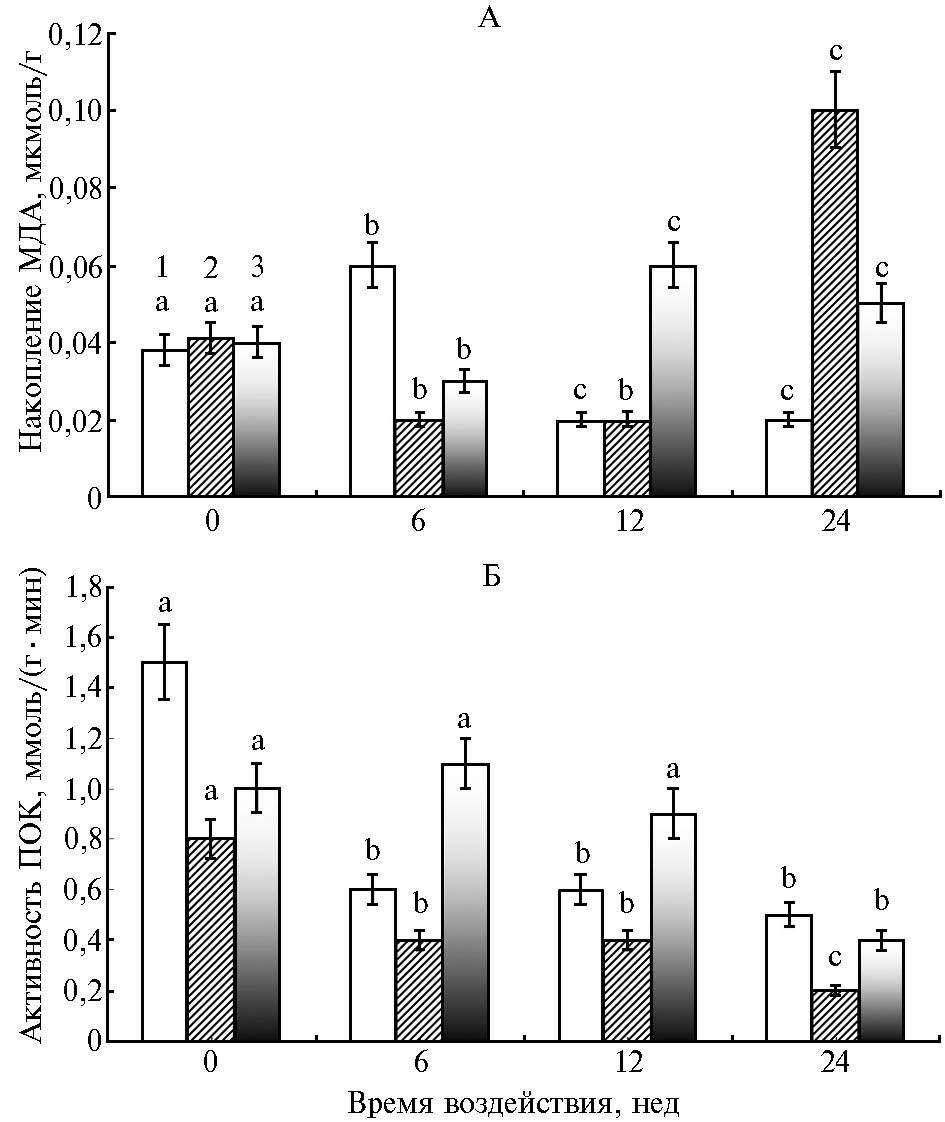
Рис. 1. Накопление малонового диальдегида (МДА) (А) и активность пероксидазы (ПОК) (Б) в клетках зародышей набухших семян у гороха посевного (Pisum sativum L.) в зависимости от времени воздействия факторов, определяющих ускоренное старение: 1 — сорт Сарыал, 2 — сорт Мелкосемянный 2, 3 — гибрид Сарыал ½ Мелкосемянный 2; a — контрольное или неотличимое от него значение, b — значение, отличающееся от контроля, c — значение, отличающееся и от a, и от b (различия статистически значимы при p < 0,05 по критерию Даннета для множественных сравнений).
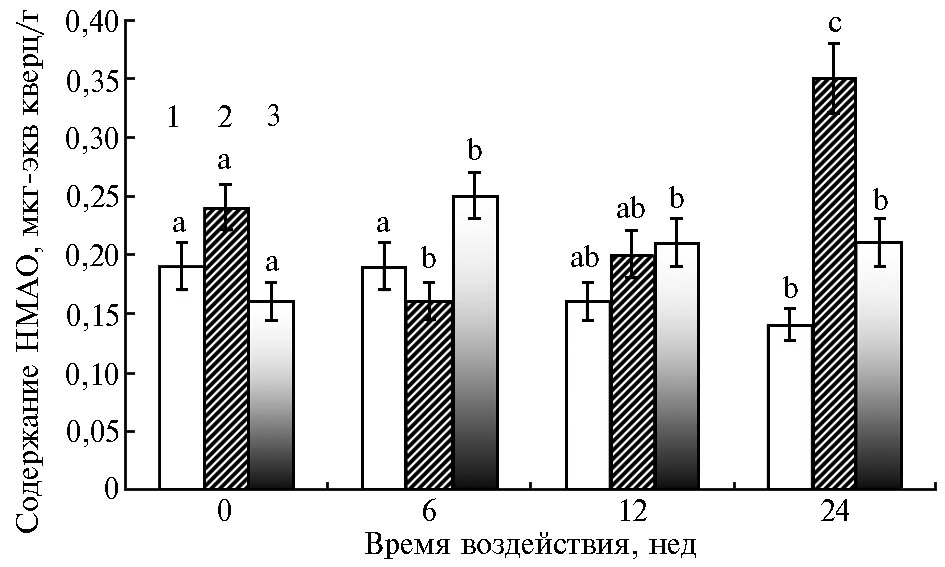
Рис. 2. Содержание низкомолекулярных антиоксидантов (НМАО) в клетках зародышей набухших семян у гороха посевного (Pisum sativum L.) в зависимости от времени воздействия факторов, определяющих ускоренное старение: 1 — сорт Сарыал, 2 — сорт Мелкосемянный 2, 3 — гибрид Сарыал × Мелкосемянный 2; a — контрольное или неотличимое от него значение, b — значение, отличающееся от контроля, c — значение, отличающееся и от a, и от b (различия статистически значимы при p < 0,05 по критерию Даннета для множественных сравнений).
ЛИТЕРАТУРА
- Rajjou L., Duval M., Gallardo K., Catusse J., Bally J., Job C. and Job D. Seed germination and vigor. Annual Review of Plant Biology, 2012, 63: 507-533 (doi: 10.1146/annurev-arplant-042811-105550).
- Bewley J.D. Seed germination and dormancy. Plant Cell, 1997, 9: 1055-1066 (doi: 10.1105/tpc.9.7.1055).
- Walters C., Wheeler L.M, Grotenhuis J.M. Longevity of seeds stored in a genebank: species characteristics. Seed Science Research, 2005, 15: 1-20 (doi: 10.1079/SSR2004195).
- Miura K., Lin Y., Yano M., Nagamine T. Mapping quantitative trait loci controlling seed longevity in rice (Oryza sativa L.). Theor. Appl. Genet., 2002, 104: 981-986 (doi: 10.1007/s00122-002-0872-x).
- Roberts E.H. Storage environment and the control of viability. In: Viability of seeds /E.H. Roberts (ed.). Chapman and Hall, London, UK, 1972: 14-58 (doi: 10.1007/978-94-009-5685-8_2).
- Priestley D.A. Seed aging. Implications for seed storage and persistence in the soil. Ithaca, Cornell University Press, 1986.
- Bailly C. Active oxygen species and antioxidants in seed biology. Seed Science Research, 2004, 14: 93-107 (doi: 10.1079/SSR2004159).
- El-Maarouf-Bouteau H., Mazuy C., Corbineau F., Bailly C. DNA alteration and programmed cell death during ageing of sunflower seed. Journal of Experimental Botany, 2011, 62(14): 5003-5011 (doi: 10.1093/jxb/err198).
- Murthy U.N., Kumar P.P., Sun W.Q. Mechanisms of seed ageing under different storage conditions for Vigna radiata (L.) Wilczek: lipid peroxidation, sugar hydrolysis, Maillard reactions and their relationship to glass state transition. Journal of Experimental Botany, 2003, 54(384): 1057-1067 (doi: 10.1093/jxb/erg092).
- Waterworth W.M., Bray C.M., West C.E. The importance of safeguarding genome integrity in germination and seed longevity. Journal of Experimental Botany, 2015, 66(12): 3549-3558 (doi: 10.1093/jxb/erv080).
- Burgess R.W., Powell A.A. Evidence for repair processes in the invigoration of seed by hydration. Annals of Botany, 1984, 53(5): 753-757 (doi: 10.1093/oxfordjournals.aob.a086741).
- Elder R., Osborne D. Function of DNA synthesis and DNA repair in the survival of embryos during early germination and in dormancy. SeedScienceResearch, 1993, 3: 43-53 (doi: 10.1017/S0960258500001550).
- Сафина Г.Ф., Филипенко Г.И. Долговечность семян при хранении и ее прогнозирование методом ускоренного старения. Труды по прикладной ботанике, 2013, 174: 123-130.
- Алексейчук Г.Н., Ламан Н.А. Физиологическое качество семян и методы его оценки /Под ред. С.И. Гриба. Минск, 2005.
- Ермаков А.И. Методы биохимического исследования растений. Л., 1987.
- Лебедева О.В., Угарова Н.Н., Березин И.В. Кинетическое изучение реакции окисления о-дианизидииа перекисью водорода в присутствии пероксидазы из хрена. Биохимия, 1977, 42: 1372-1379.
- Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. М., 1972.
- Gichner T., Patkova Z., Szakova J., Demnerova K. Cadmium induces DNA damage in tobacco roots, but no DNA damage, somatic mutations or homologous recombination in tobacco leaves. Mutation Research, 2004, 559: 49-57 (doi: 10.1016/j.mrgentox.2003.12.008).
- Tice R.R., Agurell E., Anderson D., Burlinson B., Hartmann A., Kobayashi H., Miyamae Y., Rojas E., Ryu J.-C., Sasaki Y.F. Single cell gel/Comet assay: guidelines for in vitro and in vivo genetic toxicology testing. Environmental and Molecular Mutagenesis, 2000, 35: 206-221 (doi: 10.1002/(SICI)1098-2280(2000)35:3<206::AID-EM8>3.0.CO;2-J).
- Жанатаев А.К., Никитина В.А., Воронина Е.С., Дурнев А.Д. Методические аспекты оценки ДНК-повреждений методом ДНК-комет. Прикладная токсикология, 2011, 2(4): 28-37.
- Sisman С., Delibas L. Storing sunflower seed and quality losses during storage. Journal of Central European Agriculture, 2004, 4: 239-250 (doi: 10.2298/hel0542115c).
- Mohammadi H., Soltani A., Sadeghipour H.R., Zeinali E. Effects of seed aging on subsequent seed reserve utilization and seedling growth in soybean. International Journal of Plant Production, 2011, 5(1): 65-70 (doi: 10.22069/IJPP.2012.720).
- McDonald M.B. Seed deterioration: physiology, repair and assessment. Seed Science and Technology, 1999, 27: 177-237.
- Аvila M.R., Braccini A.L., Souza C.G.M., Mandarino J.M., Bazo G. L., Cabral Y.C.F. Physiological quality, content and activity of antioxidants in soybean seeds artificially aged. Revista Brasileira de Sementes, 2012, 34(3): 397-407 (doi: 10.1590/S0101-31222012000300006).
- Morohashi Y. Peroxidase activity develops in the micropylar endosperm of tomato seeds prior to radicle protrusion. Journal of Experimental Botany, 2002, 53: 1643-1650 (doi: 10.93/jxb/erf012).
- Passardi F., Penel C., Dunand Ch. Performing the paradoxical: how plant peroxidases modify the cell wall. Trends in Plant Science, 2004, 9(11): 534-540 (doi: 10.1016/j.tplants.2004.09.002).
- Olive P.L., Banath J.P. Sizing highly fragmented DNA in individual apoptotic cells using the comet assay and a DNA crosslinking agent. Experimental Cell Research, 1995, 221(1): 19-26 (doi: 10.1006/excr.1995.1348).
- Yasuhara S., Zhu Y., Matsui T., Tipirneni N., Yasuhara Y., Kaneki M., Rosenzweig A., Martyn J.A. Comparison of comet assay, electron microscopy, and flow cytometry for detection of apoptosis. Journal Histochem. Cytochem., 2003, 51(7): 873-885 (doi: 10.1177/002215540305100703).
- Жанатаев А.К., Анисина Е.А., Чайка З.В., Мирошкина И.А., Дурнев А.Д. Феномен атипичных ДНК-комет. Цитология, 2017, 59(3): 163-168.
- Rundell M., Wagner E., Plewa M. The comet assay: genotoxic damage or nuclear fragmentation? Environmental and Molecular Mutagenesis, 2003, 42: 61-67 (doi: 10.1002/em.10175).
- Lorenzo Y., Costa S., Collins A., Azqueta A. The comet assay, DNA damage, DNA repair and cytotoxicity: hedgehogs are not always dead. Mutagenesis, 2013, 28: 427-432 (doi: 10.1093/mutage/get018).