УДК 631.46:579.64:581.557:577.15
АЦК ДЕАМИНАЗА И РАСТИТЕЛЬНО-МИКРОБНЫЕ ВЗАИМОДЕЙСТВИЯ (обзор)
А.А. БЕЛИМОВ, В.И. САФРОНОВА
Приведены результаты изучения симбиотрофных бактерий, содержащих фермент 1-аминоциклопро-пан-1-карбоксилат (АЦК) деаминазу, благодаря которому бактерии снижают образование фитогормона этилена и стимулируют рост растений. Обсуждаются механизмы действия АЦК-утилизирующих бактерий на растения, биоразнообразие АЦК-утилизирующих бактерий, а также характеристика фермента и генов АЦК деаминазы. Особое внимание уделено роли рассматриваемого растительно-микробного взаимодействия в устойчивости растений к абиотическим стрессам и образовании бобово-ризобиального симбиоза.
Ключевые слова: бактерии, биопрепараты, инокуляция, клубенькообразование, ризосфера, симбиоз, стимуляция роста, стресс, фитогормоны, этилен.
Продукция фитогормонов, витаминов и других биологически активных веществ — один из важнейших механизмов воздействия ассоциативных бактерий на растения (1). Значительное внимание уделяется роли бактериальных ауксинов в стимуляции роста и питания растений, накоплены данные о продукции бактериями цитокининов и гиббереллинов. Однако исследования изменений гормонального статуса растений под действием ростстимулирующих бактерий и их способности деградировать фитогормоны малочисленны (2).
Важным вкладом в изучение модуляции гормонального статуса растений при симбиозе с бактериями стало раскрытие механизма регуляции роста макросимбионта с участием бактериального фермента 1-аминоциклопропан-1-карбоксилат (АЦК) деаминазы. У растений аминокислота АЦК окисляется АЦК оксидазой до этилена с образованием углекислого газа, циановой кислоты и воды, то есть служит непосредственным предшественником при биосинтезе фитогормона этилена. Этилен вовлечен во многие звенья процессов роста и развития растений, включая прорастание семян, инициацию и удлинение тканей и органов, цветение, созревание плодов, старение тканей и реакции на стрессовые факторы (3). Активизация биосинтеза АЦК и этилена — неспецифическая реакция растений на различные стрессы, в которых последний действует как негативный регулятор ростовых процессов. Однако ингибирование роста растения этиленом часто происходит и в отсутствие стресса, например при аккумуляции этилена в зоне корня из-за замедленной диффузии, повышении его содержания в почве за счет микробного биосинтеза или высокой чувствительности к этилену некоторых видов растений.
М е х а н и з м д е й с т в и я А Ц К - у т и л и з и р у ю щ и х б а к т е р и й
н а р а с т е н и я. Способность ризосферных бактерий стимулировать рост корней благодаря наличию АЦК деаминазы впервые описали с использованием проростков рапса и штамма Ps. putida GR12-2 (4). Доказательством служило отсутствие эффекта у дефектных по этому ферменту мутантов (4, 5) и его восстановление при обработке аминоэтоксивинилглицином — химическим ингибитором растительной АЦК синтазы (6). В результате была предложена модель этого растительно-бактериального взаимодействия (7) (рис. 1). Известно, что аминокислота АЦК входит в состав корневых экссудатов и растение поддерживает ее баланс внутри и вне тканей (в ризосфере ее количество может достигать нескольких микромолей) (8). Симбиотрофные бактерии используют АЦК как источник азотного и углеродного питания. Для поддержания равновесия концентраций растение увеличивает отток АЦК из корней в ризосферу, что приводит к снижению интенсивности биосинтеза этилена в корнях и его ингибирующего действия на растение.
Фитогормон индолилуксусную кислоту (ИУК), усиливающую рост растения, продуцируют многие АЦК-утилизирующие бактерии. Сообщается, что ИУК стимулирует АЦК синтазу (9), но ингибирует АЦК оксидазу (10). Поэтому под действием бактериальной ИУК растение синтезирует больше АЦК, используемой бактериями, которые таким образом обеспечивают себя уникальным источником питания в ризосфере и, возможно, повышают конкурентоспособность. Мутант Ps. putida GR12-2, не выделяющий ИУК, стимулировал рост корней рапса слабее, чем дикий тип (11), а суперпродуцент ИУК ингибировал рост (вероятно, за счет активации АЦК синтазы и усиления биосинтеза этилена) (12).
Анализ кинетики транспорта АЦК в ризосферу и конкуренции за субстрат между бактериальной АЦК деаминазой и растительной АЦК оксидазой показал, что АЦК интенсивно потребляется бактериями при относительно высокой скорости переноса АЦК из корня в ризосферу и быстрой индукции АЦК деаминазы у бактерий (1). Снижение количества АЦК в корнях регистрировали при инокуляции рапса штаммами Ps. putida GR12-2 и Enterobacteraerogenes CAL3, Ps. putida ATCC17399 со встроенным геном АЦК деаминазы (11), Methylobacterium fujisawaense CBMB20 и CBMB110 (13), а также при инокуляции гороха штаммом V. paradoxus 5C-2 (14). Снижение продукции этилена у растений показано на
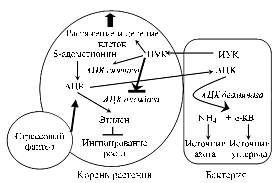 |
Рис. 1. Схема взаимодействия растения с бактериями, содержащими 1-аминоциклопропан-1-карбоксилат (АЦК) деаминазу: ИУК — индолилуксусная кислота; a-КВ — a-кетобутират (цит. по 7, изменения разрешены авторами). |
рапсе при инокуляции Serraciaqui-nivorans SUD165 (15), Achromobacter xylosoxidans Cm4 и Pseudomonas sp. Dp2 (16), M. fujisawaense CBMB20 и CBMB110 (13), а также на томатах, инокулированных Ps. putida UW4, Pseudomonas sp. CAL2 (17) и Achromobacter piechaudii ARV8 (18, 19). Недавно обнаружено, что при инокуляции активность АЦК синтазы в корнях повышается (видимо, благодаря эффекту бактериальной ИУК), а АЦК оксидазы — снижается (вероятно, из-за уменьшения концентрации субстрата) (13). Обработка ИУК ингибировала АЦК оксидазу (10). При изучении метаболизма АЦК у бактерий и участия АЦК в растительно-бактериальном взаимодействии мы установили способность V. paradoxus утилизировать не только аммоний, образующийся из АЦК, но и a-кетобутират как единственный источник С (20).
Роль АЦК деаминазы в стимуляции роста растений убедительно подтвердилась при переносе гена АЦК деаминазы Ps. putida UW4 в лишенные этого фермента штаммы. Трансформант штамма Ps. fluorescens CHA0 приобретал способность удлинять корни проростков у рапса (21), а трансформант штамма Ps. asplenii AC в большей степени стимулировал прорастание семян у тростника (22). Инокуляция томатов трансформантом Ps.putida ATCC17399 снижала продукцию этилена и улучшала рост растений (17), а экспрессия АЦК деаминазы в азотфиксаторе Azospirillum brasilense Cd повышала его стимулирующую активность в 2 раза (23).
Показано (24), что Ps. putida UW4, но не его мутант по АЦК деаминазе, усиливал экспрессию генов некоторых позитивно-регуляторных белков, участвующих в растяжении и делении клеток и индукции защитных реакций у растений рапса. Мы также установили, что у фитопатогена Ps. brassicacearum Am3 АЦК деаминаза маскирует токсический эффект бактерии, снижая биосинтез этилена (как известно, ключевой сигнальной молекулы в индукции системной устойчивости к фитопатогенам) (25). Интересно, что многие АЦК-утилизирующие бактерии относятся к роду Pseudomonas, представители которого — типичные индукторы системной устойчивости у растений. Однако роль АЦК деаминазы в фитопатогенезе и вопрос о локальном (на корни) или системном действии бактерий на статус АЦК и этилена в растении нуждаются в более детальном изучении (14).
Р а с п р о с т р а н е н и е А Ц К д е а м и н а з ы у м и к р о о р г а н и з м о в. Впервые АЦК деаминазу выявили и изучили у Pseudomonas sp. ACP и дрожжей Hansenula saturnus, которые расщепляли АЦК до аммония и a-кетобутирата (26). Для выделения АЦК-утилизирующих бактерий используют селективные среды с АЦК (20). Ген АЦК деаминазы (acdS) эффективно обнаруживается с помощью ПЦР (27, 28), в частности он найден у некоторых представителей рода Azospirillum (28). Способность использовать АЦК как единственный источник азота показана у 60 из 87 штаммов биоконтрольных псевдомонад (21) и у 81 из 103 ризосферных штаммов коллекции ARC Infruitec (ЮАР) (29).
При выделении новых штаммов ассоциативных бактерий у них часто определяют АЦК-деаминазную активность наряду с другими полезными для растений свойствами. Доля ризосферных изолятов с АЦК-деаминазной активностью составила для дикой горчицы25 % (30), для смеси различных злаков 45 % (3), для сои — 32 % (32), для ладанника — 7 % (33), для китайской капусты — 50 % (34), для гороха — 28 % (35), для горчицы сарептской — 26 % (20). Эти результаты убедительно показывают, что АЦК-деаминазной активностью обладают многие ассоциативные бактерии, и их число быстро растет. Основная часть идентифицированных в настоящее время штаммов с АЦК деаминазой (всего 111, отнесены к 36 родам из различных таксономических групп) приведена в работе А.А. Белимова (36). Наибольшее видовое разнообразие наблюдалось у родов Pseudomonas, Burkholderia и Bacillus (соответственно 14, 8 и 6 видов). АЦК-утилизирующие бактерии были обнаружены в почве и в ризосфере, филлосфере и эндосфере многих растений из разных регионов планеты. Эти бактерии могут относиться как к сапрофитным микроорганизмам, так и к патогенам растений, животных и человека. Возможен горизонтальный транспорт acdS генов в природных условиях (27). На это косвенно указывает частая локализация гена на плазмидах (28) и его обнаружение у все новых штаммов и видов.
Х а р а к т е р и с т и к а ф е р м е н т а и г е н о в А Ц К д е а м и н а з ы. Фермент был впервые выделен и охарактеризован у штамма Pseudomonas sp. ACP (26), затем у Pseudomonas sp. 6G5 (37), Ps. putida GR12-2 (38) и Ps. putida UW4 (24). Биохимические характеристики и структура фермента и генов, а также механизм деаминирования АЦК детально изучены (39). Установлено, что АЦК деаминаза относится к обширной группе ферментов, которые нуждаются в пиридоксаль-5-фосфате (ПЛФ, одна из форм витамина В6) в качестве кофактора. По пространственной структуре АЦК деаминаза принадлежит к типу триптофансинтаз (TRPSb) и представляет собой тример с молекулярной массой 105-112 кДа.
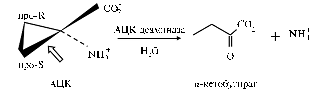 |
Рис. 2. Схема деаминирования 1-аминоциклопропан-1-карбоксилата (АЦК) АЦК деаминазой: контурной стрелкой показано место разрыва циклопропанового кольца (цит. по 7, изменения разрешены авторами). |
Предполагаемый механизм реакции заключается в деаминировании АЦК с разрывом циклопропанового кольца между α- и про-S-атомами С с образованием аммония и сохранением карбоксильной группы на С-остатке (α-кетобутират) (рис. 2). Кроме АЦК, субстратами для АЦК деаминазы служит аланин, норлейцин, серин, винил-АЦК, ацетил-D-серин, производные аминомасляной кислоты, а также 1-амино-2-метиленцикло-пропан-1-карбоновая кислота. Пик активности АЦК деаминазы наблюдается при рН 8,0-8,5 и 30 °С. При оптимальных условиях величина Km не превышает 1,5 ммоль АЦК, что указывает на относительно низкое сродство фермента к этому субстрату. Ферментативная активность зарегистрирована только в цитоплазме клеток.
Ген АЦК-деаминазы впервые клонировали у штамма Pseudomonas sp. ACP (40), затем у ряда других бактерий. Нуклеотидные последовательности этих генов (1014 п.н.) имели значительное сходство (85-95 %) и кодировали белок с молекулярной массой около 36,8 кДа. Известны последовательности acdS генов более чем у 50 штаммов из различных таксономических групп (36, 28).
А н т и с т р е с с о в ы й э ф ф е к т А Ц К - у т и л и з и р у ю щ и х б а к т е р и й
н а р а с т е н и я. Снижая биосинтез фитогормона этилена, АЦК-утилизирующие бактерии могут обладать универсальным антистрессовым эффектом на растения. Имеются сообщения о защитном действии таких бактерий при дефиците или избытке почвенной влаги. Инокуляция штаммом Achromobacter piechaudii ARV8 существенно стимулировала рост у перца и томатов и снижала содержание этилена, который интенсивно вырабатывался в растительных тканях в ответ на действие засухи (18). При возобновлении полива рост у инокулированных растений восстанавливался быстрее, чем в контроле. Выращенные в условиях дефицита влаги растения гороха при инокуляции V. paradoxus 5C-2 превосходили контрольные по длине и массе корней, числу азотфиксирующих клубеньков, массе семян и накоплению азота (14). Бактерии подавляли повышение концентрации АЦК, но увеличивали концентрацию абсцизовой кислоты в ксилемном соке подверженных засухе растений, что указывало на системное действие V. paradoxus 5C-2 и регуляцию транспорта сигнальных молекул из корня в побег (14). При этом растения формировали дополнительные побеги, затеняющие почву вокруг растений и снижающие потерю почвенной влаги при испарении. В описанных экспериментах, а также на картофеле (41) и томатах (36) бактерии повышали эффективность использования воды растениями, рассчитанную как отношение фитомассы к количеству транспирированной воды. В то же время мутант V. paradoxus 5С-2M4 с низкой АЦК деаминазной активностью не повлиял на рост, физиологию и водный статус растений (14). Было также установлено, что бактерии стимулируют удлинение корневых волосков (36), улучшающих водное питание. Важно отметить, что АЦК-утилизирующие бактерии повышают адаптацию растений не только к засухе, но и к переувлажнению: такой эффект был описан при инокуляции рапса штаммом Ps. putida UW4 (17).
При осмотическом стрессе на фоне высоких концентраций NaCl снижение биосинтеза этилена под действием A. piechaudii ARV8 сопровождалось повышением эффективности использования растениями воды, К и Р (19). Рост устойчивости к соли обнаружен у рапса при инокуляции Ps.putida UW4, но не его дефектным по АЦК деаминазе мутантом (42). При испытании флуоресцирующих псевдомонад в полевых условиях на засоленной почве повышение урожая арахиса получили только при инокуляции АЦК-ути-лизируюшими штаммами (43).
Знания о взаимодействии таких бактерий с растениями в зависимости от температуры среды фрагментарны. Показана способность Ps. putida GR12-2, но не дефектного по АЦК деаминазе мутанта, повышать экспрессию генов теплового шока (24) и стимулировать рост растений при пониженных температурах (5).
Представляется перспективным применение содержащих АЦК деаминазу бактерий для снижения токсического эффекта тяжелых металлов (ТМ) и фиторемедиации загрязненных почв (5, 44, 45). Так, инокуляция штаммом Serratia quinivorans SUD165 уменьшала токсичность Ni и образование стрессового этилена у рапса (15). Похожие результаты получены с устойчивым к Ni штаммом Ps. putida HS-2 (46). Стимуляцию роста и накопления ТМ наблюдали при инокуляции томатов штаммами Methylobacterium orysae CBMB20 и Burkholderia sp. CBMB40 (47), а также кукурузы и томатов штаммом Burkholderia sp. J62 (48), что хорошо согласуется с нашими данными по инокуляции рапса (35), гороха (49) и некоторых пастбищных бобовых растений (50) АЦК-утилизирующими бактериями из различных таксономических групп. Как правило, на содержание ТМ в растениях бактерии существенно не влияли, но улучшали потребление элементов минерального питания, нарушенное ТМ. Однако эти эффекты могут быть связаны не с АЦК-деаминазной активностью, а с другими свойствами микроорганизмов (49).
Р о л ь А Ц К д е а м и н а з ы в о б р а з о в а н и и б о б о в о - р и з о б и-
а л ь н о г о с и м б и о з а. Поскольку повышение содержания этилена препятствует образованию азотфиксирующего симбиоза бобовых с ризобиями (51), важное значение имеет обнаружение АЦК деаминазы у клубеньковых бактерий Mesorhizobium loti (52), Rhizobium sp. и Sinorhizobium sp. (53), а также R. leguminosarum bv. viciae и R. hedysari (54). Методом ПЦР ген acdS был обнаружен у 35 из 49 штаммов R. leguminosarum bv.viciae,S. melilotiи Mesorhizobium sp. из Всероссийской коллекции сельскохозяйственных микроорганизмов (г. Санкт-Петербург) (55). Более детальные исследования выявили у дефектных по АЦК деаминазе мутантов R. leguminosarum bv. viciae снижение способности образовывать клубеньки (56). Трансформация S. meliloti геном acdS ее повышала (57). Аналогичные результаты получены с дефектным по АЦК деаминазе мутантом M. loti MAFF303099 (58). Позднее эти наблюдения подтвердил перенос дополнительного acdS гена из Rhizobium sp. в АЦК-утилизирующий штамм Sinorhizobium sp., у которого при этом усилилось клубенькообразование (53). О регуляции клубеньковыми бактериями содержания этилена при инфицировании корней свидетельствуют также продукция ризобиотоксина (аналог химического ингибитора АЦК синтазы аминоэтоксивинилглицина) штаммами Bradyrhizobium elkanii и их повышенная способность формировать клубеньки (59). Поэтому продукция ризобиотоксина и АЦК деаминазная активность у ризобий рассматриваются как элементы стратегии эффективной колонизации растения-хозяина (60). Экспрессия acdS гена у M. loti MAFF303099 происходила только в зрелых клубеньках при участии регуляторного гена азотфиксации nifA2, указывая на важную роль этого фермента не только в образовании, но и в функционировании клубенька (61).
Роль ассоциативных АЦК-утилизирующих бактерий в образовании бобово-ризоби-ального симбиоза изучена недостаточно, хотя неоднократно наблюдалось повышение эффективности клубенькообразования при совместной инокуляции ризобиями и ассоциативными бактериями, способность утилизировать АЦК у которых не изучалась. Впервые стимуляция клубенькообразования такими бактериями была описана в опытах с соей, однако роль АЦК деаминазы осталась неизвестной из-за отсутствия эффекта у некоторых штаммов (62). Затем появилось сообщение об увеличении числа клубеньков у арахиса при инокуляции АЦК-утилизирующими псевдомонадами (63), однако эффект, вероятно, был связан с продуцированием ИУК и сидерофоров, мобилизацией фосфатов и антагонизмом к фитопатогенным грибам.Существенное повышение числа клубеньков, улучшение роста и питания растений вызывала инокуляция мунго штаммами Ps. putida и Ps. fluorescens (64), а также пастбищных бобовых (Lotusedulis, L.ornithopodioides) штаммом V. paradoxus 5C-2 (50).
Таким образом, 1-аминоциклопропан-1-карбоксилат (АЦК) деаминаза широко распространена у симбиотрофных бактерий. АЦК-утилизирующие бактерии снижают ингибирование роста растений этиленом, синтезируемым при абиотических и биотических стрессах, часто присутствуют на корнях растений и могут быть важным элементом растительно-микробных систем, особенно в условиях стрессов. Поэтому их следует считать перспективным компонентом нового типа бактериальных биопрепаратов со специфическим антистрессовым эффектом.
Л И Т Е Р А Т У Р А
1. F r a n k e n b e r g e r W.T., A r s h a d M. Phytohormones in soils: production and function. Marcel Dekker, Inc. N.Y., 1995.
2. D o d d I.C., Z i n o v k i n a N.Y., S a f r o n o v a V.I. e.a. Rhizobacterial mediation of plant hormone status. Ann. Appl. Biol., 2010, 157: 361-379.
3. A b e l e s F.B., M o r g a n P.W., S a l t v e i t M.E. Ethylene in plant biology. Academic Press. N.Y., 1992.
4. G l i c k B.R., J a c o b s o n C.B., S c h w a r z e M.M.K. e.a. 1-aminocyclopropane-1-carboxylic acid deaminase mutants of the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 do not stimulate canola root elongation. Canadian J. Microbiol., 1994, 40: 911-915.
5. G l i c k B.R., L i u C., G h o s h S. e.a.. Early development of canola seedlings in the presence of the plant growth-promoting rhizobacterium Pseudomonas putida GR12-2. Soil Biology and Biochemistry, 1997, 29: 1233-1239.
6. H a l l J.A., P e i r s o n D., G h o s h S. e.a. Root elongation in various agronomic crops by the plant growth promoting rhizobacterium Pseudomonas putida GR12-2. Isr. J. Plant Sci., 1996, 44, 37-42.
7. G l i c k B.R., P e n r o s e D.M., L i J. A model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria. J. Theor. Biol., 1998, 190: 63-68.
8. P e n r o s e D.M., G l i c k B.R. Levels of 1-aminocyclopropane-1-carboxylic acid (ACC) in exudates and extracts of canola seeds treated with plant growth-promoting bacteria. Canadian J. Microbiol., 2001, 47: 368-372.
9. K e n d e H. Ethylene biosynthesis. Annu. Rev. Plant Physiol., 1993, 44: 283-307.
10. M a d h a i y a n M., P o o n g u z h a l i S., S a T. Characterization of 1-aminocyclopropane-1-carboxylate (ACC) deaminase containing Methylobacterium orysae and interactions with auxins and ACC regulation of ethylene in canola (Brassica campestris). Planta, 2007, 226: 867-876.
11. P a t t e n C.L., G l i c k B.R. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system. Appl. Environ. Microbiol., 2002, 68: 3795-3801.
12. X i e H., P a s t e r n a k J.J., G l i c k B.R. Isolation and characterization of mutants of the plant growth promoting rhizobacterium Pseudomonas putida GR12-2 that overproduce indoleacetic acid. Curr. Microbiol., 1996, 32: 67-71.
13. M a d h a i y a n M., P o o n g u z h a l i S., R y u J. e.a. Regulation of ethylene levels in canola (Brassica campestris) by 1-aminocyclopropane-1-carboxylate deaminase-containing Methylobacterium fujisawaense. Planta, 2006, 224: 268-278.
14. B e l i m o v A.A., D o d d I.C., H o n t z e a s N. e.a. Rhizosphere bacteria containing ACC deaminase increase yield of plants grown in drying soil via both local and systemic hormone signalling. New Phytologist, 2009, 181: 413-423.
15. B u r d G.I., D i x o n D.G., G l i c k B.R. A plant growth promoting bacterium that decreases nickel toxicity in plant seedlings. Appl. Environ. Microbiol., 1998, 64: 3663-3668.
16. B e l i m o v A.A., S a f r o n o v a V.I., M i m u r a T. Response of spring rape to inoculation with plant growth-promoting rhizobacteria containing 1-aminocyclopropane-1-carboxylate deaminase depends on nutrient status of the plant. Canadian J. Microbiol., 2002, 48: 189-199.
17. G r i c h k o V.P., G l i c k B.R. Amelioration of flooding stress by ACC deaminase-containing plant growth-promoting bacteria. Plant Physiol. Biochem., 2001, 39: 11-17.
18. M a y a k S., T i r o s h T., G l i c k B.R. Plant growth-promotion bacteria that confer resistance to water stress in tomatoes and peppers. Plant Sci., 2004, 166: 525-530.
19. M a y a k S., T i r o s h T., G l i c k B.R. Plant growth-promoting bacteria that confer resistance in tomato to salt stress. Plant Physiol. Biochem., 2004, 42: 565-572.
20. B e l i m o v A.A., H o n t z e a s N., S a f r o n o v a V.I. e.a. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.). Soil Biol. Biochem., 2005, 37: 241-250.
21. W a n g C., R a m e t t e A., P u n j a s a m a r n w o n g P. e.a. Cosmopolitan distribution of phlD-containing dicotyledonous crop-associated biocontrol pseudomonads of worldwide origin. FEMS Microbiol. Ecol., 2001, 37: 105-116.
22. R e e d M.L., W a r n e r B.G., G l i c k B.R. Plant growth-promoting bacteria facilitate the growth of the common reed Phragmites australis in the presence of copper or polycyclic aromatic hydrocarbons. Curr. Microbiol., 2005, 51: 425-429.
23. H o l g u i n G., G l i c k B.R. Transformation of Azospirillum brasilense Cd with an ACC deaminase gene from Enterobacter cloacae UW4 fused to the Tetr gene promoter improves its fitness and plant growth promoting ability. Microbial Ecology, 2003, 4: 122-133.
24. H o n t z e a s N., S a l e h S.S., G l i c k B.R. Changes in gene expression in canola roots induced by ACC-deaminase-containing plant-growth-promoting bacteria. MPMI, 2004, 17: 865-871.
25. B e l i m o v A.A., D o d d I.C., S a f r o n o v a V.I. e.a. Pseudomonas brassicacearum strain Am3 containing 1-aminocyclopropane-1-carboxylate deaminase can show both pathogenic and growth-promoting properties in its interaction with tomato. J. Exp. Bot., 2007, 58: 1485-1495.
26. H o n m a M., S h i m o m u r a T. Metabolism of 1-aminocyclopropane-1-carboxylic acid. Agric. Biol. Chem., 1978, 42: 1825-1831.
27. H o n t z e a s N., R i c h a r d s o n A.O., B e l i m o v A.A. e.a. Evidence for horizontal transfer of 1-aminocyclopropane-1-carboxylate deaminase genes. Appl. Environ. Microbiol., 2005, 71: 7556-7558.
28. B l a h a D., P r i g e n t - C o m b a r e t C., M i z r a M.S. e.a. Phylogeny of the 1-aminocyclopropane-1-carboxylic acid deaminase-encoding gene acdS in phytobeneficial and pathogenic Proteobacteria and relation with strain biogeography. FEMS Microbiol. Ecol., 2006, 56: 455-470.
29. C a m p b e l l B.G., T h o m s o n J.A. 1-aminocyclopropane-1-carboxylate deaminase genes from Pseudomonas strains. FEMS Microbiol. Lett., 1996, 138: 207-210.
30. I d r i s M., M e m o n G.H., V i n t h e r F.P. Occurrence of Azospirillum and Azotobacter and potential nitrogenase activity in danish agricultural soil under continuous barley cultivation. Acta Agrigulturae Scandinavica, 1981, 31: 433-437.
31. D e l l’ A m i c o E., C a v a l c a L., A n d r e o n i V. Analysis on rhizobacterial communities in perennial Graminaceae from polluted water meadow soil, and screening of metal-resistant, potentially plant growth-promoting bacteia. FEMS Microbiol. Ecol., 2005, 52: 153-162.
32. M i n a m i R., U c h i y a m a K., M u r a k a m i T. e.a. Properties, sequence, and synthesis in Escherichia coli of 1-aminocyclopropane-1-carboxylate deaminase from Hansenula saturnus. J. Biochem., 1998, 123: 1112-1118.
33. S o l a n o R.B., P e r e y r a d e l a I g l e s i a M.T., P r o b a n z a A. e.a. Sceeneng for PGPR to improve growth of Cistus ladanifer seedlings for reforestation of degraded Mediterranean ecosystems. Plant and Soil, 2006, 287: 59-68.
34. P o o n g u z h a l i S., M a d h a i y a n M., S a T. Cultivation-dependent characterization of rhizobacterial communities from field grown Chinese cabbage Brassica campestris ssp pekinensis and screening of traits for potential plant growth promotion. Plant and Soil, 2006, 286: 167-180.
35. B e l i m o v A.A., S a f r o n o v a V.I., S e r g e y e v a T.A. e.a. Characterisation of plant growth-promoting rhizobacteria isolated from polluted soils and containing 1-aminocyclopropane-1-carboxylate deaminase. Canadian J. Microbiol., 2001, 47: 642-652.
36. Б е л и м о в А.А. Взаимодействие ассоциативных бактерий и растений в зависимости от биотических и абиотических факторов. Автореф. докт. дис. СПб, 2008.
37. K l e e H.J., H a y f o r d M.B., K r e t z m e r K.A. e.a. Control of ethylene synthesis by expression of a bacterial enzyme in transgenic tomato plants. Plant Cell, 1991, 3: 1187-1193.
38. J a c o b s o n C.B., P a s t e r n a k J.J., G l i c k B.R. Partial purification and characterization of 1-aminocyclopropane-1-carboxylate deaminase from the plant growth promoting rhizobacterium Pseudomonasputida GR12-2. Canadian J. Microbiol., 1994, 40: 1019-1025.
39. H o n t z e a s N., H o n t z e a s C.E., G l i c k B.R. Reaction mechanisms of the bacterial enzyme 1-aminocyclopropane-1-carboxylate deaminase. Biotechnol. Adv., 2006, 24: 420-426.
40. S h e e h y R.E., H o n m a M., Y a m a d a M. e.a. Isolation, sequence, and expression in Escherichia coli of the Pseudomonas sp. strain ACP gene encoding 1-aminocyclopropane-1-carboxylate deaminase. J. Bacteriol., 1991, 173: 5260-5265.
41. B e l i m o v A.A., D o d d I.C., S a f r o n o v a V.I. e.a. ACC deaminase-containing rhizobacteria improve vegetative development and yield of potato plants grown under water-limited conditions. Aspect Appl. Biol., 2009, 98: 163-169.
42. C h e n g Z., P a r k E., G l i c k B.R. 1-Aminocyclopropane-1-carboxylate deaminase from Pseudomonas putida UW4 facilitates the growth of canola in the presence of salt. Canadian J. Microbiol., 2007, 53: 912-918.
43. S a r a v a n a k u m a r D., S a m i y a p p a n R. ACC deaminase from Pseudomonas fluorescens mediated saline in groundnut (Arachis hypogea) plants. J. Appl. Microbiol., 2007, 102: 1283-1292.
44. G l i c k B.R. Using soil bacteria for phytoremediation. Biotechnol. Adv., 2010, 28: 367-374.
45. A r s h a d M., H u s s a i n A., J a v e d M. e.a. Effect of soil applied L-methionine on growth, nodulation and chemical composition of Albizia lebbeck L. Plant and Soil, 1993, 148: 129-135.
46. F a r w e l l A.J., V e s e l y S., N e r o V. e.a. The use of transgenic canola (Brassica napus) and plant growth-promoting bacteria to enhance plant biomass at a nickel-contaminated field site. Plant and Soil, 2006, 288: 309-318.
47. M a d h a i y a n M., P o o n g u z h a l i S., S a T. Metal tolerating methylotrophic bacteria reduces nickel and cadmium toxicity and promotes plant growth of tomato (Lycopersicon esculentum L.). Chemosphere, 2007, 69: 220-228.
48. J i a n g C., S h e n g X., Q i a n M. e.a. Burkholderia sp. from heavy metal-contaminated paddy field soil and its potential in promoting plant growth and heavy metal accumulation in metal-polluted soil. Chemosphere, 2008, 2: 157-164.
49. S a f r o n o v a V.I., S t e p a n o k V.V., E n g q v i s t G.L. e.a. Root-associated bacteria containing 1-aminocyclopropane-1-carboxylate deaminase improve growth and nutrient uptake by pea genotypes cultivated in cadmium supplemented soil. Biol. Fertil. Soils, 2006, 42: 267-272.
50. B u l l i t t a S., S a f r o n o v a V., P i l u z z a G. e.a. Characterization of plant-microbe associations from a heavy metal polluted area in SW Sardinia in view of their use in phytoremediation. Abstr. Int. Conf. «Phytotechnologies in the 21st century: Remediation—Energy—Health—Sustainability». Parma, Italy, 2010: 147.
51. G u i n e l F.C., G e i l R.D. A model for the development of the rhizobial and arbuscular mycorrhizal symbioses in legumes and its use to understand the roles of ethylene in the establishment of these two symbioses. Canadian J. Bot., 2002, 80: 695-720.
52. K a n e k o T., N a k a m u r a Y., S a t o S. e.a. Complete genome structure of the nitrogen-fixing symbiotic bacterium Mesorhizobium loti. DNA Research, 2000, 7: 331-338.
53. T i t t a b u t r P., A w a y a J.D., L i Q.X. e.a. The cloned 1-aminocyclopropane-1-carboxylate (ACC) deamnase gene from Sinorhizobium sp. strain BL3 in Rhizobium sp. strain TAL1145 promotes nodulation and growth of Leucaena leucocephala. Syst. Appl. Microbiol., 2008, 31: 141-150.
54. M a W., S e b e s t i a n o v a S.B., S e b e s t i a n J. e.a. Prevalence of 1-aminocyclopropane-1-carboxylate deaminase in Rhizobium spp. Anthony van Leeuwenhoek, 2003, 83: 285-291.
55. Z i n o v k i n a N.Y., S a f r o n o v a V.I., C h i z h e v s k a y a E.P. e.a. Occurrence of 1-aminocyclopropane-1-carboxylate deaminase genes (acdS) in symbiotic nodule bacteria. Abstr. Int. Symp. «Adaptation to climate change in the Baltic Sea region: Contribution from plant and microbial biotechnology». Mikkeli, Finland, 2010: 52.
56. M a W., G u i n e l F.C., G l i c k B.R. Rhizobium leguminosarum biovar viciae 1-aminocyclo-propane-1-carboxylate deaminase promotes nodulation of pea plants. Appl. Environ. Microbiol., 2003, 69: 4396-4402.
57. M a W., C h a r l e s T.C., G l i c k B.R. Expression of an exogenous 1-aminocyclopropane-1-carboxylate deaminase gene in Sinorhizobium meliloti increases its ability to nodulate alfalfa. Appl. Environ. Microbiol., 2004, 70: 5891-5897.
58. U c h i u m i T., O h w a d a T., I t a k u r a M. e.a. Expression islands clustered on the symbiosis island of the Mesorhizobium loti genome. J. Bacteriol., 2004, 186: 2439-2448.
59. Y h a s h i K.I., I c h i k a w a N., E z u r a H. e.a. Rhizobitoxin production by Bradyrhizobium elkanii enhances nodulation and competitiveness on Macroptilium artropurpureum. Appl. Environ. Microbiol., 2000, 66: 2658-2663.
60. O k a z a k i S., N u k u i N., S u g a w a r a M. e.a. Rhizobial strategies to enhance symbiotic interactions: rhizobiotoxine and 1-aminocyclopropane-1-carboxylate deaminase. Microbes and Environment, 2004, 19: 99-111.
61. N u k u i N., M i n a m i s a w a K., A y a b e S.I. e.a. Expression of the 1-aminocyclopropane-1-carboxylic acid deaminase gene requires symbiotic nitrogen-fixing regulator gene nifA2 in Mesorhizobium loti MAFF303099. Appl. Environ. Microbiol., 2006, 72: 4964-4969.
62. C a t t e l a n A.J., H a r t e l P.G., F u h r m a n n J.J. Screening for plant growth-promoting rhizobacteria to promote early soybean growth. Soil Science Society of America Journal, 1999, 63: 1670-1680.
63. D e y R., P a l K.K., B h a t t D.M., C h a u h a n S.M. Growth promotion and yield enhancement of peanut (Arachis hypogaea L.) by application of plant growth-promoting rhizobacteria. Microbiol. Res., 2004, 159: 371-394.
64. S h a h a r o o n a B., A r s h a d M., Z a h i r Z.A. Effect of plant growth promoting rhizobacteria containing ACC-deaminase on maize (Zea mays L.) grown under axenic conditions and on nodulation in mung bean (Vigna radiata L.). Lett. Appl. Microbiol., 2006, 42: 155-159.
ACC DEAMINASE AND PLANT—BACTERIA INTERACTIONS (review)
A.A. Belimov, V.I. Safronova
The review presents results related to the study of symbiotrophic bacteria, containing enzyme 1-aminocyclopropane-1-carboxylate (ACC) deaminase, through which the bacteria reduce the formation of phytohormone ethylene and stimulate growth of plants. Mechanisms of the effects of ACC-utilizing bacteria on plants, biodiversity of ACC-utilizing bacteria and characteristics of the enzyme and ACC deaminase genes are discussed. Particular attention is paid to the role of such plant-microbe interaction in plant tolerance to abiotic stresses and formation of legume-Rhizobium symbiosis.
Keywords: bacterisation, microbial associations, rhizosphere, symbiosis, phytohormones.
ГНУ Всероссийский НИИ сельскохозяйственной |
Поступила в редакцию |













