УДК 632.954:636.46:574.34:575:577.2
АНАЛИЗ ПОЛИМОРФИЗМА ДЛИН РЕСТРИКЦИОННЫХ ФРАГМЕНТОВ ДНК ДЛЯ ИЗУЧЕНИЯ ДИНАМИКИ ПОЧВЕННЫХ МИКРОБНЫХ СООБЩЕСТВ В УСЛОВИЯХ ВОЗДЕЙСТВИЯ КСЕНОБИОТИКОВ
Е.В. ПЕРШИНА, Е.Е. АНДРОНОВ, А.Г. ПИНАЕВ, Г.А. АХТЕМОВА, В.А. ДУМОВА, Н.А. ПРОВОРОВ
Изучали возможность совместного использования методов ПДРФ (полиморфизм длин рестрикционных фрагментов) и АГК (анализ главных компонентов) для количественной оценки изменений в почвенном микробном сообществе, состоящем из бактерий, грибов и архей, при внесении ацетона и 2,4-дихлорфеноксиуксусной кислоты (2,4-Д). Вычисление индекса Шеннона показало, что при внесении ксенобиотиков разнообразие грибов возрастает, архей — незначительно снижается, бактерий — не изменяется. Впервые продемонстрировано, что применение метода АГК позволяет определить относительные скорости сукцессии в микробном сообществе, максимальные значения которых наблюдали для грибов.
Ключевые слова: микробное сообщество, полиморфизм длин рестрикционных фрагментов (ПДРФ), анализ главных компонентов (АГК), скорость сукцессии, ксенобиотики.
Почвенные микробные сообщества имеют сложную генетическую и пространственную организацию и относятся к одним из наиболее богатых по биоразнообразию. Их детальный анализ, который в настоящее время возможен в основном с использованием метода секвенирования генетических библиотек, представляет собой крайне трудоемкую задачу. Однако на практике часто требуется своевременно и четко выяснить, будет ли изменяться структура микробного сообщества в тех или иных условиях и какой характер носят эти изменения. В этом случае применяют экспресс-методы оценки биоразнообразия, в частности ПДРФ (полиморфизм длин рестрикционных фрагментов — terminal restriction fragment length polymorphism, T-RFLP) (1). Метод позволяет получить ДНК-профили фрагментов гена 16S-рРНК бактерий (или ITS-фрагментов для грибов), в которых структура микробного сообщества описывается с помощью двух параметров — длины терминального рестрикционного фрагмента маркерного гена (положение определенного пика на ПДРФ профиле) и доли этого фрагмента в суммарной ДНК (площадь под пиком). ПДРФ — один из немногих методов молекулярно-гене-тического анализа, которые могут быть использованы в широкомасштабных мониторинговых исследованиях. Не будучи трудоемким, он позволяет проводить комплексное изучение почвенной микробиоты с рассмотрением трех основных групп — бактерий, архей и грибов. Это крайне важно, поскольку такие основные характеристики почвы, как плодородие и «здоровье», не столько зависят от какого-то одного компонента сообщества, сколько представляют собой результат взаимодействия различных групп микроорганизмов. Несмотря на то, что метод ПДРФ уже давно используется для анализа микробного разнообразия, до сих пор нет единых подходов для обработки и интерпретации получаемых данных (2, 3). Так, открытым остается вопрос об определении таксономического положения микроорганизмов по результатам ПДРФ, поскольку разные виды могут иметь одинаковую локализацию сайтов рестрикции (4). Дополнительные трудности вносят некоторые технические особенности метода, в частности различная подвижность терминальных фрагментов ДНК в геле, связанная с соотношением в них пуриновых и пиримидиновых оснований (5).
Возможность использовать ПДРФ без присвоения пикам точных таксономических характеристик очень актуальна при изучении почвенной микробиоты, где число видов на 1 г почвы может достигать многих сотен (6). Для оценки данных необходимо применять методы многофакторного анализа, среди которых наибольшее распространение получил АГК (анализ главных компонентов) (7).
В настоящее время в сельскохозяйственной практике остро стоит проблема биоремедиации, связанная с загрязнением почв ксенобиотиками. Долгое время при ее решении размер и состав микробной популяции оценивали классическими методами культивирования микроорганизмов на питательных средах. При этом неоднократно подчеркивалось (8), что выявляемая таким образом численность микроорганизмов как минимум на порядок меньше определяемой при анализе почвенной ДНК.
Мы изучили возможность применения метода ПДРФ для оценки ксенобиотического воздействия на почвенное микробное сообщество на примере внесения в почву ацетона и гербицида 2,4-дихлорфеноксиуксусной кислоты (2,4-Д), сопоставив результаты обработки полученных данных с использованием традиционных (индексы разнообразия) и многофакторных (АГК) подходов. Отличительная особенность предпринятого исследования — его комплексность, а именно учет всех трех компонентов сообщества (бактерии, археи, грибы), что позволяет получить его полную характеристику.
Методика. Модельный опыт проводили на образцах дерново-подзолистой почвы лесной зоны (Ленинградская обл.). Почву отбирали из горизонта А1 на площади 10 м2 в 5 равноудаленных точках и просеивали через сито (3 мм) до однородной структуры. Опыт выполняли в 4 сосудах, содержащих по 2 кг почвы, влажность которой (60 % от полной влагоемкости) поддерживали в лабораторных условиях регулярным поливом. Контроль (1-й сосуд) содержал необработанную почву, 2-й сосуд — ту же почву с добавлением ацетона (2,5 мл на 1 кг влажной почвы), 3-й и 4-й — почву с внесенной 2,4-дихлорфенокси-уксусной кислотой (2,4-Д), растворенной в ацетоне (2,5 мл на 1 кг почвы), в количестве соответственно 50 и 250 мг/кг. Перед загрузкой почву перемешивали с вносимыми веществами в течение 10 мин. Сосуды закрывали бумагой и инкубировали при 20 °С в течение 2 мес. Пробы массой 1 г (по 3 независимые) отбирали из верхнего слоя (3-5 см) на равном расстоянии друг от друга и от стенок сосуда на 4-е, 7-е, 14-е, 21-е, 28-е и 60-е сут (следующие сутки после полива). Всего получили 72 образца, которые хранили при -70 °С.
ДНК выделяли независимо из 3 проб почвы (по 0,33 г каждая) в соответствии со стандартной методикой (9).
При получении библиотеки гена 16S-рРНК бактерий для ПЦР использовали 3 пары праймеров — fD1/rD1: 27f 5´-AGAGTTTGATCCTGGCTCAG-3´, 1525r 5´-AAGGAGG-TGATCCAGCC-3´ (10); fBD1/rBD1: 642f 5´-HAATHYGTGCCAGCAGC-3´, 1445r 5´-GTCRTCCYDCCTCCTC-3´ (11); Eu3*: 63f (WellRed) 5´-AGGCCTAACACATGCAAGTC-3´, 1494r 5´-TACGGYTACCTTGTTACGAC-3´ (12). ПЦР проводили по стандартной методике (9). ПЦР-фрагменты клонировали в векторе pAL-TA, полученными конструкциями трансформировали компетентные клетки Escherichiacoli (штамм DH10B). Нуклеотидную последовательность гена 16S-рРНК определяли с применением интернального праймера FGPS(485-292) 5´-CAGCAGCCGCGGTAA-3´ (13) в автоматическом секвенаторе SEQ8000 с использованием набора реагентов и прилагаемой к нему инструкции фирмы-произво-дителя «Beckman Coulter» (США). Микроорганизмы идентифицировали, применив приложение Naïve Classifier базы данных RDPII (http://rdp.cme.msu.edu/classifier/classifier.jsp).
Количественную ПЦР выполняли для трех групп исследуемых микроорганизмов (бактерий, архей и грибов) по стандартной методике (9). Для оценки динамики численности микроорганизмов осуществляли линейную аппроксимацию экспериментальных данных.
При анализе полиморфизма длин рестрикционных фрагментов (ПДРФ) использовали флуоресцентно меченные праймеры: для бактерий — Eu3*; для архей — Ar3f* 5´-TTCCGGTTGATCCTGCCGGA-3´, AR927r 5´-CCCGCCAATTCCTTTAAGTTTC-3´; для грибов — ITS1f* (WellRed) 5´-TCCGTAGGTGAACCTGCGG-3´, ITS4r 5´-TCCTCCGCT-TATTGATATGC-3´. Амплифицированный фрагмент (100-200 нг) обрабатывали эндонуклеазой HaeIII (амплификат контрольного почвенного образца разделяли на 4 части и обрабатывали эндонуклеазами HaeIII, RsaI, HpaII и MboI). Для разделения и анализа фрагментов ДНК использовали оборудование и реактивы фирмы «Beckman Coulter» (США). Пики, составляющие менее 1 % от их суммарной площади, не учитывали. Оставшиеся пики объединяли в типы с принятой в исследовании погрешностью (1,5 нуклеотида). Данные анализировали в программе PAST с помощью метода АГК. Для расчета площадей эллипсов пользовались формулой S = πAB, где А и В — длины полуосей. Площадь каждого эллипса на графиках представляли в единицах условного масштаба, затем вычисляли значения относительной площади по сравнению с контролем. ПДРФ-профили для эндонуклеаз HaeIII, RsaI, HpaII и MboI анализировали на соответствие полученных пиков предполагаемым таксономическим кандидатурам с помощью программы Fragment Sorter (FRAGSORT) (http://www.oardc.ohio-state.edu/trflpfragsort/index.php).
Для расчета индекса биоразнообразия Шеннона использовали следующую формулу: H = - Σ(ni/N) ln(ni/N), где ni— доля вида в сообществе, N — общее число видов.
Результаты. О п р е д е л е н и е о б щ е й ч и с л е н н о с т и
м и к р о о р г а
н и з м о в. Численность трех групп микроорганизмов как в контрольных, так и в опытных образцах не претерпевала существенных изменений в течение всего эксперимента. Основную долю в микробном сообществе, выраженную через число рибосомных оперонов на 1 г почвы (9), составляли бактерии (7,1x108), далее следовали археи (9,9x107), затем грибы (6,0x106). У архей разброс значений численности по повторностям опыта был больше, чем у бактерий и грибов.
П Д Р Ф - а н а л и з к о н т р о л ь н о г о о б р а з ц а д е р н о в о -
п о д
з о л и с т о й п о ч в ы. После секвенирования последовательностей гена 16S-рРНК бактерий из контрольного образца почвы их депонировали в базу данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) (всего 105 последовательностей, HQ412669-HQ412763). По результатам идентификации исследуемые нуклеотидные последовательности были отнесены к бактериальным филам Proteobacteria (32 %), Acidobacteria (26 %), Verrucomicrobia (7 %), Actinobacteria (4 %), Bacteroidetes (3 %), Planctomycetes (3 %), Chlamydiae (3 %) и Firmicutes (2 %). Известно, что увеличение числа используемых эндонуклеаз рестрикции повышает точность определения таксономической характеристики пиков в ПДРФ-профиле (14). В работах по изучению почвенных сообществ для идентификации микроорганизмов авторы рекомендуют использовать не менее трех частощепящих рестриктаз. Мы провели ПДРФ-анализ контрольного образца с использованием четырех эндонуклеаз (HaeIII, RsaI, HpaII и MboI), но при этом наличие большого числа таксономических кандидатур сохранялось практически у всех пиков в профиле. Так, при анализе одного из ПДРФ-профилей (получен с помощью эндонуклеазы HaeIII) (рис. 1) каждому пику оказались присвоены несколько предполагаемых таксономических кандидатур, в некоторых случаях исчисляемых десятками. Достаточно часто пику соответствовал набор кандидатур из неродственных бактериальных таксонов различного ранга. Например, для пиков 201 п.н. и 220 п.н. среди кандидатур встречались представители как филы Firmicutes, так и филы Actinobacteria (см. рис. 1). Необходимо отметить, что подобное характерно именно для почвенного сообщества, поскольку оно лидирует по числу видов микроорганизмов.
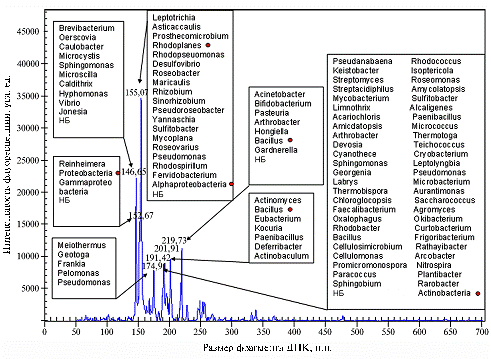 |
Рис. 1. ПДРФ-профиль, полученный с помощью эндонуклеазы HaeIII для микробного сообщества в образце почвы без ксенобиотиков. Предполагаемые таксономические кандидатуры для каждого пика объединены в группы; отмечены таксономические группы, которые были обнаружены при анализе библиотек гена 16S-рРНК (модельный опыт, описание см. в разделе «Методика»); НБ — некультивируемые бактерии. |
Сравнение ПДРФ-профиля с данными по секвенированию и идентификации клонированных последовательностей 16S-рРНК показало, что как среди кандидатур пиков, так и в составе генетических библиотек обнаруживаются последовательности представителей трех наиболее крупных бактериальных фил — Proteobacteria, Actinobacteria и Firmicutes. В библиотеке гена 16S-рРНК явно превалировали последовательности представителей порядка Rhizobiales, в том числе относящихся к роду Rhodoplanes. Кандидатуры этих микроорганизмов также присвоены доминантному пику на ПДРФ-профиле (см. рис. 1), а значит, именно они преобладают в анализируемом сообществе.
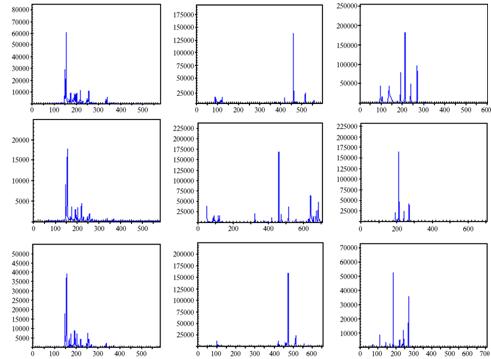
П Д Р Ф - а н а л и з д и н а м и к и п о ч в е н н о г о с о о б щ е с т в а. При суммарном анализе всех профилей ПДРФ было выделено 223 типа пиков, из которых 39 принадлежали бактериальному, 119 — грибному и 65 — археотному компонентам сообщества (приведены примеры их ПДРФ-профилей через 60 сут после начала эксперимента) (рис. 2).
Для бактериального сообщества профили ПДРФ в шести временных промежутках в контрольном образце оказались идентичными, в том числе по прошествии 2 мес опыта. Внесение в почву ацетона и 2,4-Д оказало минимальное воздействие на сообщество, что выражалось в появлении незначительного числа (не более 2 %) минорных пиков (см. рис. 2). В сообществе архей в контрольном образце через 1 нед после начала опыта из ПДРФ-профилей исчезла значительная часть пиков, но появились новые — 119,5 и 137,0 п.н. Доля первого оставалась постоянной, второго — постепенно увеличивалась и достигла максимума (11,88 %) через 2 мес. Кроме описанных качественных характеристик, изменялись и количественные. Так, на 4-е сут наибольшую долю в ПДРФ-про-филях (28,82 %) занимал пик с размером терминального фрагмента 269,5 п.н., спустя неделю после начала эксперимента его сменил пик 192,5 п.н., доля которого в профилях при этом возросла с 5,79 до 27,87 %. На 2-ю и 3-ю нед соотношение этих пиков на ПДРФ-профилях выравнялось и в среднем составило 23 % от общей площади пиков. В течение последующих 2 нед произошла еще одна смена доминирующих пиков, в частности пик размером 213,5 п.н. начал увеличиваться с 1-х сут и на 5-ю нед стал занимать лидирующее положение (25,80 %), и это соотношение трех доминирующих пиков сохранилось до окончания наблюдения. Сходные тенденции в изменении площадей трех доминирующих пиков отмечали и в остальных вариантах опыта. Как и для бактерий, для архей было характерно появление ряда минорных пиков на профилях ПДРФ, характеризующих влияние на сообщество ацетона и 2,4-Д.
А Б В |
|
Рис 2. ПДРФ-профили компонентов микробного сообщества почвы — бактерий (А), грибов (Б) и архей (В) в контроле (без ксенобиотиков, верхний ряд), при добавлении в почву ацетона (средний ряд) и ацетона с 2,4-дихлорфеноксиуксусной кислотой (250 мг/кг, нижний ряд) (60-е сут, модельный опыт, описание см. в разделе «Методика»). По оси абсцисс — размер фрагмента ДНК (п.н.), по оси ординат — интенсивность флуоресценции (усл. ед.). |
Наибольший эффект ксенобиотики оказали на грибной компонент сообщества. В контроле через 2 нед на ПДРФ-профилях наблюдалась смена пиков, в частности практически полностью исчезла группа с длинами терминальных фрагментов ДНК 50,5-122,5 п.н. и пик 512,5 п.н., однако через 2 мес исходный профиль восстановился. Воздействие ацетона, как и в предыдущих случаях, приводило к появлению пиков, доля которых не превышала 2,5 %. В ответ на внесение 2,4-Д, помимо изменений в составе профилей, значительно колебалось процентное соотношение между пиками. С начала эксперимента наблюдалось уменьшение доли абсолютного доминанта (460,5 п.н.) на фоне увеличивающегося количества фрагментов 474,5 и 476,5 п.н. Постепенно состав доминирующих групп пиков полностью сменился: если на 3-й нед эксперимента на них приходилось 15,17; 16,88 и 25,97 %, то к окончанию эксперимента значения изменились, составив соответственно 2,84; 13,80 и 39,75 %.
Таким образом, анализ ПДРФ-профилей показал, что реакция каждой группы микроорганизмов индивидуальна. У бактерий и архей внесение ацетона и его сочетание с 2,4-Д оказали сравнимое (в случае бактерий даже большее) воздействие на структуру микробного сообщества. Возможно, в этих сообществах есть группы, способные использовать ацетон в качестве субстрата, поскольку на фоне угнетения доминирующих форм временное преимущество получают минорные группы микроорганизмов. Интересен и тот факт, что наибольшие изменения в структуре бактериального сообщества вызвало не совместное действие двух абиотических факторов (ацетон и 2,4-Д), а наличие только ацетона. Известно, что многие почвенные бактерии способны разлагать 2,4-Д (15, 16). По-видимому, гербицид в исследуемой модельной системе утилизировался наравне с другими доступными субстратами при одновременном участии многих микроорганизмов и не вызвал существенных изменений в структуре сообщества. Тем не менее, даже таких малых изменений было достаточно для повышения устойчивости сообщества к ацетону. Самые сильные изменения происходили в структуре грибного сообщества. Причем (в отличие от бактерий и архей) на грибы основной эффект оказала совместная обработка почвы ацетоном и 2,4-Д, которая вызвала полную смену доминирующей группы. Столь существенные изменения могут быть обусловлены, с одной стороны, угнетающим действием 2,4-Д в отношении некоторых видов грибов, с другой — размножением микроорганизмов, способных к деградации ксенобиотика.
М а т е м а т и ч е с к о е о п и с а н и е с у к ц е с с и и
м и к р о б н о г о с о
о б щ е с т в а. Анализ общего разнообразия (индекс Шеннона, рис. 3) для всех исследуемых сообществ, а также результаты оценки общей численности микроорганизмов, полученные в количественной ПЦР, свидетельствуют об отсутствии существенных изменений в
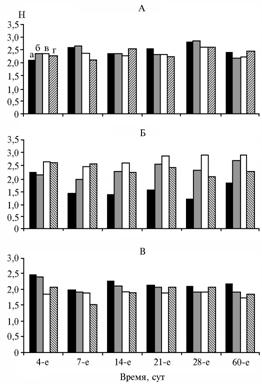 |
Рис. 3. Величины индекса Шеннона (Н) для трех исследуемых компонентов почвенного сообщества микроорганизмов: А, Б, В — соответственно бактерии, грибы, археи; а, б, в, г — контроль, внесение ацетона, внесение 2,4-дихлорфенок-сиуксусной кислоты (2,4-Д) в количестве 50 и 250 мг/кг почвы (модельный опыт). |
уровене биоразнообразия в бактериальном сообществе. Для грибного сообщества наблюдалось заметное повышение биоразнообразия при ксенобиотическом воздействии по сравнению с контрольным образцом (см. рис. 3). Противоположную закономерность отмечали для сообщества архей, где внесение ксенобиотиков вызывало некоторое понижение индекса Шеннона. Анализ дан-ных количественной ПЦР и индексов общего биоразнообразия позволяет предположить, что выраженные изменения в структуре грибного и археотного сообществ в сравнении с бактериальным сообществом связаны с их меньшей относительной численностью.
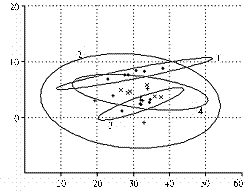
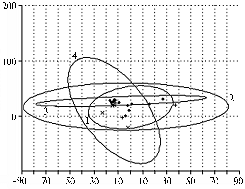
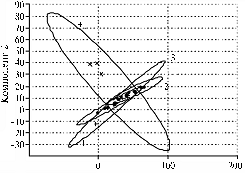
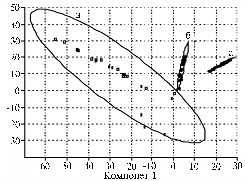
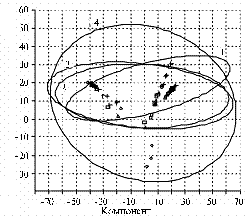
При использовании метода АГК (6, 17) для определения относительной скорости сукцессии бактериального, археотного и грибного сообществ матрицей служил список выявленных пиков и их долей в ПДРФ-профиле. На графиках АГК (рис. 4) можно наблюдать за развитием каждого из трех компонентов микробного сообщества как единой системы, последовательно меняющей координаты в математическом пространстве по точкам временной шкалы (на 4-е, 7-е, 14-е, 21-е, 28-е и 60-е сут эксперимента). Мы представляем (см. рис. 4) одну из двумерных проекций совокупности из 6 таких точек для трех исследуемых сообществ. Эллипсы отражают размах варьирования данных при 5 % уровне значимости. Площади эллипсов, характеризующих воздействие ацетона и 2,4-Д, соответствуют скорости сукцессии в исследуемых сообществах в ответ на стресс. В таблице приведены значения площади эллипсов, рассчитанные относительно величины для контрольных почвенных образцов.
| Относительная площадь эллипсов, характеризующих степень воздействия ксенобиотиков на три компонента микробного сообщества | |||||
Компонент сообщества |
Фактор воздействия |
||||
1 |
2 |
3 |
4 |
1 + 2 + 3 + 4 |
|
А |
1,0 |
9,8 |
0,7 |
2,5 |
1,0 |
Б |
1,0 |
2,7 |
0,4 |
2,2 |
4,6 |
В |
1,0 |
0,9 |
2,7 |
10,6 |
367,5 |
A + Б + В |
1,0 |
1,4 |
1,4 |
3,6 |
Не вычисляли |
П р и м е ч а н и е. Изображение и описание эллипсов см. на рисунке 4. A — бактерии, Б — археи, В — грибы; 1 — контроль, 2 — внесение ацетона, 3 — ацетон + 2,4-Д (2,4-дихлорфеноксиуксусная кислота, 50 мг/кг), 4 — ацетон + 2,4-Д (250 мг/кг). |
|||||
Для сравнения скорости сукцессии в трех исследуемых сообществах в течение опыта произвели расчет относительных площадей эллипсов, включающих все экспериментальные точки (см. рис. 4, г., табл.). При этом за единицу принимали площадь наименьшего из эллипсов.
Анализируя эти данные (см. табл., рис. 4), можно сделать вывод, что наибольшим изменениям подверглась структура грибного сообщества, причем основной вклад в изменения внес ответ грибного сообщества на добавление в почву ацетона и высокой дозы 2,4-Д. Изменения в структуре бактериального и археотного сообществ были выражены намного слабее. Показатели для бактериального сообщества (см. табл.) хорошо согласуются с результатами анализа ПДРФ-профилей и подтверждают, что скорость сукцессии сообщества при совместном внесении ксенобиотиков ниже таковой в случае избирательного действия ацетона. При этом она возрастает с увеличением количества доступного бактериям 2,4-Д. Для сообщества архей скорости сукцессии при внесении ацетона и ацетона совместно с высокой дозой 2,4-Д близки и значительно превышают значения для варианта с низкой дозой 2,4-Д. Интересно, что в этом случае имеет место компенсаторный эффект стрессовых факторов, то есть влияние ацетона может быть снижено внесением определенного количества 2,4-Д. Необходимо отметить, что приведенные результаты согласуются с изменениями индекса биоразнообразия Шеннона (см. рис. 3), то есть метод АГК может применяться в исследованиях по экологическому мониторингу.
А |
Б |
|
|
В |
Г |
|
|
Д |
|
|
Рис. 4. Графическое представление данных анализа главных компонентов (АГК) для трех компонентов микробного сообщества: А — бактерии, Б — археи, В — грибы, Г — совокупное действие стрессовых факторов на бактериальное (а), археотное (б) и грибное (в) сообщество; 1 — контроль, 2 — внесение ацетона, 3 — ацетон + 2,4-Д (2,4-дихлорфеноксиуксусная кислота, 50 мг/кг), 4 — ацетон + 2,4-Д (250 мг/кг). Сукцессия обозначается шестью точками, которые соответствуют структуре сообщества на 4-е, 7-е, 14-е, 21-е, 28-е и 60-е сут эксперимента и находятся внутри эллипсов. Итак, использование метода ПДРФ (полиморфизм длин рестрикционных фрагментов) совместно с АГК (анализ главных компонентов) позволяет проводить комплексные мониторинговые исследования сообществ микроорганизмов. Изучение динамики разных микробных сообществ в еди- |
ном многомерном математическом пространстве дает возможность ранжировать их по отношению к определенному абиотическому или биотическому агенту. В настоящей работе мы впервые показали, что в отличие от классического анализа с использованием индексов общего биоразнообразия метод АГК дает количественную оценку скорости сукцессии сообщества (по значениям относительной площади эллипсов, характеризующих размах варьирования экспериментальных данных). Особого внимания заслуживает неодинаковая степень воздействия абиотических факторов на исследуемые сообщества. Таким образом, молекулярная экология становится актуальным подходом для решения не только фундаментальных, но и сугубо практических задач.
Л И Т Е Р А Т У Р А
1. L u k o w T., D u n f i e l d P.F., L i e s a c k W. Use of the T-RFLP technique to assess spatial and temporal changes in the bacterial community structure within an agricultural soil planted with transgenic and non-transgenic potato plants. FEMS Microbiol. Ecol., 2000, 32: 241-247.
2. O s b o r n A.M., M o o r e E.R., T i m m i s K.N. An evaluation of terminal-restriction fragment length polymorphism (T-RFLP) analysis for the study of microbial community structure and dynamics. Environ. Microbiol., 2000, 2: 39-50.
3. F o r n e y L.J., Z h o u X., B r o w n C.J. Molecular microbial ecology: land of the one-eyed king. Curr. Opinion Microbiol., 2004, 7: 210-220.
4. D u n b a r J., T i c k n o r L.O., K u s k e C.R. Phylogenetic specificity and reproducibility and new method for analysis of terminal restriction fragment profiles of 16S rRNA genes from bacterial communities. Appl. Environ. Microbiol., 2001, 67: 190-197.
5. K a p l a n C., K i t t s C. Variation between observed and true Terminal Restriction Fragment length is dependent on true TRF length and purine content. J. Microbiol. Methods, 2003, 54: 121-125.
6. S c h l o s s P.D., H a n d e l s m a n J. Toward a census of bacteria in soil. PLOS Computational Biologу, 2006, 2: 786-793.
7. D o l l h o p f S.L., H a s h s h a m S.A., T i e d j e J. Interpreting 16S rDNA T-RFLP data: application of self-organizing maps and principal component analysis to describe community dynamics and convergence. Microb. Ecol., 2001, 42: 495-505.
8. E l l i s R.J., M o r g a n Ph., W e i g h t m a n A.J. e.a. Cultivation-dependent and -independent approaches for determining bacterial diversity in heavy-metal-contaminated soil. Appl. Environ. Microbiol., 2003, 69(6): 3223-3230.
9. А н д р о н о в Е.Е., П е т р о в а С.Н., Ч и ж е в с к а я Е.П. и др. Влияние генетически модифицированного штамма Sinorhizobium meliloti ACH-5 на структуру почвенного сообщества микроорганизмов. Микробиология, 2009, 78(4): 1-10.
10. W e i s b u r g W.G., B a r n s S.M., P e l l e t i e r D.A. e.a. 16S ribosomal DNA amplification for phylogenetic study. J. Bacteriol., 1991, 173(2): 697-703.
11. К о р о с т и к Е.В., П и н а е в А.Г., А х т е м о в а Г.А. и др. Универсальные 16S rRNA праймеры для описания генетического разнообразия сообщества почвенных прокариот. Экологическая генетика, 2006, 4(4): 33-38.
12. S i n g h B., N a z a r i e s L., M u n r o S. e.a. Use of multiplex terminal restriction fragment length polymorphism for rapid and simultaneous analysis of different components of the soil microbial community. Appl. Environ. Microbiol., 2006, 72: 7278-7285.
13. N o r m a n d P., O r s o S., C o u r n o y e r B. Molecular phylogeny of the genus Frankia and related genera and emendation of the family Frankiaceae. J. Syst. Bacteriol., 1996, 46: 1-9.
14. D u n b a r J., T i c k n o r L.O., K u s k e C.R. Assessment of microbial diversity in four United States soils by 16S rRNA gene terminal restriction fragment analysis. Appl. Environ. Microbiol., 2000, 66(7): 2943-2950.
15. G o n o d L.V., M a r t i n - L a u r e n t F., C h e n u C. 2,4-D impact on bacterial communities, and the activity and genetic potential of 2,4-D degrading communities in soil. FEMS Microbiol. Ecol., 2006, 58: 529-537.
16. M a c u r R., W h e e l e r J., B u r r M. e.a. Impacts of 2,4-D application on soil microbial community structure and on populations associated with 2,4-D degradation. Microbiol. Res., 2006, 162: 37-45.
17. C u l m a n S.W., G a u c h H.G., B l a c k w o o d C.B. e.a. Analysis of T-RFLP data using analysis of variance and ordination methods: A comparative study. J. Microbiol. Meth., 2008, 75(1): 55-63.
18. F i e r e r N., J a c k s o n R.B. The diversity and biogeography of soil bacterial communities. PNAS, 2006, 103(3): 626-631.
THE USE OF T-RFLP METHOD FOR STUDYING THE DYNAMICS OF SOIL MICROBIAL COMMUNITIES UNDER XENOBIOTICS TREATMENT
E.V. Pershina, E.E. Andronov, A.G. Pinaev, G.A. Akhtemova, V.A. Doumova, N.A. Provorov
The possibility of using T-RFLP (Terminal Restriction Fragment Length Polymorphism) and PCA (Principal Component Analysis) to quantify changes in soil microbial community composed of bacteria, fungi and archaea after acetone and 2,4-dichlorophenoxyacetic acid (2,4-D) treatment was investigated. The Shannon index calculation showed that diversity in fungi community increases after xenobiotics treatment, archaeal community has slightly decreasing indexes while indexes values for bacterial community remain constant. For the first time it was shown that PCA can be successfully used for investigation of the rate of succession for three components of the microbial community, maximum rates of succession speed were observed for fungi community.
Keywords: microbial community, T-RFLP, PCA, succession rate, xenobiotics.
ГНУ Всероссийский НИИсельскохозяйственной |
Поступила в редакцию |