УДК 631.46:579.64:[632.954+631.45
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ БИОРЕМЕДИАЦИИ ПОЧВЫ, ЗАГРЯЗНЕННОЙ ГЕРБИЦИДОМ ПРОМЕТРИНОМ
Ю.В. КРУГЛОВ, Л.Н. ПАРОМЕНСКАЯ
В модельных опытах оценили влияние различных растительных остатков, торфяного биологически активного грунта и органических веществ на скорость разложения прометрина. Установлено, что формируемый при компостировании дерново-подзолистой почвы и торфа с соломой овса консорциум почвенных бактерий, включающий Sporocytophaga sp., Xanthomonas sp., Pseudomonas sp., разлагает прометрин, используя целлюлозу и гемицеллюлозу, а также продукты их гидролиза (глюкозу, галактозу, ксилозу, арабинозу и маннозу) как энергетический материал и косубстраты. Установлена высокая эффективность биологически активного субстрата, полученного на основе такого консорциума, при биоремедиации загрязненной прометрином почвы.
Ключевые слова: прометрин, деградация, микроорганизмы, биоремедиация почвы.
Прометрин, или 2-метилтио-4,6-бис-(изопропиламино)-сим-триазин, рекомендован для использования против большого числа сорняков на посевах хлопчатника, сои, люпина, картофеля, моркови, многих овощных и зеленных культур (1, 2). В зависимости от климатических условий, агротехнических мероприятий и типа почвы его персистентность обычно составляет 3-6 мес, но известны случаи, когда фитотоксичность проявлялась более года после внесения препарата (3, 4). Длительное присутствие прометрина и продуктов его трансформации в почве может вызывать снижение урожая у чувствительных к гербициду сельскохозяйственных культур, включаемых в дальнейшем в севооборот.
Одним из основных факторов трансформации и детоксикации ксенобиотиков в окружающей среде являются почвенные микроорганизмы. Из почвы выделены различные виды бактерий и микромицетов, способные разлагать прометрин. Некоторые из них при выращивании на минеральных питательных средах используют его в качестве источника углерода (5), азота (6, 7) и серы (8). Однако достаточно высокая персистентность прометрина в природных условиях приводит к выводу, что в почве в силу ряда причин складываются неблагоприятные условия для реализации детоксикационных возможностей микроорганизмов (9-11). Одна из них — недостаток лабильного органического вещества, необходимого для осуществления процессов кометаболизма ксенобиотиков. В связи с этим для ускорения микробной деградации пестицидов предпринимались попытки введения в почву дополнительного органического вещества в виде навоза, компостов, растительных остатков и т.д. Однако результаты оказались неоднозначными: наблюдался как положительный эффект, так и торможение процессов разложения (12-17). Такая вариабельность не получила достаточно четкого объяснения. Вместе с тем понимание взаимоотношений в системе органическое вещество—пестициды—микроорганизмы исключительно важно для развития эффективных методов биоремедиации загрязненной почвы.
Цель настоящей работы — оценить влияние различных органических субстратов на формирование микрофлоры почвы и роль последней в деградации гербицида прометрина.
Методика. В модельных опытах использовали легкосуглинистую дерново-подзо-листую почву с рН 6,4, содержанием гумуса 2,0 % и полной влагоемкостью (ПВ) 30 %. Почвенные образцы отбирали в поле с глубины 0-15 см, просеивали через сито (размер ячеек 3 мм) и увлажняли до 60 % от ПВ. По 0,5 кг почвы помещали в пластмассовые сосуды и в соответствии с вариантом опыта вносили водную суспензию гербицида прометрина [2-метилтио-4,6-бис-(изопропиламино)-сим-триазин] в дозе 0,5-1,0 мг/кг и органические субстраты в количестве 5 % от массы почвы. Этими субстратами служили солома овса, зеленая масса кукурузы и люпина, скошенная через 1 мес после всходов, биологически активный торфяной грунт (БАГ), а также крахмал, пептон, целлюлоза. Сосуды с почвой инкубировали в термостате при 26 °С, периодически отбирая пробы для химических и микробиологических анализов. Прометрин экстрагировали ацетоном, определяя его количество методом газожидкостной хроматографии (ГЖХ) (18). Время разложения гербицида вычисляли на основании графиков его деградации в течение 4 мес. Микробиологические анализы почвы проводили общепринятыми методами, высевая разведения почвенной суспензии на агаризованные питательные среды (19, 20). Численность гетеротрофных эубактерий учитывали на глюкозо-пептонной среде, актинобактерий — на крахмало-аммиачном агаре, грибов — на среде Чапека. Микроорганизмы выделяли традиционными методами на агаризованной питательной среде Гетчинсона (целлюлозоразлагающие бактерии) и глюкозо-пептонном агаре (20). Бактерии идентифицировали до рода на основании морфологических и физиолого-биохимических признаков (21). Активность фермента целлюлазы определяли по скорости накопления глюкозы при гидролизе карбоксиметилцеллюлозы в субстрате (20).
Для приготовления торфо-соломистого компоста использовали верховой пушицесфагновый торф (пос. Форносово, Ленинградская обл.), степень разложенности 15 %, исходное значение рН — 3,2, в который добавляли 10 % соломы овса, 5 % мела (CaCO3), а также NH4NO3, суперфосфат и K2SO4 (соответственно 1,0; 2,0 и 0,5 г на 1 кг торфа). Смесь расфасовывали в полиэтиленовые пакеты вместимостью 2 л, время и температура компостирования — 2 мес при 26 °С, конечное значение рН компоста 6,6-6,8. Целлюлозоразлагающую активность определяли по скорости разложения субстрата на почвенных пластинках (22). Численность гетеротрофных микроорганизмов оценивали методом предельных разведений на агаризованной минеральной питательной среде Александера следующего состава (г/л): K2HPO4 — 1,6; KH2PO4 — 0,4; NH4NO3 — 0,5; MgSO4 — 0,2; CaCl2 — 0,02, FeCl2 — 0,03, дрожжевой экстракт — 0,2 и агар-агар — 15. В качестве источника углерода в среду вносили 1 % целлюлозы, гемицеллюлозы, глюкозы, галактозы, ксилозы, арабинозы или маннозы (в зависимости от варианта опыта). Способность микрофлоры компоста разлагать гербицид изучали в модельном опыте: к промытому речному песку, помещенному в чашки Петри, добавляли жидкую минеральную среду Александера с различными источниками углерода, а также прометрин (100 мг/кг). Для инокуляции использовали водную суспензию компоста, которую вносили в чашки Петри, тщательно перемешивая песок в стерильных условиях (контроль — варианты без инокуляции). Содержание прометрина определяли через 3 нед инкубации при температуре 26 °С.
Эффективность применения торфо-соломистого компоста (биологически активного субстрата — БАГС) для разложения прометрина оценивали в лабораторных опытах: в почву с прометрином вносили 5 % компоста и инкубировали при температуре 26 °С. Содержание гербицида в почве определяли через 3 нед методом ГЖХ (18).
Математическую обработку результатов выполняли по Н.А. Плохинскому (23) (приведены средние арифметические и их ошибки для 3-5 повторностей).
Результаты. Внесение органических субстратов неодинаково влияло на скорость деградации прометрина в почве: зеленая масса кукурузы и люпина замедляла, а солома и биологически активный торфяной грунт (БАГ) ускоряли этот процесс (табл. 1).
| 1. Оценка скорости разложения гербицида прометрина при внесении в почву различных органических субстратов (лабораторный опыт) | ||
Органический субстрат |
Время разложения, сут |
|
на 50 % |
на 90 % |
|
Р а с т и т е л ь н ы е о с т а т к и, |
||
Контроль |
25 |
90 |
Зеленая масса люпина |
95 |
> 120 |
Зеленая масса кукурузы |
40 |
85 |
Солома овса |
13 |
35 |
БАГ |
10 |
30 |
О р г а н и ч е с к и е с о е д и н е н и яб |
||
Контроль |
22 |
60 |
Крахмал |
12 |
19 |
Целлюлоза |
12 |
17 |
Пептон |
60 |
> 120 |
П р и м е ч а н и е. Исходное содержание прометрина в почве 0,50 мг/кг (а) или 0,85 мг/кг (б). |
||
Использованные органические субстраты имеют сложный химический состав и качественно различаются: в зеленой массе люпина и кукурузы содержится значительное количество легкоподвижных органических соединений, включая белки, аминокислоты и сахара, в соломе овса и в торфяном грунте углерод находится преимущественно в составе полисахаридов — целлюлозы, гемицеллюлоз, а также лигнина (24). Результаты модельных опытов показали, что органические соединения действительно оказывают на деградацию прометрина неодинаковое действие. Разложение гербицида ускорялось в почве с крахмалом и целлюлозой и замедлялось при внесении пептона (см. табл. 1).
| 2. Динамика содержания микроорганизмов (КОЕ/г почвы) после внесения органических субстратов (лабораторный опыт) | |||||||||
Вариант |
Эубактерии, x105 |
Грибы, x103 |
Актинобактерии, x104 |
||||||
5-е сут |
10-е сут |
35-е сут |
5-е сут |
10-е сут |
35-е сут |
5-е сут |
10-е сут |
35-е сут |
|
Контроль |
130±20 |
60±13 |
70±11 |
110±25 |
190±23 |
270±41 |
480±73 |
200±18 |
190±23 |
Крахмал |
270±55 |
70±12 |
170±39 |
200±38 |
320±29 |
110±26 |
160±30 |
180±39 |
90±16 |
Целлюлоза |
630±110 |
110±25 |
160±30 |
170±40 |
280±44 |
270±47 |
40±13 |
130±21 |
130±30 |
Пептон |
2400±360 |
1730±320 |
3300±264 |
120±30 |
210±31 |
270±31 |
50±11 |
40±11 |
300±45 |
Вместе с тем следует отметить, что внесение любого из используемых в опыте органических субстратов приводило к существенному росту численности аэробных гетеротрофных эубактерий, некоторому увеличению количества грибов и снижению численности актинобактерий (табл. 2). Таким образом, при добавлении органического вещества наблюдалось интенсивное размножение микроорганизмов и перестройка микробного сообщества. Доминирующее по численности положение в нем занимали эубактерии. При сопоставлении скорости разложения гербицида с результатами микробиологического анализа (см. табл. 1, 2) оказалось, что деградация не связана напрямую с количеством гетеротрофных микроорганизмов в почве. Так, численность эубактерий в присутствии пептона была в десятки раз выше, а скорость разложения гербицида — существенно ниже, чем в других вариантах опыта.
| 3. Численность микроорганизмов, утилизирующих различные моносахара (x103 КОЕ/г почвы), при внесении в почву соломы и компоста (лабораторный опыт) | ||||
Вариант |
Глюкоза |
Галактоза |
Арабиноза |
Манноза |
П |
350 |
250 |
170 |
2500 |
ПС |
11 000 |
20 000 |
3000 |
33 000 |
ТСК |
50 000 |
– |
50 000 |
35 000 |
П р и м е ч а н и е. П, ПС и ТСК — соответственно почва, почва + солома и торфо-соломистый компост. Прочерк означает, что анализ не проводили. |
||||
Из органических субстратов, используемых в опыте, наибольший интерес представляют растительные полисахариды, прежде всего целлюлоза, которая составляет основную массу растительных остатков, поступающих в почву после уборки урожая. Возникает вопрос: какова связь между скоростью разложения гербицида и содержанием соломы в почве?
Результаты анализа целлюлазной активности показали, что уже через 1 нед после внесения соломы в почву скорость накопления глюкозы возрастала более чем в 2 раза (79 против 33 мг x 100 г-1 x 24 ч-1 в контроле), при этом разница сохранялась в течение всего опыта (через 2 нед — соответственно 80±4,0 и 32±2,8, через 3 нед — 75±4,5 и 30±3,5 мг x 100 г-1 x 24 ч-1. В то же время через 3 нед компостирования почвы с соломой в ней увеличивалась численность бактерий, учитываемых на средах с глюкозой, галактозой, маннозой и арабинозой; то же наблюдали при компостировании соломы с торфом (табл. 3). Такой рост численности мог произойти только в результате поступления моносахаров в почву в процессе ферментативного гидролиза целлюлозы и гемицеллюлоз соломы микроорганизмами. Следовательно, в почве, компостируемой с соломой, формируется и занимает доминирующее положение микробное сообщество, в котором ключевая роль принадлежит микроорганизмам, гидролизующим целлюлозу и гемицеллюлозу.
| 4. Эффективность разложения гербицида прометрина консорциумом микроорганизмов, сформировавшимся в торфо-соломистом компосте, на минеральной питательной среде с добавлением различных источников углерода (лабораторный опыт) | ||
Источник углерода |
Разложено прометрина |
|
мг/л, M±m |
% |
|
Без углерода |
6,0±1,2 |
7,9 |
Целлюлоза |
45,5±2,3 |
59,0 |
Гемицеллюлоза |
49,6±1,5 |
65,2 |
Сахароза |
49,3±1,7 |
64,8 |
Глюкоза |
26,8±2,1 |
35,3 |
Галактоза |
44,9±2,2 |
59,1 |
Арабиноза |
50,6±1,5 |
66,5 |
Манноза |
54,4±1,7 |
71,6 |
П р и м е ч а н и е. Исходная концентрация прометрина 76,9 мг/л. |
||
При оценке способности представителей этого сообщества разлагать гербицид на искусственных питательных средах, инокулированных суспензией торфо-соломистого компоста (табл. 4), мы показали, что наиболее интенсивная деградация происходила на средах с маннозой, галактозой и арабинозой. Почти такую же активность разложения прометрина отмечали в присутствии целлюлозы и гемицеллюлозы. В то же время на среде без углерода гербицид практически не разлагался. Иными словами, некоторые представители микробного консорциума, формирующегося при гидролизе соломы, способны эффективно разлагать прометрин, используя полисахариды целлюлозу и гемицеллюлозу, а также продукты их гидролиза в качестве энергетического материала.
Для выявления состава такого консорциума из почвы получили накопительную культуру микроорганизмов, утилизирующую целлюлозу. После нескольких пассажей из нее были выделены чистые культуры бактерий, идентифицированные как Sporocytophaga sp., Xanthomonas sp., Pseudomonas sp.
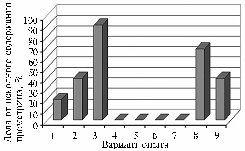
На минеральной среде Гетчинсона консорциум микроорганизмов (Sporocytophaga sp., Xanthomonas sp., Pseudomonas sp. и др.) активно разлагал прометрин, причем скорость разложения зависела от источника углерода: в присутствии целлюлозы за 1 мес — 11,0 мг гербицида, глюкозы — 20,0 мг, арабинозы — 45,4 мг, или более 90 % (рис.). Чистая культура Sporocytophaga sp. достаточно хорошо росла на среде с целлюлозой или глюкозой, но не разлагала прометрин. Xanthomonas sp. и Pseudomonas sp. не усваивали целлюлозу в качестве источника углерода, соответственно, не росли и не разлагали гербицид, но эффективно деградировали его на среде с глюкозой. Иными словами, целлюлозоразлагающие бактерии Sporocytophaga sp. успешно деградируют гербицид не в чистой культуре, а в составе ассоциации с бактериями-спутниками, которые используют глюкозу, образующуюся при гидролизе целлюлозы. Этим и объясняется положительный эффект соломы на деградацию гербицида в почве.
|
Эффективность разложения гербицида прометрина консорциумом утилизирующих целлюлозу бактерий на минеральной питательной среде с добавлением различных источников углерода: 1-3 — консорциум микроорганизмов, утилизирующих целлюлозу (Sporocytophaga sp., Xanthomonas sp., Pseudomonas sp. и др.), в присутствии соответственно целлюлозы, глюкозы и арабинозы; 4, 5 — Sporocytophaga sp. соответственно в присутствии целлюлозы и глюкозы; 6, 7 — соответственно Xanthomonas sp. и Pseudomonas sp. на среде с целлюлозой; 8, 9 — соответственно Xanthomonas sp. и Pseudomonas sp. на среде с глюкозой (лабораторный опыт; исходная концентрация прометрина — 50 мг/л). |
Практический вывод о возможности направленно формировать микробное сообщество, способное разлагать пестициды, посредством внесения растительных остатков с высоким содержанием полисахаридов, был реализован в подходе, заключавшемся во введении в загрязненную прометрином почву биологически активного торфяного субстрата (БАГС) со сформированным консорциумом микроорганизмов, разлагающим гербицид. При испытании эффективности применения такого субстрата для деградации прометрина в дерново-подзолистой почве в трех независимых опытах установлено, что введение компоста значительно повышает скорость разложения гербицида. Так, в контроле (без БАГС) при исходном содержании прометрина в 1-м, 2-м и 3-м опыте соответственно 6,5; 10,8 и 10,3 мг/кг разложилось соответственно 1,7; 3,6 и 3,4 мг/кг (или 26, 33 и 33 % гербицида). В вариантах с добавлением БАГС исходное содержание составило соответственно 6,8; 10,3 и 9,0 мг/кг, количество деградированного гербицида — 6,1; 8,2 и 7,0 мг/кг (или 89, 80 и 79 %). Полученные результаты указывают на перспективность такого подхода при биоремедиации почв.
Известно, что полисахариды целлюлоза и гемицеллюлоза, на которые приходится около 50 % органического углерода, поступающего в почву с растительным опадом, играют ведущую роль в формировании и функционировании микробного комплекса почвы (25). Скорость разложения растительного опада служит показателем биологической активности и плодородия почвы. При ферментативном гидролизе целлюлозы и гемицеллюлоз образуются моносахара, используемые сопутствующей микрофлорой в качестве источника углеродного питания и энергии. В почве формируется консорциум, в котором ключевую роль играют микроорганизмы, продуцирующие ферменты гидролиза растительных полисахаридов. Наши исследования показали, что при компостировании почвы с соломой, содержащей в сумме до 70 % целлюлозы и гемицеллюлозы, скорость разложения прометрина возрастает в 2-3 раза, что коррелирует с повышением активности фермента целлюлазы. При этом существенно увеличивается число микроорганизмов, использующих образующиеся моносахара в качестве энергетического материала, которые разлагают прометрин. Доминирующие формы этого консорциума в торфо-соломистом компосте — бактерии рода Sporocytophaga sp., Xanthomonas sp. и Pseudomonas sp. (две последние разлагают прометрин, используя в качестве источника углерода глюкозу). Возможно, механизм деградации гербицида связан с его использованием микроорганизмами в качестве источника азота или процесс идет по типу кометаболизма, когда сахара, образующиеся при гидролизе полисахаридов, используются сопутствующей микрофлорой в качестве косубстратов. Из полученных результатов следует, что консорциум микроорганизмов, формирующийся при разложении растительных полисахаридов, служит важнейшим фактором самоочищения почв от пестицидов и других органических ксенобиотиков. Этот вывод представляет интерес для оценки и прогнозирования биодеградабельности ксенобиотиков в почве, с одной стороны, и развития методов биоремедиации техногенно загрязненных почв — с другой.
Ранее М.С. Соколов и соавт. (26) показали, что в разных природно-климатических зонах при повышении скорости разложения растительного опада персистентность пестицидов снижалась (то есть их деградация происходила быстрее). На основании этого был предложен метод классификации зональной биодеградабельности пестицидов, что следует учитывать при разработке экологически безопасных технологий применения химических средств защиты растений. Их наблюдения и выводы подтверждают, что растительный опад, включающий в качестве основного компонента целлюлозу и гемицеллюлозу, имеет решающее значение в микробиологических процессах деградации пестицидов.
Итак, внесение в почву растительных остатков, богатых полисахаридами, или специальных биологически активных торфо-соломистых субстратов, включающих отселектированный консорциум микроорганизмов, утилизирующих целлюлозу, — простой и доступный агротехнический прием, открывающий большие перспективы для эффективного управления процессом биоремедиации почв, загрязненных пестицидами.
Л И Т Е Р А Т У Р А
1. М е л ь н и к о в Н.Н., Н о в о ж и л о в К.В., Б е л а н С.Р., П ы л о в а Т.Н. Справочник по пестицидам. М., 1985.
2. Государственный каталог пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. М., 2003.
3. М е л ь н и к о в Н.Н., В о л к о в а А.И., К о р о т к о в а О.А. Пестициды и окружающая среда. М., 1977.
4. K h a n S.U. Studies on bound 14C-prometryne residues in soil and plants. Chemosphere, 1982, 11(8): 771-795.
5. И г н а т о в е т с О.С., Л е о н т ь е в В.Н. Механизм разложения прометрина бактериями рода Pseudomonas. Докл. НАН Беларуси, 2008, 3: 82-86.
6. M y s k o w W., L a s k o t e T., S t a c h y r a A. Cyanuric acids-triazine derivate as a nitrogen source for some soil microorganisms. Acta Microbiol. Pol., 1983, 32(2): 80-85.
7. C o o k A.M., H u t t e r R. Triazines as nitrogen sources for bacteria. J. Agric. Food Chem., 1981, 29: 1135-1143.
8. C o o k A.M., H u t t e r R. Ametryne and prometryne as sulfur sources for bacteria. Appl. Environ. Microbiol., 1982, 43(4): 781-786.
9. S i m s J.L., S i m s R.S., M a t t h e w s J.E. Approach to bioremediation of contaminated soil. Hazard. Waste Hazard. Mater., 1990, 7(2): 117-149.
10. К р у г л о в Ю.В. Микрофлора почвы и пестициды. М., 1991.
11. S k l a d n y G.J., M e t t i n g F.B. Bioremediation of contaminated soil. In: Soil microbial ecology (Application in agricultural and environmental management) /F.B. Metting (ed.). N.Y., Basel, Hong-Kong, Marcel Deccer Inc., 1993: 483-513.
12. B e i l i n c k C. Influence de quelques amendementssur la mineralisation de la atrazine 14C dans un sol frais de prairie et la immobilization des residues. Rev. Ecol. Biol. Sol., 1983, 20(4): 435-444.
13. Г о л о в л ё в а Л.А., Ф и н к е л ь ш т е й н З.И., Ш у р у х и н Ю.В., Б а р ы ш н и к о в а Л.М. Биоремедиация почв, загрязненных симазином. Агрохимия, 1993, 12: 57-61.
14. H o u t S., B a r i u s s o E., B e r g h e a u n d V. Modification to atrazine degradation pathways in a loamy soil after addition of organic amendments. Soil Biol. Biochem., 1998, 30(40): 2147-2157.
15. R o u c h a u d J., G u s t i n F., V a n H i m m e M. e.a. Influence of the organic fertilizers treatments on the soil persistence of the imazamethalenz and izoxabene herbicides in winter wheat crops. Mededelingen Faculteit Landbouwwetenschappen, 1992, 57(3b): 1185-1191.
14.S a t o K. Effect of nutrients on interaction between pesticide pentachlorophenol and microorganisms in soil. In: Bioremediation through rizosphere technology /T.A. Anderson, Y.K. Coats (eds.). ACS Symp. Series, v. 563. Am. Chem. Soc., Washington, DC, 1994: 43-55.
17. A s s a f N.F., T u r c o R.F. Influence of carbon and nitrogen application on atrazine degradation in soil. Amer. Soc. Agron. Ann. Meeting. Minneapolis, 1992: 248-249.
18. Методы определения микроколичеств пестицидов в продуктах питания, кормах и внешней среде /Под ред. М.А. Клисенко. М., 1983.
19. С е г и Ж. Методы почвенной микробиологии. М., 1983.
20. А с е е в а И.В., Б а б ь е в а И.П., Б ы з о в Б.А. и др. Методы почвенной микробиологии и биохимии /Под ред. Д.Г. Звягинцева. М., 1991.
21. Определитель бактерий Берджи /Под ред. Дж. Хоулт, Н. Криг, П. Снит и др. Т. 1-2. М., 1997.
22. К р у г л о в Ю.В., П а р о м е н с к а я Л.Н. Микробиологические методы оценки экологической опасности применения пестицидов. М., 1991.
23. П л о х и н с к и й Н.А. Биометрия. М., 1970.
24. А л е к с а н д р о в а Л.А. Органическое вещество почвы и процессы его трансформации. Л., 1980.
25. Г у з е в В.С., И в а н о в Л.И. Концептуальная модель микробного сообщества почвы. В сб.: Биотехнология микроорганизмов в сельском хозяйстве. М., 1989: 78-89.
26. С о к о л о в М.С., С т р е к о з о в Б.П., Э ч к а л о в А.П. и др. Схематическая карта использования и детоксикации пестицидов СССР. В сб.: Почвоведение и агрохимия. Пущино, 1977: 128-135.
MICROBIOLOGICAL FACTORS OF SELF-PURIFICATION AND BIOREMEDIATION OF SOIL POLLUTED BY HERBICIDE PROMETRYNE
Yu.V. Kruglov, L.N. Paromenskaya
Composting of soddy-podzolic soil and peat with oats straw amplifies cellulose decomposing capacity and increases number of the microorganisms, which use products of polysaccharides cellulose and hemicellulose hydrolysis. Thus the consortium in which cellulose decomposing microorganisms play a key role is formed. The culture of such consortium decomposes prometryne, using cellulose and hemicellulose, and also products of their hydrolysis (glucose, galactose, xylose, arabinose and mannose) as an energetic material and co-substrates. High efficiency of peat-straw compost with consortium of microorganisms for bioremediation of the soil polluted by herbicide prometryne is demonstrated.
Keywords: prometryne, degradation, microorganisms, soil bioremediation.
ГНУ Всероссийский НИИ сельскохозяйственной |
Поступила в редакцию |