УДК 631:579.64:581.1.[132.8+135]
ВИДОВЫЕ ОСОБЕННОСТИ СОСТАВА КОРНЕВЫХ ВЫДЕЛЕНИЙ РАСТЕНИЙ И ЕГО ИЗМЕНЕНИЕ В РИЗОСФЕРЕ ПОД ВЛИЯНИЕМ ПОЧВЕННОЙ МИКРОФЛОРЫ
Л.В. КРАВЧЕНКО, А.И. ШАПОШНИКОВ, Н.М. МАКАРОВА, Т.С. АЗАРОВА, К.А. ЛЬВОВА, И.И. КОСТЮК, И.А. ТИХОНОВИЧ
Исследовали качественный состав и количество корневых выделений — органических кислот и сахаров в ризосфере растений томата, огурца и различных генотипов пшеницы. Показано сохранение их высокого содержания у овощных культур при инокуляции штаммом Pseudomonas chlororaphis SPB1217. Обсуждается значение ризосферных микроорганизмов в физиологии растений и возможности селекции последних по составу корневых выделений для повышения продуктивности агроценозов.
Ключевые слова: корневые выделения, экссудация, ризобактерии, ризосфера.
Важность выделительной функции корней одним из первых оценил известный отечественный ученый С.П. Костычев, еще в 1926 году предсказавший возможность активизации азотфиксации в прикорневой зоне у небобовых. Он писал о целесообразности изучения корневых выделений и их роли в жизнедеятельности почвенных микроорганизмов «во взаимной связи» и создания нового направления в физиологии растений под названием «выделение веществ» (1). Вскоре в работах Д.А. Сабинина, Н.Г. Потапова, А.Л. Курсанова, И.И. Колосова была выявлена высокая метаболическая активность корней, а И.И. Колосов также обнаружил, что бактерии, находящиеся на поверхности корня, значительно усиливают его синтетическую активность (2). В последующие годы представления о том, что выделение веществ клетками корней — нормальное проявление процессов жизнедеятельности (3), подтвердились. Применение изотопной метки 14C позволило оценить размеры корневой экссудации: у растений пшеницы в течение вегетации приблизительно 45 % углерода, поступившего в корни, выделялось в почву (4), у различных видов трав за 90-суточный период вегетации в нестерильных условиях — 8-15 % фиксированного углерода (5).
Сведения о корневых выделениях пополнились в результате изучения их качественного состава (6-9). Большая серия работ была проведена V. Vancura с соавт. (10-12), продемонстрировавшими специфичность набора экссудатов в ризосфере у разных видов растений. Состав корневых выделений зависит также от стадии развития растения (11, 13), условий роста, физико-химических свойств среды, в которой развивается корневая система (3). Корневые экзометаболиты проявляют неодинаковые физиологические свойства и представлены спектром органических соединений из разных классов. Это водорастворимые вещества, поступающие из корней в почву; высокомолекулярные полисахариды (муцигель), образующие тонкие слои на поверхности корней; отслаивающиеся клетки корневого чехлика, которые частично остаются в корневой зоне; отмирающие клетки эпидермиса; летучие и газообразные метаболиты прорастающих семян и корней.
Корневые выделения оказывают значительный эффект на рост и активность почвенных микроорганизмов. Благодаря использованию современных методов исследования появилось множество экспериментальных доказательств изменения структуры микробных сообществ ризосферы в зависимости от состава корневых экзометаболитов (13-15). Хорошо изученным примером взаимного влияния растений и микроорганизмов служит бобово-ризобиальный симбиоз. На ранней стадии его формирования состав и количество сигнальных молекул (флавоноидов) в корневых выделениях определяет специфичность и интенсивность взаимодействия растения с определенными видами клубеньковых бактерий, активность которых в ризосфере, в свою очередь, изменяет экссудацию сигнальных молекул растением (16). Похожий механизм выявлен и у арбускулярной микоризы (16).
Не только симбиотические, но и другие ризосферные микроорганизмы воздействуют на корневую экссудацию (17). Ее усиление может происходить за счет дополнительного градиента концентрации органических соединений, направленного от поверхности корня и вызванного трофической активностью микроорганизмов (18), а также влияния микробных экзометаболитов (19, 20). Обнаружение в корневых выделениях веществ, аналогичных по механизму действия бактериальным сигналам кворум-сенсинга (QS signal mimics) (15), приводит к выводу о способности растения регулировать рост и активность популяций ассоциативных ризобактерий в ризосфере. Основываясь на полученных данных о роли микроорганизмов в физиологических процессах у растений, современная почвенная экология рассматривает ризосферу как систему с обратными связями, в которой трансформация биогенных элементов, сигнальных молекул и энергии определяется степенью интеграции метаболических процессов и физико-химическим состоянием партнеров (21).
Используемые ранее селекционные программы привели к созданию сортов с пониженным количеством корневых выделений. Возможность генетической модификации растений с целью изменения состава и количества корневых экзометаболитов, о чем писал С.П. Костычев (22), открывает перспективы для формирования микробно-растительных систем с улучшенной способностью к адаптации в стрессовых условиях и высокой продуктивностью (23), на что и ориентирована современная селекция (23). Это позволит приблизить метаболическую активность растений к уровню у исходных генотипов (23). Известна способность ростстимулирующих ризобактерий повышать интенсивность фотосинтеза (24, 25), что может усиливать приток фотосинтатов в корни и экссудацию. Интерес также представляет повышение содержания в корневых выделениях органических кислот. Они играют важную роль в ассоциативной азотфиксации (26) и конкурентной колонизации корней ризобактериями (27), повышают антифунгальную активность штаммов — антагонистов фитопатогенных грибов (28, 29). Селекция подобных генотипов требует глубокого изучения корневых выделений у сельскохозяйственных культур и их метаболизма в ризосфере, поскольку необходимо четко определить процедуры проверки результатов отбора.
Наша цель заключалась в анализе состава органических кислот и сахаров в корневых выделениях у различных сельскохозяйственных культур и оценке влияния ризобактерий на содержание питательных субстратов в ризосфере.
Методика. Объектом исследования служили растения томата Lycopersicon esculen-tum L. (сорт Kapмeлло), огурца Cucumis sativus L. (сорт Грендель), сладкого перца Capsicum annum L. (сорт Spitfire), диплоидной пшеницы Triticum monococcum (номер по каталогу Всероссийского НИИ растениеводства к-46750) и T. boeoticum (к-40117), гексаплоидной пшеницы сортов Обелиск (к-62032), Безостая 1, Buchanan и Finley. Для инокуляции использовали ризосферный антифунгальный и ростстимулирующий штамм Pseudomonas chlororaphis SPB1217. Семена томата, огурца и перца стерилизовали 5,0 % раствором гипохлорита натрия в течение 3 мин, семена гексаплоидной пшеницы — 0,1 % раствором сулемы в течение 6 мин, диплоидной пшеницы —4,5 % раствором гипохлорита натрия в течение 1,5 ч. Растения выращивали 14 сут в фитотроне при 21 °С, освещенности 10 000 лк и фотопериоде 16 ч/8 ч (день/ночь) в стеклянных сосудах объемом 800 мл (томат, огурец, перец) и стеклянных трубках, с одного конца закрытых марлей и закрепленных в плоскодонных колбах объемом 250 мл (пшеница), с раствором PNS, содержащим Ca(NO3)2L4H2O — 972; MgSO4L7H2O — 616; NaNO3 — 140; KH2PO4 — 170; NH4NO3 — 55; Fe-EDTA — 20; ZnSO4L7H2O — 1,7; B4Na2O7L7H2O — 3,35; CuSO4L5H2O — 0,25 и Na2MoO4L2H2O — 0,12 мг/л (раствор разбавляли в 2 раза). Для инокуляции готовили суспензию клеток P. chlo-roraphis SPB1217 с титром 105 КОЕ/мл. Бактерии также выращивали 3 сут в среде PNS с добавлением стерильных корневых выделений от 14-суточных растений для оценки интенсивности потребления этих выделений микроорганизмами (контроль).
Состав органических кислот, углеводов и аминокислот в корневых экссудатах определяли методом высокоэффективной жидкостной хроматографии (ВЭЖХ) в системе JASCO LC-900 («Jasco International Co., Ltd.», Япония). Органические кислоты разделяли на ионообменной хроматографической колонке SUPELCOGEL C-610H («Supelco Gland», Швейцария) с ультрафиолетовым детектором (l = 220 нм). В качестве подвижной фазы применяли раствор 10,0 мМ H3PO4. Сахара фракционировали на хроматографической колонке SUPELCOSIL LC-NH2 («Supelco Gland», Швейцария). В качестве подвижной фазы использовали смесь ацетонитрил:вода (85:15 по объему). Редуцирующие сахара после фракционирования выявляли при помощи колориметрической реакции (окрашивающим реактивом служил раствор хлористого 2,3,5-трифенилтетразолия). Поглощение окрашенного комплекса измеряли на ультрафиолетовом детекторе при l = 487 нм. Аминокислоты идентифицировали высокочувствительным методом AccQ-Tag («Waters», США), который основан на анализе их специфичных флуоресцирующих производных. Для анализа использовали стандартный набор реактивов AccQ-Fluor Reagent Kit («Waters», США).
Все эксперименты проводили в 3-кратной повторности. Статистическую обработку выполняли с помощью программы STATISTICA V-5. Представлены средние арифметические значения со стандартным отклонением.
Результаты. Основными органическими кислотами корневых выделений у томата были лимонная (79,0 % от суммарного количества) и янтарная (14,0 %), у огурца — яблочная (38,4 %) и янтарная (41,4 %), у сладкого перца — лимонная (45,3 %), яблочная (30,6 %) и янтарная (23,5 %), у гексаплоидной пшеницы — яблочная и янтарная (соответственно 55,3 и 27,2 % — у сорта Обелиск, 39,7 и 56,8 % — у сорта Buchanan, 21,7 и 74,4 % — у сорта Finley). В корневых выделениях у сорта Безостая 1 яблочная кислота составляла более 90 % от суммарного количества органических кислот. Особенностью растений сорта Обелиск оказалась достаточно высокая доля лимонной кислоты — 11,0 %. Диплоидные генотипы пшеницы характеризовались высоким содержанием янтарной кислоты (до 90 % от общего количества). В составе сахаров в корневых выделениях у томата преобладали фруктоза (54,0 %) и глюкоза (29,0 %), у огурца — глюкоза (70,5 %), у сладкого перца — глюкоза (52,6 %) и фруктоза (43,3 %). Особенностью гексаплоидной пшеницы было повышенное содержание мальтозы и мелибиозы: соответственно от 19,5 % у сорта Безостая 1 до 61,0 % у
| 1. Суммарное количество органических кислот и сахаров (мкг/растение) в корневых выделениях при выращивании в жидкой среде PNS (M±m) | ||
Культура, сорт, образец по каталогу ВИР |
Органические |
Сахара |
О в о щ н ы е к у л ь т у р ы |
||
Томат, сорт Кармелло |
53,5±5,8 |
2,6±0,4 |
Огурец, сорт Грендель |
23,0±3,0 |
7,0±0,9 |
Сладкий перец, сорт Spitfire |
48,3±5,2 |
6,5±0,8 |
Г е к с а п л о и д н а я п ш е н и ц а |
||
Сорт Безостая 1 |
79,4±8,2 |
253,0±27,1 |
Сорт Обелиск |
19,7±2,4 |
249,3±26,1 |
Сорт Buchanan |
49,1±5,4 |
158,9±17,0 |
Сорт Finley |
22,6±3,0 |
209,3±21,4 |
Д и п л о и д н а я п ш е н и ц а |
||
T. boeoticum (к-40117) |
28,3±3,2 |
55,5±5,8 |
T. monococcum (к-46750) |
17,1±1,9 |
28,1±3,1 |
П р и м е ч а н и е. PNS — состав среды см. в разделе «Методика». ВИР — Всероссийский НИИ растениеводства (г. Санкт-Петербург). |
||
сорта Обелиск и от 8,0 % у сорта Обелиск до 66,5 % у сорта Безостая 1. Большую часть остальных сахаров составляли фруктоза и глюкоза. У диплоидных генотипов T. monococcum и T. boeoticum доля мальтозы равнялась соответственно 66,0 и 63,5 %, фруктозы — 17,4 и 11,7 %, глюкозы — 7,7 и 10,0 %.
Наибольшее суммарное количество органических кислот в расчете на одно растение отмечали у пшеницы сорта Безостая 1 и томата (соответственно 79,4 и 53,5 мкг/растение), наибольшее количество сахаров — у всех сортов гексаплоидной пшеницы (табл. 1). За 14 сут суммарная экссудация органических кислот и сахаров составляла 0,1-1,3 % от величины сухой биомассы растений. Минимальные значения отмечали у огурца и T. monococcum (соответственно 0,1 и 0,2 %), наибольшие — у гексаплоидных сортов пшеницы (1,0-1,2 %) и томата (1,3 %).
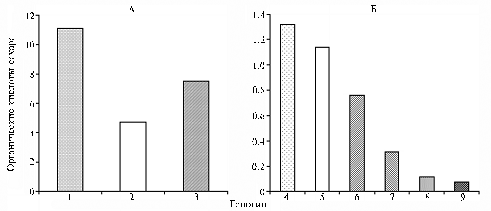 |
Молярное соотношение органических кислот и сахаров в корневых выделениях овощных культур (А) и пшеницы (Б) при выращивании в жидкой среде PNS: 1, 2 и 3 — соответственно томат (сорт Кармелло), огурец (сорт Грендель) и сладкий перец (сорт Spitfire); 4 и 5 — диплоидная пшеница Triticum monococcum и T. boeoticum,образцы по каталогу ВИР (Всероссийский НИИ растениеводства им. Н.И. Вавилова, г. Санкт-Петербург) соответственно к-46750 и к-40117; 6-9 — гексаплоидная пшеница T. aestivum, соответственно сорта Безостая 1, Buchanan, Finley и Обелиск. PNS — состав среды см. в разделе «Методика». |
У исследуемых видов растений корневые выделения заметно различались по соотношению органических кислот и сахаров — основных питательных субстратов для ризосферных микроорганизмов. У овощных культур в экссудатах доминировали органические кислоты (их суммарное количество было в 4,7-11,1 раза больше, чем количество сахаров) (рис., А). Значительные различия по этому показателю были выявлены у генотипов пшеницы (см. рис., Б). Небольшое преобладание органических кислот отмечали в корневых выделениях у диплоидов T. monococcum и T. boeoticum, сахаров — у всех гексаплоидных сортов. Только у сорта Безостая 1 доля органических кислот в экссудатах была сравнительно высока и достигала 0,76 (см. рис., Б).
Для оценки влияния инокуляции штаммом P. chlororaphis SPB1217 на количество корневых выделений отобрали культуры, различающиеся по относительному содержанию органических кислот, — томат, огурец и гексаплоидную пшеницу сортов Безостая 1 и Обелиск. В ризосфере растений и при культивировании бактерий in vitro на среде со стерильными корневыми выделениями (без растений) штамм P. chlororaphis SPB1217 активно рос, достигая во всех анализируемых вариантах примерно одинаковой численности (соответственно около 107, 106 и 108 КОЕ/растение, КОЕ/мл PNS). При этом in vitro ризобактерии потребляли не менее 90 % органических кислот и сахаров корневых выделений. В опытах с инокуляцией общее количество органических кислот в выделениях у томата было в 1,7 раза, у огурца — в 1,4 раза выше, чем у стерильных растений, общее количество сахаров также возрастало (табл. 2). В ризосфере сохранялось высокое содержание активно утилизируемых субстратов (лимонная, яблочная и янтарная кислоты, глюкоза, фруктоза), которые практически полностью потреблялись in vitro. В корневых выделениях пшеницы в этих условиях количество органические кислот значительно снижалось (см. табл. 2), особенно у сорта Обелиск, для которого были характерны наименьшие показатели их экссудации (см. табл. 1) и доли по сравнению с сахарами (см. рис., Б). Существенно меньше снижалась концентрация сахаров (см. табл. 2), но оставшуюся их часть составляли в основном мальтоза и мелибиоза.
| 2. Суммарное количество органических кислот и сахаров в корневых выделениях растений при инокуляции штаммом Pseudomonas chlororaphis SPB1217 (M±m) | ||||
Вариант |
Органические кислоты |
Сахара |
||
мкг/растение |
к контролю, % |
мкг/растение |
к контролю, % |
|
Т о м а т, с о р т К а р м е л л о |
||||
Контроль |
53,5±5,8 |
|
2,6±0,4 |
|
Опыт |
93,0±10,3 |
173,8 |
2,9±0,3 |
111,5 |
О г у р е ц, с о р т Г р е н д е л ь |
||||
Контроль |
23,0±3,0 |
|
7,0±0,9 |
|
Опыт |
31,3±3,7 |
136,1 |
11,5±1,3 |
164,3 |
Г е к с а п л о и д н а я п ш е н и ц а |
||||
Сорт Обелиск |
||||
Контроль |
19,7±2,4 |
|
249,3±26,1 |
|
Опыт |
1,8±0,4 |
9,1 |
139,3±14,3 |
55,9 |
Сорт Безостая 1 |
||||
Контроль |
79,4±8,2 |
|
253,0±27,1 |
|
Опыт |
22,3±2,9 |
28,1 |
183,6±20,5 |
72,6 |
П р и м е ч а н и е. Контроль — стерильные растения, опыт — инокулированные растения. |
||||
Сохранение достаточного количества питательных субстратов в ризосферной зоне способно служить одним из факторов успеш-ного взаимодействия растений и по-лезных ризобактерий. Можно пред-положить наличие разных стратегий подавления фитопатогенной инфекции у растений, в корневых выделениях которых преобладают органические кислоты (овощные культуры) и сахара (пшеница). Обогащение прикорневой зоны органическими кислотами будет способствовать активной колонизации корней микроорганизмами, биосинтезу антифунгальных метаболитов и индукции реакций системной устойчивости у растения, а стимуляция экссудации даст ризобактериям дополнительное конкурентное преимущество. Данные о том, что псевдомонады продуцируют экзометаболиты, которые значительно усиливают корневую экссудацию, получены для растений люцерны, кукурузы и пшеницы (20). В состав соединений, оказывающих влияние на экссудацию, входили феназины, выделяемые штаммом P. chlororaphis SPB1217 (29), и 2,4-диацетилфлороглюцин (20). Повышение доли сахаров (мальтозы, мелибиозы) в корневых выделениях может ослабить конкуренцию между ризобактериями и фитопатогенными грибами за источники питания. Снижение фитопатогенной нагрузки на растение в этом случае будет связано как с активностью ризобактерий-антагонистов, так и с уменьшением агрессивности фитопатогена. Показано, что при наличии в ризосферной почве доступного для гриба питания и меньшей конкуренции F. culmorum развивается как сапротроф с минимальной колонизацией корней или ее замедлением (30).
Таким образом, при изучении количественного состава органических кислот и сахаров в ризосфере растений томата, огурца и различных генотипов пшеницы выявлена его специфичность. Высокое содержание этих растительных метаболитов в ризосфере сохранялось у овощных культур при инокуляции штаммом Pseudomonas chlororaphis SPB1217. Современное развитие идей С.П. Костычева, предсказавшего важное значение корневых выделений для почвенных микроорганизмов и нормальной жизнедеятельности растений, показывает, что создание перспективных для устойчивого земледелия растительно-мик-робных систем требует селекции растений, способных обогащать ризосферу полезными для себя микроорганизмами, которые, в свою очередь, будут формировать благоприятную среду обитания за счет регулирования метаболической активности корневой системы. То есть наиболее перспективной представляется тесная функциональная интеграция партнеров ассоциативных растительно-микробных симбиозов.
Л И Т Е Р А Т У Р А
1. К о с т ы ч ев С.П. Физиология растений. Ч. 2. М.-Л., 1933.
2. Г е н к е л ь П.А. Физиология растений с основами микробиологии. М., 1962.
3. С м и р н о в А.М. Рост и метаболизм изолированных корней в стерильной культуре. М., 1970.
4. M a r t e n s R. Contribution of rhizodeposits to the maintenance and growth of soil microbial biomass. Soil Biol. Biochem., 1990, 22: 141-147.
5. B i o n d i n i M., K l e i n D.A., R e d e n t e E.F. Carbon nitrogen losses through root exudation Agropyron cristatum, A. smithii and Bouteloua gracilis. Soil Biol. Biochem., 1988, 20: 477-482.
6. И в а н о в В.П. Растительные выделения и их значение в жизни фитоценозов М., 1973.
7. R o v i r a A.D.Plant root exudates. Bot. Rev., 1969, 35: 35-57.
8. H a l e M.G., M o o r e L.D., G r i f f i n G.J. Root exudates and exudation. In: Interaction between non-pathogenic soil microorganisms and plants /Y.R. Dommergues, S.V. Krupa (eds.). Amsterdam, 1978: 163-203.
9. L y n c h J.M., W h i p p s J.M.Substrate flow in rhizosphere. Plant and Soil, 1990, 129: 1-10.
10. V a n c u r a V., H o v a d i k A. Root exudates of plants. II. Composition of root exudates of some vegetables. Plant and Soil, 1965, 22: 21-32.
11. V a n c u r a V., H a n z l i k o v a A.Root exudates of plants. IV. Differences in chemical composition of seed and seedlings exudates. Plant and Soil, 1972, 36: 271-282.
12. V a n c u r a V., S t o t z k y G. Gaseous and volatile exudates from germinating seeds and seedlings. Canad. J. Bot., 1976, 54: 518-532.
13. F o l m a n L.B., P o s t m a J., V a n V e e n J.A. Ecophysiological characterization of rhizosphere bacterial communities at different root locations and plant developmental stages of cucumber grown on rockwool. Microbiol. Ecol., 2001, 42: 586-597.
14. B r o e c k l i n g C., B r o z A., B e r g e l s o n J. e.a. Root exudates regulate soil fungal community composition and diversity. App. Environ. Microbiol., 2008, 74(3): 738-744.
15. B a i s H.P., W e i r T.L., P e r r y L.G. e.a. The role of root exudates in rhizosphere interactions with plants and other organisms. Annu. Rev. Plant Biol., 2006, 57: 233-266.
16. Т и х о н о в и ч И.А., П р о в о р о в Н.А. Симбиозы растений и микроорганизмов: молекулярная генетика агросистем будущего. СПб, 2009.
17. V a n c u r a V., P r i c r y l Z., K a l a c h o v a L. e.a. Some quantitative aspects on root exudation: Soil organisms as components of ecosystems. Ecological Bulletins (Stockholm), 1977, 25: 381-386.
18. B o w e n G.D. Misconceptions, concepts and approaches in rhizosphere biology. In: Contemporary microbial ecology /D.C. Ellwood, J.N. Hedger e.a. (eds.). London, 1980: 283-304.
19. M e h a r g A.A., K i l l h a m K. Loss of exudates from the roots of perennial ryegrass inoculated with a range of microorganisms. Plant and Soil, 1995, 170: 345-349.
20. P h i l l i p s D.A., F o x C.T., K i n g M.D., B h u v a n e s w a r i T.V., T e u b e r L.R. Microbial products trigger amino acid exudation from plant roots. Plant Physiol., 2004, 136: 2887-2894.
21. M o o r e J.C., M c C a n n K., S e t ä l ä H. e.a. Top-down is bottom-up: does predation in the rhizosphere regulate aboveground dynamics? Ecology,84: 846-857.
22. К о с т ы ч е в С.П. Избранные труды по физиологии и биохимии микроорганизмов. Т. II. М., 1956: 384.
23. R e n g e l Z. Genetic control of root exudation. Plant and Soil, 2002, 245: 59-70.
24. Z h a n g F., D a s h t i N., H y n e s R.K. e.a. Plant growth-promoting rhizobacteria and soybean [(Glycine max (L.) Merr.] growth and physiology at suboptimal root zone temperatures. Ann. Bot., 1997, 79: 243-249.
25. B a s e t M i a M.A., S h a m s u d d i n Z.H., W a h a b Z. e.a.. The effect of rhizobacterial inoculation on growth and nutrient accumulation of tissue-cultured banana plantlets under low N-fertilizer regime. African J. Biotechnol., 2009, 8(21): 5855-5866.
26. К р а в ч е н к о Л.В., А з а р о в а Т.С., Д о с т а н к о О.Ю. Влияние корневых экзометаболитов пшеницы с различной плоидностью генома на рост Azospirillumbrasilense. Микробиология, 1993, 62(5): 863-868.
27. L u g t e n b e r g B.J.J., K r a v c h e n k o L.V., S i m o n s M. Tomato seeds and root exudate sugars: composition, utilization by Pseudomonas biocontrol strains and role in rhizosphere colonization. Environ. Microbiol., 1999, 1: 439-445.
28. К р а в ч е н к о Л.В., А з а р о в а Т.С., Л е о н о в а - Е р к о Е.И. и др. Корневые выделения томатов и их влияние на рост и антифунгальную активность штаммов Pseudomonas. Микробиология, 2003, 72(1): 48-53.
29. Ш т а р к О.Ю., Ш а п о ш н и к о в А.И., К р а в ч е н к о Л.В. Продуцирование антифунгальных метаболитов Pseudomonaschlororaphis при росте на различных источниках питания. Микробиология, 2003, 72(5): 645-650.
30. С т р у н н и к о в а О.К., В и ш н е в с к а я Н.А., Б о р о д и н а Е.В. и др. Влияние целлюлозы на развитиеFusariumculmorum в ризосфере и ризоплане ячменя и интенсивность проявления корневой гнили. Микология и фитопатология, 2008, 42(6): 68-74.
CHARACTERIZATION OF THE ROOT EXSUDATES IN PLANT SPECIES AND ITS CHANGES IN RHIZOSPHERE UNDER THE INFLUENCE OF SOIL MICROORGANISMS
L.V. Kravchenko, A.I. Shaposhnikov, N.M. Makarova, T.S. Azarova, K.A. L’vova, I.I. Kostyuk, I.A. Tikhonovich
Composition and quantitative characteristics of root exudates, i.e. organic acids and sugars, were estimated in rhizoshpere of tomato and cucumber plants, and different wheat genotypes. It is shown that the content of these compounds is stably high in vegetables inoculated with Pseudomonas chlororaphis strain SPB1217. The role of rhizosphere microorganisms in plant physiology is discussed, and breeding the plants with the specified composition of root exudates to increase the productivity of agrocenosis is considered.
Keywords: root exudates, exudation, rhizobacteria, rhizosphere.
ГНУ Всероссийский НИИ сельскохозяйственной |
Поступила в редакцию |













