УДК 631.52:582.736:581.557:579.64:[575+577.2
ВЗАИМОДЕЙСТВИЕ БОБОВЫХ С ПОЛЕЗНЫМИ ПОЧВЕННЫМИ МИКРООРГАНИЗМАМИ: ОТ ГЕНОВ РАСТЕНИЙ К СОРТАМ
А.Ю. БОРИСОВ1, О.Ю. ШТАРК1, В.А. ЖУКОВ1, Т.А. НЕМАНКИН1, Т.С. НАУМКИНА2, А.Г. ПИНАЕВ1, Г.А. АХТЕМОВА1, В.А. ВОРОШИЛОВА1, Е.С. ОВЧИННИКОВА1, Т.С. РЫЧАГОВА1, В.Е. ЦЫГАНОВ1, А.И. ЖЕРНАКОВ1, Е.В. КУЗНЕЦОВА1, О.А. ГРИШИНА1, А.С. СУЛИМА1, Я.В. ФЕДОРИНА1, В.К. ЧЕБОТАРЬ1, Т. БИССЕЛИНГ3, Ф. ЛЕМАНСО4, В. ДЖИАНИНАЗЗИ-ПИРСОН4, П. РАТЭ5, Х. САНХУАН6, Й. СТОУГААРД7, Г. БЕРГ8, К. МАКФИ9, Н. ЭЛЛИС10, И.А. ТИХОНОВИЧ1
Обобщен многолетний опыт изучения азотфиксирующего симбиоза (АФС), арбускулярной микоризы (АМ) и ассоциаций с полезными ризосферными бактериями. Дана фенотипическая классификация симбиотических мутантов на примере гороха посевного (Pisum sativum L.). Разработаны методы идентификации и клонирования симбиотических генов. Продемонстрирована возможность повышения продуктивности бобовых за счет инокуляции комплексом полезных почвенных микроорганизмов. Согласно предложенной концепции генетическую систему бобовых, контролирующую взаимодействие с различными формами полезных микроорганизмов, следует рассматривать как универсальную и функционально целостную. Предложена методология селекции бобовых на повышение симбиотического потенциала для адаптивного растениеводства.
Ключевые слова: бобовые, арбускулярная микориза, азотфиксирующий симбиоз, бактерии, стимулирующие рост растений, симбиотические гены растений, селекция растений, адаптивное растениеводство.
Бобовые растения способны формировать мутуалистические симбиозы с необычайно широким спектром почвенных микроорганизмов. Азотфиксирующий симбиоз (АФС) с клубеньковыми бактериями (ризобиями) уникален для бобовых, они также образуют арбускулярную микоризу (АМ) с почвенными грибами (Glomeromycota) и, кроме того, подобно многим другим растениям вступают в ассоциативные симбиозы с ростстимулирующими ризосферными бактериями (plant growth-promoting rhizobacteria — PGPR): азоспириллами, бациллами, сапрофитными псевдомонадами, агробактериями, эрвиниями, ксантомонадами и др. АФС от остальных симбиозов отличается высокой специфичностью: определенные виды/штаммы клубеньковых бактерий образуют совместимые пары лишь с определенными родами/видами/генотипами бобовых, на корнях у которых формируются специализированные структуры — клубеньки, содержащие N2-фиксирующие бактерии (1). Благодаря этому бобовые растения успешно растут в бедных азотом почвах, значительно обогащая их и внося решающий вклад в азотный баланс наземных экосистем и агроценозов (2). Арбускулярная микориза — менее специфичный симбиоз, чем АФС, и ее способны формировать большинство видов наземных растений (80-90 %). Структурно-функциональная единица симбиоза, обеспечивающая обмен метаболитами между партнерами (арбускула), находится внутри растительной клетки и представляет собой сильно разветвленный концевой участок гифы гриба АМ (3). АМ улучшает водный статус растения, снабжает необходимыми элементами минерального питания (преимущественно труднодоступным фосфором и азотом), повышает устойчивость к фитопатогенам и тяжелым металлам (3, 4). Кроме того, микоризные грибы участвуют в улучшении структуры и повышении плодородия почвы (5, 6). АМ и АФС — эндосимбиозы, то есть микросимбионт проникает в ткани корня растения-хозяина. Для этих симбиозов характерна высокая степень генетической и метаболической интеграции партнеров (7, 8). Их развитие включает ряд четко взаимосвязанных и скоординированных молекулярных и клеточных процессов у партнеров с постоянным обменом сигналами между ними (3, 9-11).
Для ассоциативных симбиозов с PGPR характерна преимущественная локализация микроорганизмов в ризосфере и ризоплане, специализированные симбиотические структуры нетипичны, видо- или штаммоспецифичного взаимодействия не происходит. PGPR стимулируют развитие растений либо непосредственно (синтезируемые гормоны и улучшение минерального питания, в том числе при N2-фиксации), либо опосредованно — благодаря повышению устойчивости растений к стрессам и «биоконтроля» фитопатогенов (12, 13).
В настоящее время активно разрабатываются препараты на основе симбиотических микроорганизмов для поддержания естественного плодородия почвы, биологического разнообразия в фитоценозах, уменьшения антропогенной нагрузки на среду и повышения качества сельскохозяйственных продуктов (5, 14, 15). Бобовые, обладающие разнообразной симбиотической активностью, представляются лучшими моделями для исследования процессов в ризосфере и их генетического контроля растением при симбиозе. Традиционным объектом служит, в частности, горох посевной (PisumsativumL.). Во Всероссийском НИИ сельскохозяйственной микробиологии (ВНИИСХМ) создана уникальная коллекция образцов гороха (свыше 300) (http://www.arriam.spb.ru/eng/lab9/collections/). Здесь проблему изучают более 25 лет. Горох — одна из важнейших бобовых культур в мире (используется для производства пищевых продуктов, кормов и в севооборотах различной сложности) (16, 17), поэтому исследования его симбиотических систем актуальны не только в фундаментальном, но и в прикладном аспекте (развитие сбалансированных адаптивных систем земледелия и защита окружающей среды).
Г е н е т и ч е с к и е о с н о в ы р а з в и т и я э н д о с и м б и о з о в
б о
б о в ы х. Для идентификации генов бобовых, вовлеченных в развитие и функционирование симбиозов, используют экспериментальный мутагенез (позволяет идентифицировать однокопийные регуляторные sym-гены) и исследование дифференциальной экспрессии генов (как правило, выявляет семейства генов, кодирующих ферменты и структурные молекулы, составляющие «молекулярную машину» симбиоза).
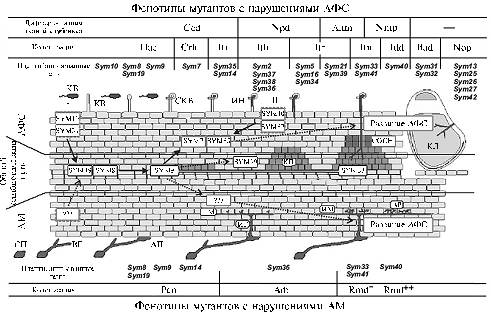
С помощью экспериментального мутагенеза бобовых получают мутанты с нарушениями различных стадий симбиоза (чаще всего в АФС, поскольку такие растения достаточно легко обнаружить по неспособности расти в отсутствие связанного азота). Фенотипический и комплементационный анализ мутантов у различных бобовых растений уже позволил идентифицировать более 100 генов, ответственных за развитие клубенька (7, 18-20). С использованием этого подхода показано, что АФС у гороха (P. sativum) контролируют около 40 регуляторных генов, причем 3 из них выявлены во ВНИИСХМ (20). На основе собственных исследований фенотипических характеристик у мутантов гороха, а также анализа данных литературы (20-22) мы разделили процесс развития АФС на две подпрограммы (рис. 1). Первая (развитие инфекции) включает скручивание корневого волоска (Hac), колонизацию кармана, образованного скрученным корневым волоском (Crh), инициацию роста инфекционной нити (Iti), рост и развитие инфекционной нити в клетке корневого волоска (Ith), рост и развитие инфекционной нити в ткани корня (Itr), рост и развитие инфекционной нити в ткани молодого клубенька (Itn), дифференцировку «инфекционной капли» (эндоцитоз бактерий и формирование симбиосом) (Idd), дифференцировку бактероидов (Bad) и структурно-функциональную стабилизацию клубеньков (Nop) (соответственно i-x стадии). Вторая подпрограмма (органогенез клубенька) охватывает деление клеток внутренней коры корня (Ccd), развитие клубенькового примордия (Npd), дифференцировку апикальной меристемы клубенька (Anm), стабилизацию меристемы клубенька (Nmp) (соответственно I-iv стадии).
|
Рис. 1. Схема развития азотфиксирующего симбиоза (АФС) и арбускулярной микоризы (АМ): КБ — клубеньковая бактерия, КВ — корневой волосок, СКВ — скручивание корневого волоска, ИН — инфекционная нить, КП — клубеньковый примордий, КЛ — клубенек, СП — спора гриба АМ, ВГ — ветвление гифы, АП — аппрессорий, ИГ — инфекционная (колонизирующая) гифа, ИМ — интрарадикальный мицелий, АР — арбускула; I и II — соответственно первичная и вторичная рецепция Nod-фактора (описание см. в тексте). |
Генетический анализ формирования АМ более трудоемкий из-за отсутствия селективных сред для отбора растительных мутантов с нарушениями ее развития. Грибы АМ как экспериментальные объекты также сложны: у них отсутствует половой процесс, они гетерокариотичны и являются облигатными биотрофами (3). Поэтому одним из наиболее продуктивных способов идентификации генов, участвующих в формировании АМ, служит анализ растительных мутантов с нарушениями развития АФС (7), что позволяет выявить общие для развития АФС и АМ гены (у гороха их обнаружено 8) (см. рис. 1). Описаны по крайней мере три стадии развития АМ (20) (см. рис. 1): рост инфекционной (колонизирующей) гифы из апрессория и проникновение в корень (Myc1 или Pen), развитие арбускул (Myc2 или Arb) и динамика развития АМ (Rmd- и Rmd++). Недавно в результате прямого скрининга были выявлены первые мутанты у бобового растения Medicago truncatula Gaertn., несущие мутации в двух не известных ранее генах, контролирующих развитие АМ, но не АФС, с нарушениями самых ранних стадий развития симбиоза (23, 24). Они интересны прежде всего тем, что эти мутации, скорее всего, уникальны для АМ. С целью идентификации новых генов гороха, контролирующих развитие АМ, во ВНИИСХМ начат прямой скрининг мутантов с использованием инокуляционной системы на основе шнитт-лука (Allium schoenoprasum L.) как растения — донора грибов АМ (25), предварительно адаптированной к изучаемой культуре и местным условиям. В результате получены перспективные линии гороха с предполагаемыми мутациями в генах, вовлеченных только в контроль развития АМ (26).
Ф и з и о л о г и ч е с к а я и б и о х и м и ч е с к а я р о л ь
с и м б и о т и
ч е с к и х г е н о в г о р о х а. Идентифицированные в результате экспериментального мутагенеза гены являются регуляторными, что было подтверждено методами молекулярной генетики с использованием модельных бобовых лядвенца японского Lotus japonicus (Regel.) K. Larsen и люцерны слабоусеченной Medicago truncatula Gaertn.
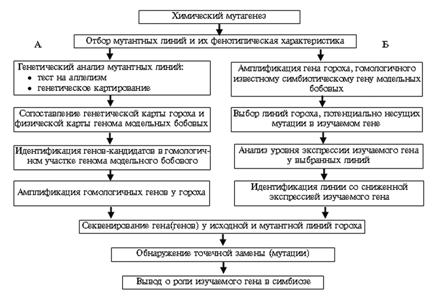
Во ВНИИСХМ разработана методология клонирования симбиотических генов гороха (рис. 2), основанная на гомологии генов у гороха, лядвенца и люцерны, а также на макро- и микросинтении геномов (коллинеарное расположение генов на определенных участках хромосом) у этих видов. Наиболее эффективно последовательности симбиотических генов гороха идентифицируются по гомологии с известными нуклеотидными последовательностями у модельных бобовых растений (см. рис. 2, А). Для генетического картирования в геноме гороха создан набор молекулярных CAPS маркеров (сleaved amplified polymorphic sequence — расщепленные амплифицированные полиморфные последовательности), представляющих собой фрагменты последовательностей экспрессирующихся генов (27). Особенность этих маркеров — амплификация фрагмента определенного гена и расщепление только одной из его аллелей специфичной эндонуклеазой (28). С применением такого подхода авторами клонированы и секвенированы четыре симбиотических гена гороха. Гены Sym37 и K1, участвующие в сигнальных взаимодействиях с клубеньковыми бактериями, клонированы на основании их гомологии с геном NFR1 лядвенца японского (29), гены Coch и Sym33, ответственные за органогенез клубенька и развитие поздних стадий АФС, — благодаря гомологии с генами NOOT и IPD3 люцерны слабоусеченной (30, 31).
|
Рис. 2. Схема клонирования симбиотических генов гороха посевного с использованием двух методологических подходов — классической (А) и обратной (Б) генетики (описание см. в тексте). |
Позиция многих генов гороха на генетической карте неизвестна, и не удается сделать предположение об их возможной гомологии с известными генами модельных бобовых. Для клонирования таких генов разработан альтернативный подход (см. рис. 2, Б), исключающий этап картирования изучаемого гена, что существенно экономит время, и основанный на анализе уровня экспрессии генов-кандидатов у мутантов и соответствующих линий гороха дикого типа.
В результате изучения последовательностей регуляторных симбиотических генов гороха были определены их предполагаемые белковые продукты. Значительная часть этих генов относится к общему симбиотическому сигнальному пути (сommon symbiotic pathway — CSP) (32) и регулирует развитие как АФС, так и АМ (8) (см. рис. 1). Возможно построение следующей обобщенной модели развития АФС у гороха (см. рис. 1): комплекс рецепторных киназ SYM10 + SYM37 (29) воспринимает структуру бактериальной сигнальной молекулы (Nod-фактора) и активирует киназу SYM19 (33), что при участии катионного канала SYM8 (34) приводит к выбросу ионов кальция из внутриклеточных депо и генерации так называемых кальциевых волн (35). Эти волны воспринимаются кальций/кальмодулин-зависимой киназой SYM9 (36), которая совместно с белком SYM33 (37) активирует экспрессию последующих симбиотических генов, кодирующих транскрипционные факторы SYM7 (37) и SYM35 (38). Действие последних приводит к изменениям в транскрипции генов в клетках корней гороха и формированию клубеньков, на активность меристем которых влияет анкирин-содержащий белковый регулятор COCH (30). Рецепторная киназа SYM29 (39), вовлеченная в системную регуляцию симбиоза, контролирует число образующихся клубеньков в зависимости от азотного статуса растения.
Молекулярные основы развития АМ изучены слабее: пока не идентифицированы растительные рецепторы, распознающие сигнальные молекулы гриба. Однако известно, что дальнейшая передача сигнала происходит через тот же общий симбиотический сигнальный путь (CSP), что и в случае образования АФС (40). Интересно, что частота и амплитуда генерируемых кальциевых волн различаются в случае АФС или АМ, причем кальций/каль-модулин-зависимая киназа SYM9 распознает эти различия и активирует экспрессию генов, соответствующих определенному типу симбиоза (40). Кроме того, упомянутая выше рецепторная киназа SYM29 также контролирует развитие АМ на системном уровне (39).
Новейшими методами транскриптомики обнаружены несколько сотен геновM. truncatula — нодулинов (41) и микоризинов (42), активируемых на разных стадиях развития АФС и АМ (43). Индукция приблизительно 100 из них, названных симбиозинами (43), наблюдалась при функционировании обоих симбиозов. Предполагается, что гены, индуцируемые совместно, могут быть связаны с различными функциями клетки, необходимыми для симбиотической эффективности, например с активным транспортом через перисимбиотические мембраны, окружающие бактероиды и арбускулы (43). С использованием ряда симбиотических мутантов и клубеньковых бактерий, маркированных репортерными генами, было показано, что Sym-гены гороха регулируют экспрессию бактериальных симбиотических генов (44, 45). Также недавно продемонстрировано, что некоторые из Sym-генов гороха регулируют экспрессию грибных генов при развитии АМ (46). Таким образом, геномы макро- и микросимбионта функционально интегрируются в надорганизменную систему, причем геном растения играет в ней ведущую роль.
Несмотря на отсутствие видимой анатомической дифференциации в ассоциациях растений с PGPR, в развитие таких ассоциаций вовлечен ряд молекулярных механизмов, характерных для АМ и АФС (7, 8, 12, 47). В частности, у люцерны (M. truncatula) при взаимодействии с псевдомонадами индуцируются гены микоризинов, и в этом процессе задействован ген общего симбиотического пути DMI3 (48), гомологичный гену Sym9 гороха (36).
П е р с п е к т и в ы и с п о л ь з о в а н и я с и м б и о з о в б о б о-
в ы х в с е л ь с к о х о з я й с т в е н н о й п р а к т и к е. Обнаружение общих генов и молекулярных продуктов, необходимых для формирования АФС и АМ (42, 43), привело к заключению, что бобовые обладают единой генетической системой, контролирующей развитие многостороннего симбиоза (бобовое растение + грибы АМ + полезные ризосферные/клубеньковые бактерии). Этот факт наряду с предположением, что генетическая система растения, контролирующая развитие АФС, эволюционно базировалась на системе контроля формирования АМ (49), очень важен для использования симбиотических систем бобовых в адаптивном сельском хозяйстве.
Вегетационные эксперименты и серии полевых испытаний с привлечением образцов из мировой коллекции гороха Всероссийского НИИ растениеводства им. Н.И. Вавилова (ВИР, г. Санкт-Петербург), а также коммерческих сортов и селекционных линий, созданных без учета симбиотического потенциала, продемонстрировали возможность использования симбиотического потенциала растений в сельскохозяйственном производстве с целью уменьшения доз минеральных удобрений и химических средств защиты растений. У гороха была выявлена высокая степень генетического полиморфизма по симбиотической эффективности и найдены генотипы с максимальной эффективностью. При эффективном симбиозе комплексная инокуляция оказывала действие, эквивалентное применению полной дозы минеральных удобрений (50-52). Установлено, что у этой культуры симбиотическая эффективность — признак с высокой степенью наследуемости (53). В серии полевых экспериментов доказана успешность применения препарата ассоциативных бактерий экстрасол (15) под бобовые, а также преимущества «тройной» инокуляции с экстрасолом перед «двойной» инокуляцией только клубеньковыми бактериями и грибами АМ. Разработана технология производства комплексного микробиологического препарата бисолбимикс, содержащего высокоэффективные штаммы и изоляты грибов АМ, клубеньковых бактерий и полезных ризосферных бактерий из коллекции ВНИИСХМ (54). В полевых условиях показана высокая эффективность этого препарата при применении под бобовые и небобовые культуры. Создан стационарный селекционный питомник для отбора растений, проявляющих высокую симбиотическую эффективность, организованный по принципу шестипольного севооборота во избежание размножения патогенной микрофлоры (на базе Всероссийского НИИ зернобобовых и крупяных культур), где в течение по крайней мере 5 лет в почву не вносили минеральные удобрения (для инокуляции применяется бисолбимикс). С использованием питомника и предложенного протокола селекции создан и в 2007 году передан на государственные сортоиспытания первый сорт гороха Триумф с повышенным симбиотическим потенциалом (7, 55). При традиционной технологии возделывания его продуктивность не ниже стандартов по Орловской области, а при инокуляции препаратом бисолбимикс она возрастает на 10 %. В настоящее время с привлечением образцов из коллекции ВИР в питомнике продолжается поиск генотипов фасоли (Phaseolus vulgaris L.) и чечевицы (Lens culinaris Medik.) (56), высокоэффективных в симбиозе с полезной почвенной микрофлорой.
Итак, изучение генетического контроля мутуалистических симбиозов, образуемых бобовыми растениями с микроорганизмами (арбускулярная микориза, N2-фиксирующий симбиоз и ассоциации с ростстимулирующими ризосферными бактериями), привело к созданию системы знаний об их формировании и функционировании. Ее центральное положение — факт существования общих генов, вовлеченных в развитие перечисленных типов симбиозов. Значительный прогресс в молекулярной биологии, сравнительной генетике и геномике бобовых растений позволил перейти от изучения структуры и функций генетической системы бобовых, контролирующей развитие мутуалистических симбиозов, к их активному внедрению в практику сельского хозяйства. Авторами сформулирована концепция инновационного подхода к селекции бобовых культур. Он основан на положении, что для управления процессами в агро- и природных фитоценозах необходимо рассматривать совокупность симбиозов бобовых как единую систему, где геном растения, который изменяется медленнее, чем геномы микроорганизмов, играет организующую роль. При этом генетическая система бобовых, контролирующая эти симбиозы, должна рассматриваться как универсальная, функционально целостная и подвергаться селекции по интегральному признаку «эффективность взаимодействия с полезными почвенными микроорганизмами». Селекцию растений на повышение симбиотического потенциала взаимодействия с полезной почвенной микрофлорой необходимо проводить на фоне ее максимального генетического разнообразия, а главными селекционными признаками считать дополнительную биомассу растения, накопленную за счет образования взаимовыгодной растительно-микробной системы, и качество получаемой продукции, в первую очередь белка. Созданные при таком подходе сорта будут наиболее эффективно использовать симбиотические взаимодействия. Разработка системы адаптивного растениеводства согласуется с данными экспертов Евросоюза (http://www.grainlegumes.com/aep/) о глобальной пользе применения бобовых (снижение потребления невозобновляемых ресурсов, негативного влияния на окружающую среду, потребности в минеральных удобрениях и химических средствах защиты растении, повышение биоразнообразия, плодородия почв, качества продукции, обеспечение более стабильных доходов производителей).
Л И Т Е Р А Т У Р А
1. S p r e n t J.I. Nodulation in legumes. Kew, UK, 2001.
2. V a n c e C.P. Symbiotic nitrogen fixation and phosphorous acquisition. Plant nutrition in the world of declining renewable resources. Plant Physiol., 2001, 127: 390-397.
3. S m i t h S.E., R e a d D.J. Mycorrhizal symbiosis.. London, UK, 2008.
4. H i l d e b r a n d t U., R e g v a r M., B o t h e H. Arbuscular mycorrhiza and heavy metal tolerance. Phytochemistry, 2007, 68: 139-146.
5. C e l i k I., O r t a s I., K i l i c S. Effects of compost, mycorrhiza, manure and fertilizer on some physical properties of a Chromoxerert soil. Soil Tillage Research, 2004, 78(1): 59-67.
6. R i l l i g M.C. Arbuscular mycorrhizae, glomalin and soil aggregation. Can. J. Soil Sci., 2004, 84: 355-363.
7. P r o v o r o v N.A., S h t a r k O.Y., Z h u k o v V.A. e.a. Developmental genetics of plant-microbe symbioses. N.Y., USA, 2010.
8. S h t a r k O.Y., B o r i s o v A.Y., Z h u k o v V.A. e.a. Intimate associations of beneficial soil microbes with the host plants. In: Soil microbiology and sustainable crop production /G.R. Dixon, E.L. Tilston (eds.). Dordrecht, The Netherlands, 2010: 119-196.
9. B r e w i n N.J. Plant cell wall remodeling in the Rhizobium-legume symbiosis. Crit. Rev. Plant. Sci., 2004, 23: 1-24.
10. J o n e s K.M., K o b a y a s h i H., D a v i e s B.W. e.a. How rhizobial symbionts invade plants: the Sinorhizobium-Medicago model. Nat. Rev. Microbiol., 2007, 5: 619-633.
11. G e n r e A., C h a b a u d M., F a c c i o A. e.a. Prepenetration apparatus assembly precedes and predicts the colonization patterns of arbuscular mycorrhizal fungi within the root cortex of both Medicago truncatula and Daucus carota. Plant Cell, 2008, 20: 1407-1420.
12. Молекулярные основы взаимоотношений ассоциативных микроорганизмов с растениями /Под ред. В.В. Игнатова. М., 2005.
13. B l o e m b e r g G.V., L u g t e n b e r g B.J.J. Molecular basis of plant growth promotion and biocontrol by rhizobacteria. Curr. Opin. Plant Biol., 2001, 4: 343-350.
14. Г о р а л ь В.М., Л а п п а Н.В., Г о р а л ь С.В. и др. Инсектофунгицидный препарат гаупсин на основе штаммов Pseudomonasaureofaciens. Прикладная биохимия и микробиология, 1999, 35(5): 596-598.
15. Биопрепараты в сельском хозяйстве /Под ред. И.А. Тихоновича, Ю.В. Круглова. М., 2005.
16. G r a h a m P.H., V a n c e C.P. Legumes: importance and constraints to greater use. Plant Physiol., 2003, 131: 872-877.
17. Food and agriculture organization of the United Nations (FAO). FAOSTAT, 2008. http://faostat.fao.org.
18. M a o C., Q i u J., W a n g C. e.a. NodMutDB: a database for genes and mutants involved in symbiosis. Bioinformatics, 2005, 21(12): 2927-2929.
19. S a n d a l N., P e t e r s e n T.R., M u r r a y J. e.a. Genetics of symbiosis in Lotus japonicus: recombinant inbred lines, comparative genetic maps, and map position of 35 symbiotic loci. Mol. Plant Microbe Interact., 2006, 19(1): 80-91.
20. Б о р и с о в А.Ю., В а с и л ь ч и к о в А.Г., В о р о ш и л о в а В.А. и др. Регуляторные гены гороха посевного (Pisum sativum L.), контролирующие развитие азотфиксирующих клубеньков и арбускулярной мико-ризы: фундаментальные и прикладные аспекты. Прикладная биохимия и микробиология, 2007, 43(3): 265-271.
21. G u i n e l F.C., G e i l R.D. A model for the development of the rhizobial and arbuscular mycorrhizal symbioses in legumes and its use to understand the roles of ethylene in the establishment of these two symbioses. Can. J. Bot., 2002, 80: 695-720.
22. V o r o s h i l o v a V.A., D e m c h e n k o K.N., B o r i s o v A.Y. e.a. Functioning of Pisum sativum genes Sym33, Sym40 and Sym41 with respect to coordinated infection thread and meristem development in symbiotic root nodules. New Phytol., 2009, 181(4): 913-923.
23. M a r s h J.F., S h u l t z e M., O l d r o y d G.E.F. Isolation and analysis of Medicago truncatula mutants defective in the arbuscular mycorrhizal symbiosis. Handbook & Abstracts of 3rd Int. Conf. on legume genomics & genetics. Brisbane, Australia, 2006: 52.
24. M a r s h J.F., G o b b a t o E., S c h u l t z e M.e.a. Ram1 and Ram2: signaling specificity in mycorrhizal symbiosis. Abstract Book of 8th European Nitrogen Fixation Conf. Gent, Belgium, 2008: 26.
25. R o s e w a r n e G., B a r k e r S.L., S m i t h S.E. Production of near synchronous colonisation in tomato for developmental and molecular analysis of mycorrhiza. Mycol. Res., 1997, 101: 966-970.
26. S h t a r k O.Y., O v c h i n n i k o v a E.S., Z h u k o v V.A. e.a. Isolation of pea (Pisum sativum) mutants impaired in arbuscular mycorrhiza development, using a direct screening. Pisum Genetics, 2007, 39: 26-27.
27. Ж у к о в В.А., Н е м а н к и н Т.А., О в ч и н н и к о в а Е.С. и др. Создание серии геноспецифичных молекулярных маркеров для сравнительного картирования геномов гороха посевного (PisumsativumL.) и диплоидной люцерны (MedicagotruncatulaGaertn.). В сб.: Фактори експериментальної еволюцii органiзмiв: зб. наук. пр. НАН України, АМН України, Укр. т-во генетикiв i селекционерiв iм. М.I. Вавилова. T. 9 /Под ред. В.А. Кунах. Киев, 2010: 30-34.
28. K o n i e c z n y A., A u s u b e l F.M. A procedure for mapping Arabidopsis mutations using co-dominant ecotype-specific PCR-based markers. Plant Journal, 1993, 4(2): 403-410.
29. Z h u k o v V.A., R a d u t o i u S., M a d s e n L.H. e.a. The pea Sym37 receptor kinase gene controls infection thread initiation and nodule development. Mol. Plant Microbe Interact., 2008, 21(12): 1600-1608.
30. Ж у к о в В.А., Р ы ч а г о в а Т.С., С у л и м а А.С. и др. Ген Cochleata у Pisum sativum L. и его ортолог NOOT у MedicagotruncatulaGaertn. контролируют судьбу меристемы азотфиксирующих клубеньков. Тез. докл. 14-й Пущинской межд. школы-конференции молодых ученых «Биология — наука XXI века». Пущино, 2010, 2: 135.
31. O v c h i n n i k o v a E., L i m p e n s E., B o r i s o v A. e.a. Intracellular accommodation of Rhizobium bacteria is controlled by the common symbiotic signaling pathway. Abstract book of the 9th European Nitrogen Fixation Conf. Geneva, Switzerland, 2010: 214.
32. B a n b a M., G u t j a h r C., M i y a o A. e.a. Divergence of evolutionary ways among common sym genes: CASTOR and CCaMK show functional conservation between two symbiosis systems and constitute the root of a common signaling pathway. Plant Cell Physiol., 2008, 49: 1659-1671.
33. E n d r e G., K e r e s z t A., K e v e i Z. e.a. A receptor kinase gene regulating symbiotic nodule development. Nature, 2002, 417: 962-966.
34. E d w a r d s A., H e c k m a n n A.B., Y o u s a f z a i F. e.a. Structural implications of mutations in the pea SYM8 symbiosis gene, the DMI1 ortholog, encoding a predicted ion channel. Mol. Plant Microbe Interact., 2007, 20: 1183-1191.
35. O l d r o y d G.E., D o w n i e J.A. Calcium, kinases and nodulation signalling in legumes. Nat. Rev. Mol. Cell Biol., 2004, 5(7): 566-576.
36. L é v y J., B r e s C., G e u r t s R. e.a. A putative Ca2+ and calmodulin-dependent protein kinase required for bacterial and fungal symbioses. Science, 2004, 303(5662): 1361-1367.
37. K a l o P., G l e a s o n C., E d w a r d s A. e.a. Nodulation signaling in legumes requires NSP2, a member of the GRAS family of transcriptional regulators. Science, 2005, 308(5729): 1786-1789.
38. B o r i s o v A.Y., M a d s e n L.H., T s y g a n o v V.E. e.a. The Sym35 gene required for root nodule development in pea is an ortholog of Nin from Lotus japonicus. Plant Physiology, 2003, 131: 1009-1017.
39. K r u s e l l L., M a d s e n L.H., S a t o S. e.a. Shoot control of root development and nodulation is mediated by a receptor-like kinase. Nature, 2002, 420(6914): 422-426.
40. O l d r o y d G.E., D o w n i e J.A. Coordinating nodule morphogenesis with rhizobial infection in legumes. Annu. Rev. Plant. Biol., 2008, 59: 519-546.
41. V a n K a m m e n A. Suggested nomenclature for plant genes involved in nodulation and symbiosis. Plant. Mol. Biol. Rep., 1984, 2: 43-45.
42. G i a n i n a z z i - P e a r s o n V. Plant cell responses to arbuscular mycorrhizal fungi: getting to the roots of the symbiosis. Plant Cell, 1996, 8: 1871-1883.
43. K ü s t e r H., V i e w e g M.F., M a n t h e y K. e.a. Identification and expression regulation of symbiotically activated legume gene. Phytochemistry, 2007, 68: 8-18.
44. V o r o s h i l o v a V.A., B o e s t e n B., T s y g a n o v V.E. e.a. Effect of mutations in Pisum sativum L. genes (sym13, sym31, sym33, sym40) blocking different stages of nodule development on the expression of late symbiotic genes in Rhizobium leguminosarum bv. viciae. Mol. Plant-Microbe Interact., 2001, 14(4): 471-476.
45. T s y g a n o v V.E., V o r o s h i l o v a V.A., H e r r e r a - C e r v e r a J.A. e.a. Developmental down-regulation of rhizobial genes as a function of symbiosome differentiation in symbiotic root nodules of Pisum sativum L. New Phytol., 2003, 159: 521-530.
46. K u z n e t s o v a E., S e d d a s - D o z o l m e P.M., A r n o u l d C. e.a. Symbiosis-related pea genes modulate fungal and plant gene expression during the arbuscule stage of mycorrhiza with Glomus intraradices. Mycorrhiza, 2010, 20(6): 427-443.
47. S a n c h e z L., W e i d m a n n S., A r n o u l d C. e.a. Pseudomonas fluorescens and Glomus mosseae trigger DMI3-dependent activation of genes related to a signal transduction pathway in roots of Medicago truncatula. Plant Physiol., 2005, 139: 1065-1077.
48. P a r n i s k e M. Arbuscular mycorrhiza: the mother of plant root endosymbioses. Nature Rev. Microbiol., 2008, 6: 763-775.
49. Б о р и с о в А.Ю., Ц ы г а н о в В.Е., Ш т а р к О.Ю. и др. Каталог мировой коллекции ВИР. Вып. 728. Горох (Симбиотическая эффективность) /Под ред. И.А. Тихоновича, М.А. Вишняковой. СПб, 2002.
50. Б о р и с о в А.Ю., Н а у м к и н а Т.С., Ш т а р к О.Ю. и др. Эффективность использования совместной инокуляции гороха посевного (Pisum sativum L.) грибами арбускулярной микоризы и клубеньковыми бактериями для повышения продуктивности растений в устойчивом экологически ориентированном земледелии. Докл. РАСХН, 2004, 2: 12-14.
51. Ш т а р к О.Ю., Д а н и л о в а Т.Н., Н а у м к и н а Т.С. и др. Анализ исходного материала гороха посевного (Pisum sativum L.) для селекции сортов с высоким симбиотическим потенциалом и выбор пара-метров для его оценки. Экологческая генетика, 2006, 4: 22-28.
52. Н а у м к и н а Т.С. Селекция гороха (Pisumsativum L.) на повышение эффективности симбиотической азотфиксации. Автореф. докт. дис. Орел, 2007.
53. Ч е б о т а р ь В.К., К а з а к о в А.Е., Е р о ф е е в С.В. и др. Способ получения комплексного микробиологического удобрения. Патент РФ № 2318784, зарегистрирован 10 марта 2008 г. Приоритет изобретения 30 марта 2006 г.
54. B o r i s o v A.Y., D a n i l o v a T.N., S h t a r k O.Y. e.a. Tripartite symbiotic system of pea (Pisum sativum L.): applications in sustainable agriculture. Proc. 15th Int. Congr. on nitrogen fixation & 12th Int. Conf. of the African Association for biological nitrogen fixation «Biological nitrogen fixation: towards poverty alleviation through sustainable agriculture» /F.D. Dakora, B.M. Chimphango, A.J. Valentine e.a. (eds.). Berlin, Heidelberg, 2008: 15-17.
55. Ш т а р к О.Ю., Б о р и с о в А.Ю., Н а у м к и н а Т.С. и др. Биотехнология создания принципиально новых коммерческих сортов бобовых с повышенной эффективностью взаимодействия с полезной почвенной микрофлорой (09-04-13895-офи_ц). Мат. Всерос. науч. конф. «Ориентированные фундаментальные исследова-ния и их реализация в АПК России». М., 2010: 43-47.
INTERACTION OF LEGUMES WITH BENEFICIAL SOIL MICROORGANISMS: FROM PLANT GENES TO VARIETIES
A.Yu. Borisov1, O.Yu. Shtark1, V.A. Zhukov1, T.A. Nemankin1, T.S. Naumkina2, A.G. Pinaev1, G.A. Akhtemova1, V.A. Voroshilova1, E.S. Ovchinnikova1, T.S. Rychagova1, V.E. Tsyganov1, A.I. Zhernakov1, E.V. Kuznetsova1, O.A. Grishina1, A.S. Sulima1, Ya.V. Fedorina1, V.K. Chebotar’1, T. Bisseling3, P. Lemanceau4, V. Gianinazzi- Pearson4, P. Ratet5, J. Sanjuan6, J. Stougaard7, G. Berg8, K. McPhee9, N. Ellis10, I.A. Tikhonovich1
Long-term experience of studying genetic system of Legumes controlling development of mutually beneficial symbioses (nitrogen fixation, arbuscular mycorrhiza and associations with beneficial rhizosphere bacteria) has been summarized. With pea (Pisum sativum L.) as the object of research the phenotypic classification of pea symbiotic mutants has been given. The methods of identification and cloning of plant symbiotic genes have been developed. An opportunity to increase legume plant production by means of inoculation with the complex of beneficial microbes has been demonstrated. A new concept to consider legume genetic system controlling interactions with various beneficial microbes as universal and functionally integrated has been formulated. A methodology to breed legumes to increase the potential of interactions with beneficial soil microbes for the use of new kind of varieties in sustainable plant production has been proposed.
Keywords: legumes, arbuscular mycorrhiza, nitrogen-fixing symbiosis, plant growth-promoting bacteria, symbiotic plant genes, plant breeding, sustainable plant production.
1ГНУ Всероссийский НИИ сельскохозяйственной |
Поступила в редакцию |