doi: 10.15389/agrobiology.2019.2.378rus
УДК 636.2:619:57.083:577.2
ДИФФЕРЕНЦИАЦИЯ Mycoplasma bovis, Mycoplasma bovigenitalium, Mycoplasma californicum
И ВЫЯВЛЕНИЕ Ureaplasma diversum МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ
А.Д. КОЗЛОВА, Н.С. ГОРБАЧЕВА, Р.Ф. ХАЕРОВА, М.С. КРАСНИКОВА, Е.А. ЛАЗАРЕВА, С.П. ЯЦЕНТЮК
Микоплазмы и уреаплазмы — важные этиологические агенты маститов, пневмоний и репродуктивных нарушений у крупного рогатого скота (КРС), которые наносят значительный экономический ущерб хозяйствам. К наиболее распространенным клинически значимым видам относятся Mycoplasma bovis, M. bovigenitalium, M. californicum и Ureaplasma diversum. Существующие диагностические наборы на основе полимеразной цепной реакции (ПЦР) позволяют с высокой точностью выявлять в биологическом материале бактерии рода Mycoplasma, но не проводить видовую идентификацию. В представленной работе с помощью разработанных методик на основе ПЦР мы впервые выявили и дифференцировали патогенные виды семейства Mycoplasma taceae в образцах криоконсервированной спермы быков-производителей, используемой для искусственного осеменения в отечественных хозяйствах. Нашей целью была разработка методик для идентификации и дифференциации наиболее распространенных патогенных микоплазм (Mycoplasma bovis, M. californicum, M. bovigenitalium) и Ureaplasma diversum на основе ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени. В качестве мишеней для ПЦР были выбраны гены UvrC для M. bovis, 16S рРНК для M. bovigenitalium и U. diversum, ген rpoB для M. californicum. В методики включили систему праймеров и зондов для детекции амплификации экзогенного неконкурентного внутреннего контрольного образца (ВКО). Специфичность разработанных методик проверяли на панели образцов, содержащей вирусные и бактериальные патогены, которые вызывают заболевания у крупного рогатого скота, а также геномную ДНК коровы. Для оценки чувствительности каждой методики были разработаны положительные контрольные образцы на основе генно-инженерных конструкций, содержащих участок соответствующей специфической ДНК. Аналитическую чувствительность оценивали отдельно для каждого патогена, для чего исследовали 10-кратные разведения соответствующих контрольных образцов в отрицательных пробах биологического материала (сперма, молоко, влагалищные смывы, внутренние органы). Для разных видов материала аналитическая чувствительность составила в среднем 5×103 копий/мл. Эффективность амплификации для M. bovis составила 99 %, для M. bovigenitalium — 87 %, для M. californicum — 94 %, для U. diversum — 98 %. С помощью разработанных методик были исследованы 410 образцов спермы быков для искусственного осеменения из отечественных и зарубежных племенных центров. ДНК M. bovis была обнаружена в 2,5 % образцов из зарубежных племенных центров. В образцах спермы из отечественных хозяйств ДНК M. bovis не выявили. Положительный результат обнаружения ДНК M. bovigenitalium был получен для 60,7 % отечественных и для 25,1 % импортных образцов спермы, ДНК M. californicum обнаружили соответственно в 51,7 % и 25,1 % образцов. ДНК Ureaplasma diversum — в 55 % образцов спермы быков из российских племенных центров и в 12,1 % образцов спермы иностранного происхождения. Коинфицирование M. californicum/M. bovigenitalium выявили в 97 образцах (23,7 %), M. bovigenitalium/U. diversum — в 86 случаях (21 %). Одновременное инфицирование M. bovigenitalium, M. californicum и U. diversum отмечали в 52 образцах (24,6 %) спермы из отечественных хозяйств и в 4 образцах (2,0 %) из зарубежных племенных центров. Разработанные методики могут использоваться в ветеринарных лабораториях для совершенствования диагностики и оптимизации противоэпизоотических мероприятий, а также для мониторинга качества спермы КРС, используемой для искусственного осеменения.
Ключевые слова: Mycoplasma bovis, Mycoplasma californicum, Mycoplasma bovigenitalium, Ureaplasma diversum, ПЦР в реальном времени, быки, сперма.
Микоплазмы и уреаплазмы — важные этиологические агенты маститов, пневмоний и репродуктивных нарушений у крупного рогатого скота (КРС), которые наносят значительный экономический ущерб хозяйствам. К наиболее распространенным патогенным и клинически значимым видам относятся Mycoplasma bovis, M. bovigenitalium, M. californicum и Ureaplasma diversum (1, 2).
M. bovis — один из самых опасных патогенов, возбудитель заболеваний верхних дыхательных путей, пневмоний, отитов, артритов, маститов, эндометритов, кератоконъюнктивитов, а также других патологий у КРС (3-5). При маститной патологии на втором по распространенности месте после M. bovis находится M. californicum, которая вызывает артриты и пневмонии у молодых животных (6, 7). Вид M. bovigenitalium, который также может вызывать маститы у коров, обнаруживается в репродуктивном тракте и ассоциирован с эндометритами, бесплодием, нарушением родовой деятельности (8, 9). Показано, что M. bovigenitalium служит возбудителем некротического вульвовагинита, наносящего ущерб хозяйствам, занимающимся разведением КРС (10). Кроме того, установлена статистически значимая корреляция между присутствием этой микоплазмы в сперме быков и сниженной подвижностью сперматозоидов.
Другой представитель семейства Mycoplasmataceae — Ureaplasma diversum отличается от видов рода Mycoplasma способностью к гидролизу мочевины, но тоже ассоциирован с различными нарушениями репродуктивных функций КРС, такими как гранулярный вульвовагинит, эндометриты, сальпингиты, спонтанные аборты, бесплодие и рождение слабого потомства (11, 12).
Классическим методом выявления микоплазм считается культивирование на селективных питательных средах (13). Однако этот метод имеет ряд ограничений. Для роста микоплазм необходимы специализированные среды и микроаэрофильные условия культивирования. Исследование занимает от 7 до 10 сут. При этом рост других видов бактерий существенно затрудняет или делает невозможным точную идентификацию возбудителя.
В настоящее время при диагностике микоплазмозов широко применяется полимеразная цепная реакция (ПЦР) с родоспецифическими праймерами, позволяющая выявлять представителей рода Mycoplasma в различных образцах биологического материала за короткое время и независимо от других микроорганизмов, присутствующих в пробе. Однако использование такого подхода не позволяет дифференцировать видовую принадлежность возбудителя.
В представленной работе с помощью разработанных методик на основе ПЦР мы впервые выявили и дифференцировали патогенные виды семейства Mycoplasmataceae в образцах криоконсервированной спермы быков-производителей, используемой для искусственного осеменения в отечественных хозяйствах. Проведено сравнение обсемененности микоплазмами спермопродукции, поставляемой из отечественных и зарубежных племенных хозяйств, отмечены случаи одновременного инфицирования образцов несколькими видами микоплазм.
Нашей целью была разработка методик идентификации и дифференциации наиболее распространенных патогенных микоплазм (Mycoplasma bovis, M. californicum, M. bovigenitalium) и Ureaplasma diversumна основе полимеразной цепной реакции в режиме реального времени.
Методика. В работе использовали вагинальные смывы, молоко, паренхиматозные органы, сперму КРС и штаммы Mycoplasma bovis ATCC 25523, M. bovigenitalium ATCC 19852, M. arthritidis ATCC 19611, M. bovirhinis PG43 ATCC 27748, M. arginine G230 ATCC 23838-TTR; Histophilus somni ATCC 700025; Campylobacter fetus 25936; Brucella abortus 82; Yersinia enterocolitica серотип 03; Salmonella entericasubsp. enterica Dublin 6; Pseudomonas aeruginosa серотип 0-17; Staphylococcus aureus ВКПМВ 6646; Mycobacterium bovis AN5 2/5-69-MS-07, Mycobacterium intracellulare 13-4; Leptospira interrogans Pomona ВГНКИ-6; Bacillus cereus ВКПМ В-8076; Arcanobacterium pyogenes ATCC 8164; Neospora caninum ATCC 50977; Escherichia coli 0157:Н7; Clostridium perfringens тип С; Streptococcus pyogenes АТСС 19615; Candida albicans ATCC 10231; Aspergillus niger ATCC 16404; Enterococcus faecalis ATCC 29212; Bovine Herpesvirus 1 MBA 2; Bovine Herpesvirus ATCC-VR-845; Bovine Herpesvirus 4 DN-599ATCC-VR-631; штамм вируса диареи (ВД) КРС Ore-gon C24V; штамм ВД КРС NADL; штамм вируса парагриппа КРС ПТК 45/86; ДНК вируса нодулярного дерматита; положительный материал от КРС, содержащий РНК вируса болезни Шмалленберга.
Исследовали 410 образцов криоконсервированной спермы КРС из отечественных и зарубежных племенных центров.
Экстракцию ДНК осуществляли с использованием коммерческого набора Рибо-преп («Амплисенс», Россия). Микроорганизмы рода Mycoplasma выявляли с помощью тест-системы Мик-Ком («Амплисенс», Россия). Также в работе использовали ПЦР-набор LSI VetMAX™ Mycoplasma bovis («Thermo Fisher Scientific», Франция).
ПЦР для идентификации M. bovis, M. bovigenitalium, M. californicum и U. diversum проводили в режиме реального времени на приборах RotorGene Q («Qiagen», Германия) и CFX («Bio-Rad», США). Результаты амплификации интерпретировали на основании наличия (или отсутствия) пересечения кривой флуоресценции с пороговой линией. Реакционная смесь для амплификации содержала 10 мкл ДНК-матрицы, 10 мкл ПЦР-смеси-1 (6 мкМ специфических праймеров, 3 мкМ специфических зондов, 3 мкМ праймеров для амплификации экзогенного неконкурентного внутреннего контрольного образца — ВКО, 1,5 мкМ зонда ВКО, раствор дНТФ, деионизованная вода), 0,5 мкл Taq-F полимеразы, 5 мкл ПЦР-смеси-2-FRT («Амплисенс», Россия). Программа амплификации для M. bovis, M. californicum, M. bovigenitalium была следующей: 15 мин при 95 °C; 10 с при 95 °C, 20 с при 60 °С, 10 с при 72 °С (10 циклов без детекции флуоресцентного сигнала); 10 с при 95 °C, 20 с при 55 °С, 10 с при 72 °С (35 циклов с детекцией флуоресцентного сигнала). Программа амплификации для U. diversum включала следующие этапы: 15 мин при 95 °C; 10 с при 95 °C, 20 с при 55 °С, 10 с при 72 °С (10 циклов без детекции флуоресцентного сигнала); 10 с при 95 °C, 20 с при 55 °С, 10 с при 72 °С (35 циклов с детекцией флуоресцентного сигнала).
Положительные контрольные образцы (ПКО) получали методом клонирования специфического продукта амплификации в плазмиду pAL2-T («Евроген», Россия). Клонирование продуктов ПЦР в вектор pAL2-T производили по стандартной методике производителя без предварительной обработки рестриктазами и экзонуклеазами. Концентрацию полученных плазмид измеряли спектрофотометрически и выражали как число копии в 1 мл.
Аналитическую чувствительность методик оценивали отдельно для каждого патогена. Образцами служили 10-кратные разведения плазмид в заведомо отрицательных образцах спермы, молока, влагалищных смывов, 10 % суспензии внутренних паренхиматозных органов. Специфичность оценивали на панели образцов, состоящей из геномной ДНК коровы, ДНК штаммов микоплазм и гетерологичных бактерий и вирусов, вызывающих заболевания у КРС. Положительные образцы подтверждали секвенированием ПЦР-фрагментов с использованием специфичных праймеров. Секвенирование осуществляли с применением набора Big Dye® Terminator v1.1. Cycle Sequencing Kit на амплификаторе GeneAmp PCR System 2720 («Applied Biosystem», США) и автоматическом секвенатоpe ABI PRISM 3130 Genetic Analyzer («Applied Biosystem», США).
Результаты. Для выявления и дифференциации микоплазм молекулярно-биологическими методами в иностранной литературе предлагаются протоколы ПЦР, обладающие различной диагностической эффективностью (1, 14, 15). Для амплификации M. bovigenitalium и U. diversum большинство авторов используют праймеры, подобранные на ген 16S рРНК и 16S-23S рРНК межгенный спейсер (16-18), для M. californicum — на ген rpoB (1, 2). Наибольшее число работ посвящено выявлению M. bovisв разных типах биологического материала. Для увеличения чувствительности и специфичности предлагается использовать системы праймеров на гены vsp, fusA, oppD (1, 14, 19). Представлена информация об использовании гена uvrC для выявления M. bovis (14, 15, 20). Специфические последовательности, подобранные для амплификации этого фрагмента генома, позволяют дифференцировать M. bovis от видов M. californicum, M. bovigenitalium, M. bovirhinis, M. bovoculi, M. dispar, M. agalactiae.
В результате анализа нуклеотидных последовательностей, представленных в базе данных GenBank (https://www.ncbi.nlm.nih.gov/genbank/), с помощью программного обеспечения VectorNTI Advanced 11.0 («InforMax, Inc.», США) нами были предложены олигонуклеотидные праймеры и ДНК-зонды для амплификации участков генов UvrC для M. bovis, 16S рРНК для M. bovigenitaliumи U. diversum. Для идентификации M. californicum использовали последовательности олигонуклеотидов, представленные в работе S. Boonyayatra с соавт. (1). Выбранные праймеры фланкируют участки генов длиной 148 п.н. (позиции 697986-698133 последовательности GenBank CP019639.1) для M. bovis, 96 п.н. (позиции 504837-504932 последовательности GenBank СР007521.1) дляM. californicum, 127 п.н. (позиции 131-257 последовательности GenBank AY974058.1) для M. bovigenitalium, 114 п.н. (позиции 119-232 последовательности GU227397.1) для U. diversum. Были подобраны олигонуклеотидные зонды, несущие флуоресцентные красители HEX и ROX, которые позволяют одновременно выявлять и дифференцировать M. californicum/M. bovigenitalium и M. bovis/U. diversum в мультиплексном формате. Амплификацию внутреннего контрольного образца во всех методиках детектировали с помощью зонда с флуорофором FAM.
Специфичность олигонуклеотидов изучали с помощью Интернет-сервиса Nucleotide BLAST online (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PA-GE_TYPE=BlastSearch). Была показана гомология выбранных олигонуклеотидов со специфическими мишенями и не обнаружено их значимой гомологии с нуклеотидными последовательностями у других видов Mol-licutes, а также каких-либо вирусов, бактерий или эукариот. Экспериментальное подтверждение специфичности работы праймеров получили с использованием контрольной панели, включающей ДНК 32 штаммов различных микроорганизмов, а также геномную ДНК крупного рогатого скота. При тестировании предложенной панели методика показала 100 % специфичность.
Чтобы предотвратить ложноотрицательные результаты, в образцы на этапе экстракции ДНК вносили экзогенный неконкурентный внутренний контрольный образец (ВКО), который амплифицировали одновременно со специфической мишенью. ВКО — плазмида pAL2-T, содержащая искусственно синтезированный фрагмент ДНК. Введение ВКО позволяло контролировать выполнение всех этапов ПЦР-исследования для каждого образца.
Для определения абсолютной чувствительности праймеров мы использовали 10-кратные разведения ПКО c известной концентрацией плазмидной ДНК, содержащей клонированные фрагменты специфических мишеней. Также анализировали амплификацию серии 10-кратных разведений ПКО (в концентрациях от 5×105 до 5×102 копий/мл) в отрицательных образцах спермы, молока, влагалищных смывов КРС и суспензий внутренних паренхиматозных органов.
Эксперименты проводились в разные дни, разными исполнителями и на разных приборах. Эффективность ПЦР определяли автоматически с помощью программного обеспечения амплификаторов RotorGene Q. Каждый образец исследовали в 6 повторах. За аналитическую чувствительность принимали наименьшую концентрацию ПКО ДНК, дающую положительный сигнал в ПЦР в 6 случаях из 6.
Чувствительность разработанных методик для разных видов биологического материала составила в среднем 5×103 копий/мл (результат анализа проб молока иллюстрирует рисунок). Эффективность амплификации составила 99 % для M. bovis, 87 % — для M. bovigenitalium, 94 % — для M. californicum, 98 % — для U. diversum.
Разработанные методики использовали для выявления патогенных микоплазм в образцах криоконсервированной спермы от быков-про-изводителей. Всего проанализировали 410 образцов спермы от быков из отечественных и зарубежных племенных центров (табл. ). Предварительно эти образцы были исследованы с использованием тест-системы Мик-Ком («Амплисенс», Россия), предназначенной для выявления ДНК микроорганизмов рода Mycoplasma в биологическом материале (21).
В сперме, полученной из зарубежных племенных хозяйств, бактерии рода Mycoplasma в целом и патогенные микоплазмы в частности выявлялись реже, чем в сперме быков из отечественных хозяйств. Однако M. bovis была обнаружена только в импортной сперме. Присутствие M. bovis в образцах подтверждали с использованием тест-системы LSI VetMAX™ Mycoplasma bovis. Положительные результаты выявления и дифференциации M. bovis, M. bovigenitalium, M. californicum и U. diversum были подтверждены секвенированием.
Коинфицирование различными видами микоплазм наблюдалось в 121 пробе из отечественных хозяйств (57,3 %) и в 31 пробе из зарубежных племенных центров (15,5 %). Коинфицирование M. californicum/M. bovigenitalium выявили в 74 пробах из отечественных хозяйств и в 24 образцах импортной спермы (23,7 % от всех образцов), M. bovigenitalium/U. diversum — в 79 пробах отечественной спермы и в 7 образцах из зарубежных хозяйств (21,0 % от всех проб). Одновременное инфицирование M. bovigenitalium, M. californicum и U. diversum наблюдалось в 52 образцах (24,6 %) спермы из отечественных хозяйств и в 4 пробах (2 %) из зарубежных племенных центров.
Поскольку у животного выделение микоплазм со спермой часто протекает без клинических проявлений (22), важно исследовать сперму перед осеменением коров, чтобы избежать заражения и последующего развития маститов (23). Высокая распространенность маститов, репродуктивных и респираторных нарушений микоплазменной этиологии у КРС свидетельствует об актуальности подтверждения микоплазменной природы возбудителя (1). На основании полученных данных можно рекомендовать разработанные методики для использования в ветеринарных лабораториях, совершенствования диагностики и оптимизации противоэпизоотических мероприятий, а также для мониторинга качества спермы КРС, используемой для искусственного осеменения.
Таким образом, разработанные методики идентификации и дифференциации патогенных микоплазм Mycoplasma californicum, M. bovigenitalium, M. bovis и Ureaplasma diversum на основе полимеразной цепной реакции в реальном временипоказали высокую специфичность и чувствительность, в среднем для разного материала составившую 5×103 копий целевой ДНК в 1 мл. В исследованных образцах замороженной спермы крупного рогатого скота, предназначенной для искусственного осеменения, выявлена высокая степень заражения патогенными микоплазмами.
Выявление различных видов Mycoplasmataceae в образцах спермы крупного рогатого скота, предназначенной для искусственного осеменения, методом ПЦР в реальном времени |
||||||
Патоген |
Племенные центры |
Всего (n = 410) |
||||
отечественные (n = 211) |
зарубежные (n = 199) |
|||||
обнаружена ДНК |
% |
обнаружена ДНК |
% |
обнаружена ДНК |
% |
|
Mycoplasma spp. |
182 |
86,3 |
127 |
63,8 |
309 |
75,4 |
M.bovis |
0 |
0 |
5 |
2,5 |
5 |
1,2 |
M.californicum |
109 |
51,7 |
44 |
22,1 |
153 |
37,3 |
M.bovigenitalium |
128 |
60,7 |
50 |
25,1 |
178 |
43,4 |
Ureaplasma diversum |
116 |
55,0 |
24 |
12,1 |
140 |
34,1 |
Примечание. n — число образцов. |
||||||
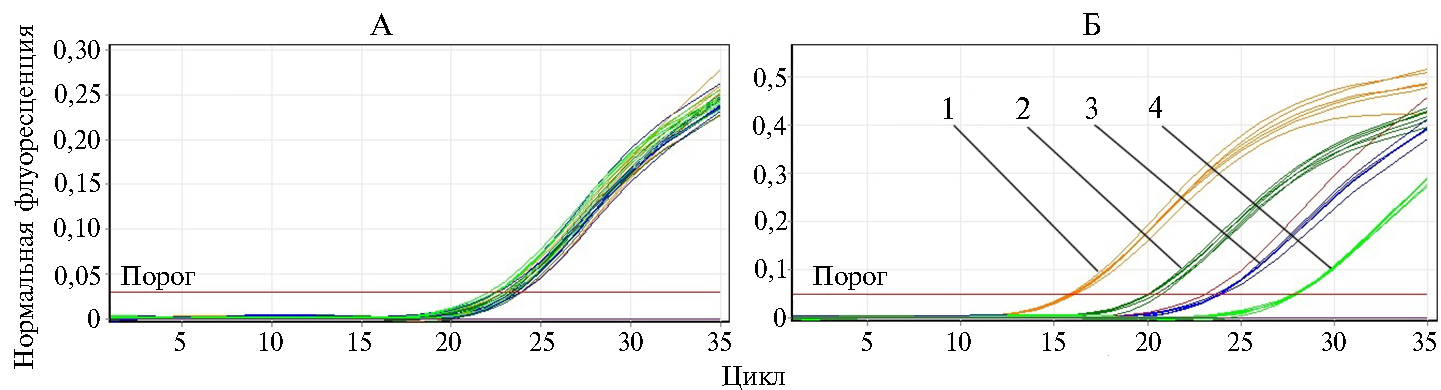
Графики накопления флуоресцентного сигнала при амплификации целевых фрагментов ДНК, выделенной из 10-кратных разведений положительных контрольных образцов ДНК в отрицательных образцах молока: А — амплификация ВКО (флуорофор FAM), Б — амплификация Ureaplasma diversum (флуорофор HEX); 1, 2, 3, 4 — разведения ДНК в концентрации соответственно 5×105, 5×104, 5×103 и 5×102 копий/мл.
ЛИТЕРАТУРА
- Boonyayatra S., Fox L.K., Besser T.E., Sawant A., Gay J.M., Raviv Z.A. PCR assay and PCR-restriction fragment length polymorphism combination identifying the 3 primary Mycoplasma species causing mastitis. Journal of Dairy Science, 2012, 95(1): 196-205 (doi: 10.3168/jds.2011-4531).
- Parker A.M., House J.K., Hazelton M.S., Bosward K.L., Sheehy P.A. Comparison of culture and a multiplex probe PCR for identifying Mycoplasma species in bovine milk, semen and swab samples. PLoS ONE, 2017, 12(3): e0173422 (doi: 10.1371/journal.pone.0173422).
- Bürki S., Frey J., Pilo P. Virulence, persistence and dissemination of Mycoplasma bovis. Veterinary Microbiology, 2015, 179(1-2): 15-22 (doi: 10.1016/j.vetmic.2015.02.024).
- Maunsell F., Brown M.B., Powe J., Ivey J., Woolard M., Love W., Simecka J.W. Oral inoculation of young dairy calves with Mycoplasma bovis results in colonization of tonsils, development of otitis media and local immunity. PLoS ONE, 2012, 7(9): e44523 (doi: 10.1371/journal.pone.0044523).
- Fraser B.C., Anderson D.E., White B.J., Miesner M.D., Lakritz J., Amrine D., Mosier D.A. Associations of various physical and blood analysis variables with experimentally induced Mycoplasma bovis pneumonia in calves. American Journal of Veterinary Research, 2014, 75(2): 200-207 (doi: 10.2460/ajvr.75.2.200).
- Mackie D.P., Ball H.J., Logan E.F. Isolation of Mycoplasma californicum from an outbreak of bovine mastitis and the experimental reproduction of the disease. Veterinary Record, 1982, 110(25): 578-580 (doi: 10.1136/vr.110.25.578).
- Kirk J.H., Glenn K., Ruiz L., Smith E. Epidemiologic analysis of Mycoplasma spp. isolated from bulk-tank milk samples obtained from dairy herds that were members of a milk cooperative. Journal of the American Veterinary Medical Association, 1997, 211(8): 1036-1038 .
- Brenner J., Lysnyansky I., Elad D., Blum S., Bernstein M., Friedgut O., Rotenberg D. Granulo-pustular vulvovaginitis (“Jackal bite”) an emerging disease: Mycoplasma bovigenitalium and M. canadense infection of dairy cattle in Israel. Israel Journal of Veterinary Medicine, 2009, 64(4): 103-107.
- Ghanem M.E., Higuchi H., Tezuka E., Ito H., Devkota B., Izaike Y., Osawa T. Mycoplasma infection in the uterus of early postpartum dairy cows and its relation to dystocia and endometritis. Theriogenology, 2013, 79(1): 180-185 (doi: 10.1016/j.theriogenology.2012.09.027).
- Lysnyansky I., Brenner J., Alpert N., Benjamin A., Bernstein M., Elad D., Blum S., Friedgut O., Rotenberg D. Identification of Mycoplasma bovigenitalium and Mycoplasma canadense from outbreaks of granulopapular vulvovaginitis in dairy cattle. Veterinary Record, 2009, 165(11): 319-322 (doi: 10.1136/vr.165.11.319).
- Vasconcellos Cardoso M., Blanchard A., Ferris S., Verlengia R., Timenetsky J., Florio Da Cunha R.A. Detection of Ureaplasma diversum in cattle using a newly developed PCR-based detection assay. Veterinary Microbiology, 2000, 72(3-4): 241-250 (doi: 10.1016/S0378-1135(99)00203-5).
- Gaeti J.G., Lana M.V., Silva G.S., Lerner L., de Campos C.G., Haruni F., Colodel E.M., Costa E.F., Corbellini L.G., Nakazato L., Pescador C.A. Ureaplasma diversum as a cause of pustular vulvovaginitis in bovine females in Vale Guapore, Mato Grosso State, Brazil. Tropical Animal Health and Production, 2014, 46(6): 1059-1063 (doi: 10.1007/s11250-014-0614-5).
- Parker A.M., Sheehy P.A., Hazelton M.S., Bosward K.L., House J.K. A review of mycoplasma diagnostics in cattle. Journal of Veterinary Internal Medicine, 2018, 32(3): 1241-1252 (doi: 10.1111/jvim.15135).
- Bashiruddin J.B., Frey J., Königsson M.H., Johansson K.E., Hotzel H., Diller R., de Santis P., Botelho A., Ayling R.D., Nicholas R.A., Thiaucourt F., Sachse K. Evaluation of PCR systems for the identification and differentiation of Mycoplasma agalactiae and Mycoplasma bovis: a collaborative trial. The Veterinary Journal, 2005, 169(2): 268-275 (doi: 10.1016/j.tvjl.2004.01.018).
- Clothier K.A., Jordan D.M., Thompson C.J., Kinyon J.M., Frana S., Strait E.L. Mycoplasma bovis real-time polymerase chain reaction assay validation and diagnostic performance. Journal of Veterinary Diagnostic Investigation, 2010, 22(6): 956-960 (doi: 10.1177/104063871002200618).
- Marouf S.A., Mohamed Kh.F., El-Jakee J. Detection of Mycoplasma bovis and Mycoplasma bovigenitalium in cattle and buffalo in Egypt using dot ELISA and PCR with anti-microbial trials. European Journal of Biological Sciences, 2011, 25: 136-146.
- Argue B., Chousalkar K.K., Chenoweth P.J. Presence of Ureaplasma diversum in the Australian cattle population. Australian Veterinary Journal, 2013, 91(3): 99-101 (doi: 10.1111/avj.12009).
- Marques L.M., Buzinhani M., Neto R.L., Oliveira R.C., Yamaguti M., Guimarães A.M., Timenetsky J. Detection of Ureaplasma diversum in bovine semen straws for artificial insemination. Veterinary Record, 2009, 165(19): 572-573 (doi: 10.1136/vr.165.19.572).
- Tenk M., Bálint A., Stipkovits L., Biró J., Dencso L. Detection of Mycoplasma bovis with an improved PCR assay. Acta Veterinaria Hungarica, 2006, 54(4): 427-435 (doi: 10.1556/AVet.54.2006.4.1).
- Subramaniam S., Bergonier D., Poumarat F., Capaul S., Schlatter Y., Nicolet J., Frey J. Species identification of Mycoplasma bovis and Mycoplasma agalactiae based on the uvrC genes by PCR. Molecular and Cellular Probes, 1998, 12(3): 161-169 (doi: 10.1006/mcpr.1998.0160).
- Яцентюк С.П., Горбачева Н.С., Яралова Е.А., Козлова А.Д. Использование метода ПЦР для выявления возбудителей инфекционных болезней в сперме крупного рогатого скота. Russian Journal of Agricultural and Socio-Economic Sciences, 2017, 10(70): 331-337 (doi: 10.18551/rjoas.2017-10.47).
- Morton J.M., Bosward K.L., Sheehy P.A., Parker A.M., House J.K. Isolation of Mycoplasma spp. and serological responses in bulls prior to and following their introduction into Mycoplasma bovis-infected dairy herds. Journal of Dairy Science, 2018, 101(8): 7412-7424 (doi: 10.3168/jds.2018-14457).
- Haapala V., Pohjanvirta T., Vähänikkilä N., Halkilahti J., Simonen H., Pelkonen S., Soveri T., Simojoki H., Autio T. Semen as a source of Mycoplasma bovis mastitis in dairy herds. Veterinary Microbiology, 2018, 216: 60-66 (doi: 10.1016/j.vetmic.2018.02.005).