УДК 591.05:577.161.3
ОБ УЧАСТИИ α-ТОКОФЕРИЛХИНОНА В НАД+-ЗАВИСИМОЙ РЕГУЛЯЦИИ ФИНАЛЬНОЙ СТАДИИ РАСПАДА ГЛЮКОЗЫ
В.И. ДУДИН
В опытах с инкубированием сухих быстродействующих пекарских дрожжей Saccharomyces cerevisiae S15С (OXY) в неполной среде с D-глюкозой установили, что при включении в среду НАД+ увеличивается скорость образования пирувата. В сочетании с НАД+ α-токоферилхинон заметно изменяет динамику содержания уксусного альдегида в среде. При использовании лактата лития в качестве субстрата обнаружено два максимума концентрации пирувата как результат действия двух лактатдегидрогеназ, одна из которых (14 ч) ингибируется совместно НАД+ и α-токоферилхиноном, другая (36 ч) — этими же агентами раздельно.
Ключевые слова: сухие пекарские дрожжи Saccharomyces cerevisiae, глюкоза, уксусный альдегид, α-токоферилхинон, образование пировиноградной кислоты и уксусного альдегида, брожение, лактатдегидрогеназы, контроль активности.
В опытах с инкубированием сухих свежих или подвергшихся продолжительному хранению пекарских дрожжей Saccharomyces cerevisiaeв неполной питательной среде с D-глюкозой мы установили, что D,L-α-токо-ферилхинон (продукт свободнорадикального окисления витамина Е) ускоряет образование пирувата из глюкозы (1). НАД+-зависимые дегидрогеназы, такие как лактатдегидрогеназа, алкогольдегидрогеназа, D-глицероаль-дегид-3-фосфатдегидрогеназа, имеют в своем составе похожие белковые фрагменты — НАД+-связывающие домены (2). Механизм их смыкания управляется НАД+, и высокая чувствительность указанных ферментов в отношении регулирующих факторов может основываться на участии α-токоферилхинона в этом процессе.
Известно, что свойства лактатдегидрогеназ млекопитающих специфичны в отношении L(+)-лактата (мясомолочная кислота). Дрожжевая лактатдегидрогеназа (L-лактат:феррицитохром с оксидоредуктаза, КФ 1.1.2.3), идентичная цитохрому b2, обладает субстратной стереоспецифичностью. Фермент представляет собой бифункциональный тетрамер, каждая субъединица которого состоит из двух основных доменов — домена цитохрома b и домена, содержащего флавинмононуклеотид (3). Фермент, катализирующий окисление D-формы (D-лактат:феррицитохром с оксидоредуктаза, КФ 1.1.2.4), существенно отличается от фермента, использующего L-лактат (4).
Целью нашей работы было изучение влияния α-токоферилхинона и НАД+ на концентрацию в среде пирувата и уксусного альдегида при сбраживании дрожжами Saccharomyces cerevisiae глюкозы или лактата лития.
Методика. Использовали сухие коммерческие пекарские дрожжи Saccharomyces cerevisiae штамм S15С (OXY) («Lesaffre», Франция). D,L-α-токоферилхинон получали из D,L-α-токоферола посредством его окисления азотной кислотой (5) с последующей очисткой на колонке с силикагелем под контролем высокоэффективной жидкостной хроматографии (ВЭЖХ) (6).
В первом опыте в 200 см3 воды растворяли 4 г D-глюкозы. Полученный раствор разливали по 100 см3 в две колбы объемом 200 см3. В экспериментальный образец вводили НАД+ («Sigma-Aldrich», Германия) и a-токоферилхинон (концентрация 0,2 мкмоль/см3), солюбилизированный в 10 мл воды с помощью Твин 20 (150 мг) («Merck», Германия). В контрольный образец добавляли то же количество Твин 20 и воды, а также НАД+. Испытывали следующие дозы НАД+ (конечная концентрация): 0; 0,34; 0,68; 1,37; 2,74 и 5,48 мкмоль/см3 среды. В каждую колбу вводили по 0,75 г дрожжей. Смеси инкубировали на водяной бане с шейкером при 30 °С. Через 12 мин проводили отбор исходных образцов, затем колбы помещали обратно и отбирали пробы (по 5 мл) через 3,5; 7; 14; 24; 36; 48; 60; 72 и 84 ч. В качестве осадителя белка использовали 1,25 мл 10 % раствора HPO3. После этого пробы центрифугировали в рефрижераторной центрифуге К-24 («Janetzki», Германия) при 10 000 g и 4 °С. Во втором и третьем опытах в качестве субстрата применяли литиевую соль D,L-лактата («Sigma», США) в концентрации 90 мкмоль/см3. Во втором опыте в контрольный образец вводили только 150 мг Твин 20, в экспериментальный — Твин 20 (150 мг) и 0,0227 ммоль D,L-a-токоферилхинона (концентрация 0,20 мкмоль/см3). В третьем в оба образца добавляли также 0,6 ммоль НАД+ (концентрация 5,48 мкмоль/см3). В каждую колбу вносили по 0,85 г дрожжей.
Количество пировиноградной кислоты определяли по ее способности образовывать 2,4-динитрофенилгидразоны, которые очищали обратной экстракцией из толуольного раствора в водный раствор соды (Na2CO3) и переводили в аци-форму добавлением раствора едкого натра (7). Уксусный альдегид выделяли в виде 2,4-динитрофенилгидразона из толуольного раствора, оставшегося после удаления из него кислых 2,4-динитроферил-гидразонов пировиноградной кислоты. Толуол упаривали, 2,4-динитрофе-нилгидразоны уксусного альдегида выделяли с помощью двукратной хроматографии со свидетелем в тонком закрепленном слое силикагеля L («Lachema», Чешская Республика), используя бензол в качестве носителя. Гидразоны с силикагеля экстрагировали метанолом. Количество альдегида определяли при l = 340 нм с помощью спектрального колориметра Specol-11 («Carl Zeiss», Германия).
Во втором и третьем опытах количество гидразонов пирувата в пробах определяли после очистки с помощью тонкослойной хроматографии. Проводили синтез 2,4-динитрофенилгидразонов, их экстракцию толуолом, обратную экстракцию в водный раствор соды (7). 2,4-Динитрофе-нилгидразоны экстрагировали толуолом после нейтрализации 2 н. HCl до слабокислой реакции (рН 5,0). Растворитель упаривали, в тонком слое силикагеля выделяли гидразон пирувата, используя в качестве носителя смесь 10 % этанола в бензоле (Rf = 0,50).
Статистическую обработку проводили на основе общепринятых принципов вариационной статистики (8) с использованием программы Microcoft Exсel.
Результаты. Увеличение дозы НАД+ в среде с глюкозой приводило к повышению концентрации пирувата в зависимости от времени инкубирования (рис. 1). Дозы НАД+ 2,74 и 5,48 мкмоль/см3 (см. рис. 1, д, е) вызывали сдвиг максимума с 3,5 ч на период между 3,5 и 7 ч. В то же время добавление α-токоферилхинона не вызывало существенных изменений ни в концентрации пирувата в среде, ни во времени проявления ее максимумов по сравнению с контролем. Торможение образования пирувата под влиянием a-токоферилхинона отмечалось только при добавлении НАД+ (5,48 мкмоль/см3) между 7-м и 14-м ч инкубирования (см. рис. 1, е).
При относительно нерезком повышении количества НАД+ в среде α-токоферилхинон заметно влиял на динамику содержания уксусного альдегида. Это хорошо заметно по разнонаправленному действию α-токо-ферилхинона на количество ацетальдегида при добавлении 0,68 (рис. 2, в) и 1,37 мкмоль/см3 (см. рис. 2, г) НАД+. Полученные данные можно рассматривать как указание на способность a-токоферилхинона регулировать метаболизацию уксусного альдегида в среде в зависимости от содержания в ней НАД+.
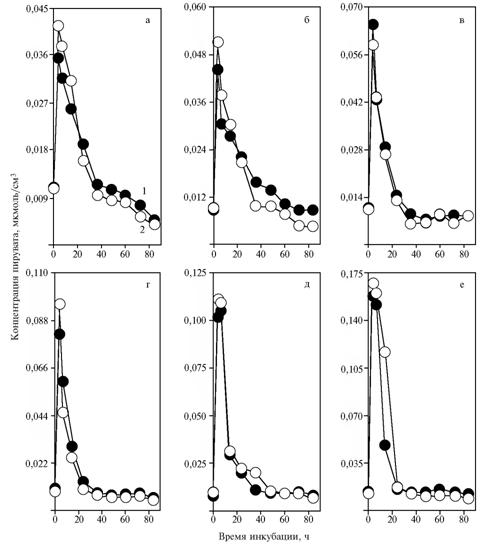 |
| Рис. 1. Концентрация пирувата в процессе сбраживания глюкозы дрожжами Saccharomyces cerevisiae S15C (OXY) при добавлении в среду НАД+: а, б, в, г, д, е — соответственно 0; 0,34; 0,68; 1,37; 2,74 и 5,48 мкмоль/см3; 1 и 2 — без внесения и с внесением в среду a-токоферил-хинона. |
НАД+-связывающий домен изучался, в частности, на примере алкогольдегидрогеназы из печени лошадей (9). Указанный фермент представляет собой Zn2+-зависимый гомодимер. Каждый протомер имеет коэнзим-связы-вающий и каталитический домены. Изучен механизм смыкания домена, индуцируемый НАД+. Имитационное моделирование и точный рентгеноструктурный анализ подтвердили, что петля интерфейса домена предупреждает его смыкание в отсутствие НАД+. При этом действует механизм кооперативности между субъединицами. Он поддерживает роль петли как блокатора смыкания домена в отсутствие НАД+ в период, когда другие субъединицы замкнуты НАД+. Как следствие, фермент может проявлять чрезвычайную чувствительность к препятствующим или регулирующим факторам. В частности, на функционирование каталитического домена влияет препарат висмута (10), который способен ингибировать активность алкогольдегидрогеназы. Он может замещать только половину Zn2+ (около одного Zn2+ на один мономер). Сера (5,5 ррm) также ингибирует алкогольдегидрогеназу и каталазу, а дитиотреитол усиливает действие элемента (11).
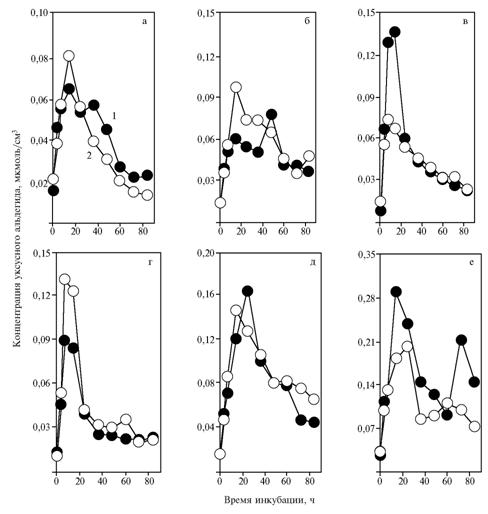 |
| Рис. 2. Концентрация уксусного альдегида в процессе сбраживания глюкозы дрожжами Saccharomyces cerevisiae S15C (OXY) при добавлении в среду НАД+: а, б, в, г, д, е — соответственно 0; 0,34; 0,68; 1,37; 2,74 и 5,48 мкмоль/см3; 1 и 2 — без внесения и с внесением в среду a-то-коферилхинона. |
Лактат — продукт для одного метаболического пути (гликолиз) и субстрат для другого (дыхание). Он играет роль межклеточного и внутриклеточного челнока, участвующего в поставке окисленных и глюконеогенетических субстратов (12). Примером может служить обмен лактата между белыми (гликогенными) и красными (окислительными) мышечными волокнами, между работающими скелетными мышцами и сердцем, между тканевым освобождением лактата и глюконеогенезом. Митохондриальный лактат-пируватный обмен приводится в действие лактатдегидрогеназой, благодаря которой становится возможным окисление лактата в активно дышащих клетках. Гликолиз и окисление лактата в клетках обусловливают высокую скорость потока субстратов и поддержание редокс-баланса между цитозолем и митохондриями. Лактатдегидрогеназы, которые превращают лактат в пируват, найдены у большинства организмов и составляют группу протеинов, высокодивергентных по аминокислотной последовательности, каталитическим свойствам и субстратной специфичности (13).
 |
Рис. 3. Концентрация пирувата (а, б) иуксусного альдегида (в, г) при сбраживании лактата лития дрожжами Saccharomyces cerevisiae S15С (OXY) без добавления (а, в) и с добавлением в среду НАД+(б, г): 1 и 2 — соответственно без введения и с введением a-токоферилхинона. |
В наших опытах при использовании лактата лития в качестве субстрата на графике проявились два максимума концентрации пирувата (14 и 36 ч). Добавление в среду НАД+ (рис. 3, б, г) приводило к снижению интенсивности брожения, скорее всего вследствие ингибирующих свойств этого кофермента в отношении лактатдегидрогеназы.
Таким образом, в дрожжах S. cerevisiae S15С (OXY) действуют две лактатдегидрогеназы с различными свойствами. Одна ингибируется совместно a-токо-ферилхиноном и НАД+, другая — этими же агентами раздельно. Первая проявляется быстро (через 14 ч), вторая — медленно (через 36 ч). Скорее всего, речь идет об L- и D-лактатдегидрогеназах. Особый интерес вызывает совпадение максимумов концентрации пирувата с минимумами содержания ацетальдегида. Причиной подобного взаимоотношения субстратов может быть усиление ацетоинсинтетазной активности пируватдекарбоксилазы. Известно, что добавление к бродящим дрожжам пировиноградной кислоты приводит к образованию ацетоина (14). Такое же появление пирувата в реакционной смеси происходило в нашем случае в результате действия дрожжевых лактатдегидрогеназ.
Дрожжевые лактатдегидрогеназа и алкогольдегидрогеназа инактивируются посредством атак свободных радикалов, интенсивность которых в бескислородной среде меньше (15). Аскорбат может защищать от них оба фермента. Этот факт лежит в основе общей трактовки влияния антиоксидантов на ферментные активности. α-Токоферилхинон — сильный возобновляемый антиоксидант, восстанавливающийся в дыхательной цепи (16). В то же время приведенные в настоящей работе сведения нельзя объяснить антиоксидантными свойствами α-токоферилхинона, которые обеспечиваются работающими митохондриями.
Показано, что хиноны могут действовать как окислители флавопротеида (17). Что касается a-токоферилхинона, то в рубцовой анаэробной бактерии Butyrivibrio fibrisolvens и в Escherichia coli он восстанавливается в соответствующий хинол в реакции, катализируемой флавопротеидным ферментом за счет восстановительных эквивалентов НАДH (18). В нашем случае необходим поиск механизма действия α-токоферилхинона, который предусматривает участие НАД+.
Итак, при сбраживании D-глюкозы пекарскими дрожжами Saccharomyces cerevisiae S15С (OXY)скорость образования пирувата увеличивалась в случае внесения в среду НАД+. В сочетании с НАД+ α-токоферилхинон заметно изменял динамику содержания уксусного альдегида. При использовании лактата лития в качестве субстрата обнаружено два максимума концентрации пирувата, что было результатом действия двух лактатдегидрогеназ.
Л И Т Е Р А Т У Р А
1. Д у д и н В.И. Об участии α-токоферилхинона в процессах сбраживания глюкозы дрожжами Saccharomyces cerevisiae. С.-х. биол., 2010, 2: 34-39.2. А н и с и м о в А.А. Основы биохимии. М., 1986.
3. З в я г и л ь с к а я Р.А., К о т е л ь н и к о в а А.В. Структура и функциональная активность дрожжевых митохондрий. В кн.: Итоги науки и техники ВИНИТИ. Серия «Биологическая химия». Т. 36. М., 1991.
4. У и л к и н с о н Дж. Изоферменты. М., 1968.
5. R a o G.H.R., K e i c h T.P., W h i t e J.G. Preparation, separation and characterisation of vitamin E quinone. J. Chromat., 1980, 196(3): 506-511.
6. Д у д и н В.И. Биохимия витамина Е и связанных с ним биологически активных веществ. М., 2004.
7. П е т р у н ь к и н а А.М. Практическая биохимия. Л., 1961: 384-390.
8. М е р к у р ь е в а Е.К. Биометрия в животноводстве. М., 1964.
9. H a y w a r d S., K i t a o A. Molecular dynamics simulations of NAD+-induced domain closure in horse liver alcohol dehydrogenase. Biophys. J., 2006, 1(91)/5: 1823-1831.
10. J i n L., S z e t o K.Y., Z h a n g L., D u W., S u n H. Inhibition of alcohol dehydrogenase by bismuth. Environ. Toxicol., 2004, 19(4): 372-386.
11. G e t k a u s k a i t e A., P e s s a l a P., S ö d e r g r e n A. Elemental sulfur toxicity in vivo and in vitro to bacterial luciferase, in vitro yeast alcohol dehydrogenase, and bovine liver catalase. Mol. Cell. Biol., 2004, 24(9): 3874-3884.
12. B r o o k s G.A. Lactate shuttles in nature. Microbiologia, 1996, 12(3): 411-416.
13. C r i s t e s c u M.E., E g b o s i m b a E.E. Evolutionary hystory of D-lactatede-hydrogenases: a phylogenomic perspective on functional diversity in the FAD binding oxidoreductase/transferase type 4 family. J. Mol. Evol., 2009, 69(3): 276-287.
14. С а м н е р Д.Б., С о м е р с Г.Ф. Химия ферментов и методы их исследования. М., 1948.
15. K i t t r i d g e K.J., W i l l s o n R.L. Uric acid substantially enhances the free radical-induced inactivation of alcoholdehydrogenase. Biochem. J., 1984, 95(1): 109-115.
16. Д у д и н В.И., Г р и щ у к С.В., С а к о в ц е в а Т.В. Взаимосвязь между убихиноном и a-токоферилхиноном в организме животных. С.-х. биол., 2008, 6: 53-58.
17. Д о л и н М. Метаболизм бактерий. М., 1963: 316-359.
18. H u g h e s P.E., T o v e S.B. Identification of an endogenous electron donor for biohydrogenation as α-tocopherolquinol. J. Biol. Chem., 1980, 255(10): 4447-4452.
ABOUT α-TOCOPHERYLQUINONE PARTICIPATION IN NAD+-DEPENDENT REGULATION OF FINAL STAGE OF GLUCOSE CLEAVAGE
V.I. Dudin
In the experiments with incubation of dry fast-acting baker's yeast Saccharomyces cerevisiae S15С (OXY) in incomplete medium with D-glucose the author established, that the addition to medium of NAD+ increases the speed of pyruvate formation. The combination of NAD+ and α-toco-pherylquinone changes markedly in medium the dynamics of acetaldehyde content. The use of lithium lactate as substrate permits to detect two maximum of pyruvate concentration as result of action of two lactate dehydrogenases, one of which (14 h) is inhibited by NAD+ and α-tocopherylquinone together, the other (36 h) — by these agents separately.
Keywords: dried baker`s yeast Saccharomyces cerevisiae, glucose, acetic aldehyde, α-tocopherolquinone, pyruvic acid and acetic aldehyde formation, fermentation, lactate dehydrogenases, control of activity.
ГНУ Всероссийский НИИ физиологии, |
Поступила в редакцию |













