УДК 636.028+636.92]:591.39:57.089.3:575.16
ЭФФЕКТИВНОСТЬ ИНТЕГРАЦИИ ГЕНА ЛАКТОФЕРРИНА ЧЕЛОВЕКА В ГЕНОМ МЫШИ И КРОЛИКА
С.И. ТЕВКИН, М.С. ШИШИМОРОВА, В.А. ЕЗЕРСКИЙ, Т.П. ТРУБИЦИНА, О.Б. ФАТКУЛИНА, В.П. РЯБЫХ
Создана генно-инженерная конструкция αS1>CnhLF, содержащая ген лактоферрина человека (hLF) под контролем 5'- и 3'-фланкирующих регуляторных последовательностей гена αS1-казеина крупного рогатого скота. После ее микроинъецирования в пронуклеус мышиных и кроличьих зигот оценивали способность этих зигот развиваться in vitro при интеграции трансгена на стадии бластоцисты, подтвержденной ПЦР-анализом. Проводили трансплантацию эмбрионов самкам-реципиентам и получили трансгенных животных с частотой интеграции трансгена в геном мыши и кролика 16,7 % при общей эффективности трансгеноза соответственно 1,3 и 0,8 %.
Ключевые слова: генно-инженерная конструкция, лактоферрин, микроинъекция, пронуклеус, трансгенные кролики.
Повышение частоты интеграции чужеродных генов и обеспечение их эффективной экспрессии в генетически модифицированном организме представляет собой главную задачу современных трансгенных технологий. Высокая востребованность рекомбинантных белков человека на мировом рынке стала причиной начала работ по получению трансгенных животных-биореакторов. Модель таких животных основана на интеграции какого-либо гена, кодирующего фармацевтически необходимый белок, экспрессия которого управляется регуляторной последовательностью (промотором) генов различных белков молока — αS1-, β- и κ-казеина, β-лактоглобулина, β-лактоальбумина (1, 2).
В настоящее время получены трансгенные овцы, козы, коровы, свиньи и кролики — продуценты белков человека: антистатина, гранулоцит-колониестимулирующего фактора, кальцитонина, лактоферрина и др. (3, 4). Однако оказалось, что эффективность интеграции трансгена и уровень экспрессии рекомбинантных белков в молочной железе сильно варьируют в зависимости от множества факторов (вида животных, типа используемого для создания конструкции вектора, например плазмиды или ретровируса, размера и формы рекомбинантной ДНК, типа тканеспецифичности промотора и т.д.) (1, 4, 5-7) и в большинстве экспериментов остаются невысокими. Поэтому первый и важный этап при отработке трансгенной технологии — поиск и создание генно-инженерных конструкций, способных эффективно интегрировать в геном хозяина, а их тестирование и анализ на лабораторных животных позволяет выбрать наиболее перспективные для дальнейшего использования.
Гены казеиновых белков крупного рогатого скота (КРС) находят все большее применение в биотехнологических исследованиях по созданию животных — продуцентов биологически активных белков, поскольку pегуляторные последовательности этих генов определяют тканеспецифический характер экспрессии в клетках молочной железы. Исходя из того, что ген αS1-казеина расположен в начале казеинового кластера, можно предположить наличие в его 5'-фланкирующей области регуляторных элементов для всего кластера. Во многих публикациях отмечается успешное использование подобного промотора при создании генно-инженерных конструкций (1, 3, 4).
К числу белков-кандидатов для экспрессии в молоке трансгенных животных относится лактоферрин человека (hLF) — многофункциональный протеин, который стимулирует рост лимфоцитов, играет большую роль в регуляции абсорбции железа, обладает антимикробной и антивирусной активностью. Кроме того, он является иммуномодулятором и важным фактором в регуляции функций желудочно-кишечного тракта у новорожденных (8, 9).
Целью нашего исследования была оценка жизнеспособности мышиных и кроличьих эмбрионов после микроинъекции в зиготу генно-инженерной конструкции, содержащей последовательность гена лактоферрина человека под контролем регуляторных элементов гена aS1-казеина КРС, а также определение эффективности интеграции этой конструкции в геном животных.
Методика. Создание генно-инженерной конструкции. Для трансформации и выделения плазмид использовалиштамм Escherihia coli JM109. Трансформацию проводили по стандартной методике (10). В качестве промежуточного вектора использовался pGEM-T («Promega», США).
кДНК гена лактоферрина человека (hLF) былa амплифицирована с плазмиды pCMV-Lf, любезно предоставленной В.Г. Луниным (Всероссийский НИИ сельскохозяйственной биотехнологии, г. Москва). Дизайн праймеров проводили на основании базы генов, полученных из GENBANK. Последовательность прямого праймера LF1 (direct) включaлa стартовый кодон hLF, а также сайт рестрикции для эндонуклеазы SacI; обратный праймер LF2 (reverse) содержал терминирующий кодон гена лактоферрина и сайт рестрикции для эндонуклеазы HindIII. Нуклеотидная последовательность праймеров: LF1 (direct) — 5'-atg gag ctc atg aaa ctt gtc ttc ctc gtc-3'; LF2 (reverse) — 5'-atg aag ctt tta ctt cct gag gaa ttc aca-3'. Условия полимеразной цепной реакции (ПЦР): денатурация ДНК — 94 °С, 1 мин; отжиг праймеров — 58 °С, 45 с; синтез — 72 °С, 2 мин; элонгация — 72 °С, 5 мин. В результате ПЦР был синтезирован фрагмент LF1/LF2 размером 2136 п.н.Полученный амплификат LF1/LF2 выделяли и очищали с использованием колонок MicroSpin Columns («Promega», США), затем клонировали в промежуточный вектор pGEM-T. После двойного гидролиза эндонуклеазами SacI и HindIII фрагмент ДНК, содержащий ген лактоферрина, элюировали из 1 % агарозного геля, очищали и клонировали в плазмиду, содержащую промоторную область гена αS1-казеина КРС. 3'-фланкирующую область гена αS1-казеина КРС, содержащую сигналы сплайсинга и полиаденилирования, также амплифицировали, применив в качестве матрицы геномную ДНК КРС. На концевые участки этого фрагмента были добавлены сайты рестрикции HindIIIи BamHI для использования в последующем клонировании. Полученный фрагмент лигировали с описанной выше плазмидой, несущей ген лактоферрина и промоторную область гена αS1-казеина. Cкрининг рекомбинантных клонов проводили посредством рестрикции плазмидной ДНК, а также секвенированием клонированных фрагментов (11). Полученная в результате плазмида, содержащая ген лактоферрина человека под контролем регуляторных областей гена αS1-казеина КРС, была обозначена как pas1hLF и использована при создании генно-инженерной конструкции aS1CnhLF для микроинъекций в эмбрионы кролика и мыши. Для этого конструкцию отделяли от вектора рестрикцией pas1hLF эндонуклеазами SalI и BamHI. Выделенный из агарозного геля фрагмент ДНК размером 5700 п.н. очищали на колонках MicroSpin Columns («Promega», США), разводили в буфере ТЕ для инъекции (10 мМ Трис-Cl, pH 7,4; 0,1 мМ ЭДТА) до концентрации раствора ДНК 5-7 нг/мкл и использовали для микроинъекции в пронуклеусы зигот (11).Получение трансгенных мышей. В работе использовали мышей F1 CBA x C57BL. Зиготы извлекали через 7-8 ч после спаривания промыванием яйцеводов средой М2 («Sigma», США), обогащенной 0,4 % бычьим сывороточным альбумином (БСА) («Sigma», США). Введение генно-инженерной конструкции aS1CnhLF (2-3 пкл) в пронуклеус мышиных зигот проводили стеклянной микроинъекционной иглой с внешним диаметром кончика 1,5-2,0 мкм под инвертированным микроскопом ICM 405 («ОРТОN», Германия) с дифференциально-интер-ференционным контрастом (DIC по Номарскому). Точность введения раствора ДНК контролировали по увеличению пронуклеуса. Эмбрионы культивировали в среде М16 («Sigma», США) с добавлением 0,5 % БСА в стерильных чашках Петрипод легким минеральным маслом («Sigma», США) при температуре 37 °C в газовой фазе, содержащей 5 % CO2 в воздухе. Критерием оценки жизнеспособности зигот после микроинъекции служило их развитие in vitro в течение 120 ч до стадии бластоцисты с последующим выходом из блестящей оболочки.
Псевдобеременных самок-реципиентов готовили, спаривая их с вазэктомированными самцами. Срок псевдобеременности отсчитывали с даты обнаружения копуляционной пробки. Эмбрионы, несущие генную конструкцию, трансплантировали под наркозом (по 6-8 в каждый яйцевод), используя микроскоп МБС-10 (Россия) (12).
Получение трансгенных кроликов. Объектом исследования служили кролики пород шиншилла и калифорнийский в возрасте 13-24 мес, (живая масса — 3,0-3,5 кг). Для получения максимального числа зигот от крольчих-доноров применяли метод суперовуляции с одновременной синхронизацией крольчих-реципиентов.
Извлечение зигот у крольчих-доноров проводили через 17-19 ч после покрытия самцом и введения хорионического гонадотропина человека (ХГч) (Московский эндокринный завод), пользуясь стандартными хирургическими приемами (13). Зиготы вымывали фосфатно-солевым буфером Дюльбекко — DPBS («ПанЭко», Москва). Манипуляции с эмбрионами выполняли в среде Кане (14) с добавлением 10 мМ HEPES-буфера («Sigma», США). Зиготы культивировали in vitro до стадии бластоцисты в среде Ham’s F-10 («ICN», США) с добавлением 10 % фетальной телячьей сыворотки — ФТС («Eurobio», Франция) при температуре 37 °C в газовой фазе, содержащей 5 % CO2 в воздухе.
После микроинъекции часть эмбрионов кролика культивировали in vitro в течение 120 ч c последующим выполнением ПЦР-анализа, остальные трансплантировали самкам-реципиентам (по 9-11 в каждый рог яйцевода).
Выявление интеграции трансгена. Интеграцию трансгена на стадии бластоцисты и у рожденного потомства определяли с помощью ПЦР. ДНК из тканей выделяли, как описано (15), с некоторыми модификациями. Процедуру выполняли в амплификаторе Терцик («ДНК-Технология», Россия), режим подбирали экспериментально в зависимости от используемых праймеров. Для анализа бластоцист мышей и кроликов использовали праймеры Lf4/Lf10 (размер амплифицируемого фрагмента 806 п.н.), геномной ДНК, выделенной из тканей хвоста мыши и уха кролика, — праймеры Lf4/Lf10 и N377/Lf5 (размер амплифицируемого фрагмента 2000 п.н.).
Полученные результаты обрабатывали методами регрессионного и корреляционного анализа и вариационной статистики. Для выявления статистически значимых различий использовали критерий Стьюдента по Н.А. Плохинскому (16).
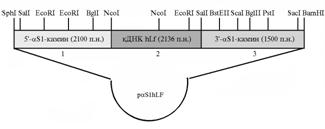
Результаты. Схема сконструированной плазмидыpas1hLF представлена на рисунке 1. Плазмида включала последовательность кДНК структурного гена лактоферрина человека— hLF (2136 п.н.), ассоциированную с регуляторной промоторной 5'-последовательностью гена αS1-казеина КРС (2100 п.н.) и 3'-фланкирующей областью гена того же белка (1500 п.н.).
|
| Рис. 1. Схема расположения сайтов рестрикции на плазмиде pas1hLF c указанием величины клонированных фрагментов: 1 — 5'-промоторная область гена αS1-казеина крупного рогатого скота; 2 — нуклеотидная последовательность кДНК гена лактоферрина человека (hLf); 3 — 3'-область гена αS1-казеина крупного рогатого скота. |
При введении генно-инженерной конструкции в пронуклеусы зигот крайне важна способность таких зигот развиваться in vitro после микроинъекции. По ранее опубликованным данным, на жизнеспособность эмбрионов, перенесших микроинъекцию, влияет ряд факторов: концентрация вводимого раствора генно-инженерной ДНК-конструкции, собственно прокол блестящей оболочки, оболочки пронуклеуса и т.д. (1, 4, 5, 7, 17, 18). Поэтому мы оценили воздействие aS1CnhLF-конструкции на жизнеспособность мышиных и кроличьих эмбрионов.
Полученные данные (табл. 1) свидетельствуют о достоверном подавлении развития мышиных и кроличьих зигот (P < 0,001) in vitro в опыте по сравнению с контролем (буфер ТЕ для инъекции). Так, стадии бластоцисты (120 ч культивирования) у мышей достигло 23,2 % (44 из 190) зигот в опытной группе против 67,4 % (31 из 46) в контрольной, у кроликов — соответственно 35 % (22 из 63) против 87,0 % (20 из 23). В развитии зигот до стадии бластоцисты между опытными группами у мышей и кроликов (соответственно 23,2 и 35,0 %) отмечены достоверные различия (P < 0,05).
| 1. Показатели развитиязигот мыши и кролика in vitro после микроинъекции генно-инженерной конструкции aS1CnhLF и частота интеграции трансгена в геном эмбрионов | ||||||||||
Вид |
Вариант |
Число зигот |
||||||||
общее |
перенесших |
дробившихся |
развив- |
трансгенных из развив- |
||||||
всего |
доля, % |
всего |
доля, % |
всего |
доля, % |
всего |
доля, % |
|||
Мышь |
Контроль |
62 |
46 |
74,1 |
41 |
89,0 |
31 |
67,4 |
0 |
0 |
Опыт |
283 |
190 |
67,0 |
143 |
75,3 |
44 |
23,2 |
9 |
20,5 |
|
Кролик |
Контроль |
23 |
23 |
100 |
23 |
100 |
20 |
87,0 |
0 |
0 |
Опыт |
88 |
63 |
72,0 |
48 |
76,0 |
22 |
35,0 |
9 |
30,0 |
|
П р и м е ч а н и е. Долю дробившихся и достигших стадии бластоцисты зигот определяли от числа перенесших микроинъекцию (выживших). В качестве контроля использовали эмбрионы, микроинъецированные буфером ТЕ для инъекции. По показателям формирования бластоцисты различия между опытом и контролем для мыши и кролика достоверны при P < 0,001; между опытными группами различия достоверны при P < 0,05. |
||||||||||
ПЦР-анализ ДНК эмбрионов выявил наличие трансгена на стадии бластоцисты: у мышей и кроликов частота интеграции составила соответственно 20,5 (9 из 44) и 30,0 % (9 из 22) (см. табл. 1). Электрофореграммы продуктов ПЦР-амплификации представлены на рисунке 2.
Таким образом, несмотря на снижение выживаемости мышиных и кроличьих эмбрионов после микроинъекции, созданная генно-инженерная конструкция способна интегрировать в геном бластоцист. Трансплантация эмбрионов, переживших инъекцию, самкам-реципиентам в 1-е сут псевдобеременности показала (табл. 2), что их приживаемость у кроликов была ниже, чем у мышей — соответственно 5,0 против 7,7 %.
 |
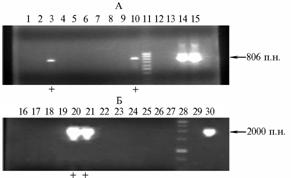
Рис. 2. Электрофореграмма ампликонов, ограниченных праймерамиLf4/Lf10: 2-14 — ДНК из бластоцист кролика («+» — трансгенные бластоцисты); 1 — положительный контроль (разведение конструкции aS1CnhLF — 1:500 000); 15 — отрицательный контроль (деионизирванная вода); 16 — маркер молекулярных масс 100 п.н. ДНК (стрелка указывает на положение фрагмента размером 806 п.н.). |
После трансплантации мы получили трансгенное потомство при общей эффективности тран-сгеноза чужеродной ДНК в мышиные и кроличьи зиготы соответственно 1,3 и 0,8 %. Частота интеграции (доля трансгенных потомков от всех новорожденных) в группах животных обоих видов при этом была одинаковой и составляла 16,7 %. Электрофореграммы продуктов амплификации, полученных в результате ПЦР-анализа ДНК из тканей рожденного потомства, приведены на рисунке 3.
| 2.Приживаемость зигот после микроинъекции генно-инженерной конструкции αS1CnhLFпри трансплантации самкам-реципиентам у мышей и кроликов и общая эффективность трансгеноза | |||||||||
Вид живо- |
Число, шт. |
Беременных самок-реципи- |
Родившихся потомков |
Прижива- |
Эффек- |
||||
самок-реципи- |
транс- |
все- |
транс- |
||||||
всего |
доля, % |
всего |
доля, % |
||||||
Мышь |
11 |
155 |
3 |
27,0 |
12 |
2 |
16,7 |
7,7 |
1,3 |
Кролик |
6 |
120 |
2 |
33,0 |
6 |
1 |
16,7 |
5,0 |
0,8 |
|
Рис. 3. Электрофореграмма ампликонов, ограниченных праймерами Lf4/Lf10 (A) и N377/Lf5 (Б), при ПЦР-анализе геномной ДНК потомства соответственно у мышей и кроликов, полученного после тран-сплантации зигот, микроинъецированных генно-инженерной конструкцией αS1CnhLF : 1-10 и 16-27 — образцы ДНК, выделенные из тканей рожденного потомства; «+» — образцы ДНК, выделенные из тканей хвоста трансгенных мышей, а также из тканей уха и хвоста трансгенного кролика; 11 и 28 — маркеры моле- |
кулярных масс соответственно 100 и 1000 п.н. ДНК; 12 и 29 — отрицательный контроль (деионизированная вода); 13 — отрицательный контроль (ДНК мыши); 14, 15 и 30 — положительный контроль (конструкция αS1CnhLF, разведения соответственно 1:250 000, 1:500 000 и 1:500 000). 1 % агарозный гель; стрелки указывают на положение фрагментов ДНК соответствующего размера. |
|
Очевидно, что даже при стандартизации методики эксперимента эффективность выхода трансгенных животных может варьировать в зависимости от качества вымытых эмбрионов, условий проведения микроманипуляций, точности определения объема вводимой конструкции, степени ее очистки и т.д. Кроме того, наряду с приживаемостью трансплантируемых эмбрионов на этот показатель влияет эффективность интеграции микроинъецированной генно-инженерной конструкции, определяемая как доля (%) трансгенных животных среди новорожденных.
Итак, создана генно-инженерная конструкция αS1CnhLF, содержащая ген лактоферрина человека, которая при микроинъекции в пронуклеусы зигот мыши и кролика не оказывает значительного отрицательного влияния на развитие эмбрионов in vitro, а также обладает способностью интегрировать в геном реципиента. Мы не наблюдали достоверных различий по частоте интеграции трансгена у животных этих видов (16,7 %) при общей эффективности трансгеноза соответственно 1,3 и 0,8 %. Следовательно, можно расширить сферу применения описанной конструкции и рекомендовать ее использование для получения трансгенных животных других видов — например, мелкого и крупного рогатого скота.
Л И Т Е Р А Т У Р А
1. B r e m G., B e s e n f e l d e r U., Z i n o v i e v a N. e.a. Mammary gland specific expression of chymosin constructs in transgenic rabbits. Theriogenology, 1995, 43: 175-175.2. K i m S.J., L e e K.-W., Y u D.-Y. e.a. Expression analysis of a bovine β-casein human lactoferrin hybrid gene in transgenic mice. J. Reprod. Dev., 1997, 43: 143-149.
3. M e a d H., G a t e s L., L a c y E. e.a. Bovine alpha S1-casein gene sequences direct high level expression of active human urokinase in mouse milk. Bio. Technol., 1990, 8: 443-446.
4. H i r a b a y a s h i M., T a k a h a s h i R., T t o d К. e.a. Comparative study on the integration of exogenous DNA into mouse, rat, rabbit and pig genomes. Exp. Anim., 2001, 50(2): 125-131.
5. B r i n s t e r R.L., C h e n H.Y., T r u m b a u e r M.E. e.a. Factors affecting the efficience of introducing foreign DNA into mice by microinjecting eggs. PNAS USA, 1985, 82: 4438-4442.
6. L i m o n t a J.M., C a s t r o F.O., M a r t i n e z R. e.a. Transgenic rabbits as bioreactors for the production of human growth hormone. J. Biotechnol., 1995, 40: 49-58.
7. N o t t l e M.B., H a s k a r d K.A., V e r m a P.J. e.a. Effect of DNA concentration on transgenesis rates in mice and pigs. Transgenic Res., 2001, 10(6): 523-531.
8. L o n n e r d a l B., L y e r S. Lactoferrin: molecular structure and biological function. Ann. Rev. Nutr., 1995, 15: 93-110.
9. S o k o l o v A.V., P u l i n a M.O., K r i s t i v a n A.V. e.a. A study of recombinant human laсtoferrin secreted in milk of transgenic mice. Dokl. Biochem. Biophys., 2006, 411: 336-338.
10. Г л о в е р Д. Клонирование ДНК. Методы. М., 1988.
11. М а н и а т и с Т. Молекулярное клонирование. М., 1984.
12. Г л о в е р Д. Новое в клонировании ДНК. Методы. М., 1989.
13. М а г д а И.И. Оперативная хирургия. М., 1990.
14. K a n e M.T. Variability in different lots of commercial bovine serum albumin affects cell multiplication and hatching of rabbit blastocysts in culture.J. Reprod. Fertil., 1983, 69: 555-558.
15. B l i n N., S t a f f o r d D.V. A general method for isolation of high molecular weight DNA from eukaryotes. Nucl. Acids Res., 1976, 3: 2303-2308.
16. П л о х и н с к и й Н.А. Биометрия. Новосибирск, 1961.
17. С у р а е в а Н.М., Т р у х а н Р.С. Некоторые методологические приемы введения чужеродного гена в зиготы животных. Генно-инженерные животные, 1995, 1: 227-243.
18. П о п о в а Е.А., К р и в о х а р ч е н к о А.С., В и л ь я н о в и ч Л.И. Развитие мышиных эмбрионов in vitro при различных вариантах микроинъекции. Онтогенез, 2002, 33(2): 107-110.
INTEGRATION EFFECIENCY OF THE HUMAN LACTOFERRIN GENE IN THE MOUSE AND RABBIT GENOM
S.I. Tevkin, M.S. Shishimorova, V.А. Ezerskii, T.P. Trubitsina, О.B. Fatkulina, V.P. Ryabykh
The authors have created the aS1CnhLF gene-engineered construction containing cDNA of the humah lactoferrin gene (hLF) fused with the 5'- and 3'- flanking region of bovine aS1-caseine gene of cattle. After microinjection of construct into nucleus of the mice and rabbits zygotes the authors estimated the ability to survive between the mice and rabbit embryos in vitro after integration of the transgene in blastocyst which was detected by PCR. The transgenic animals were obtained after the transplantation of the injected zygotes to the reproductive tract of female-recipients. The frequency of the transgene integration in the genom of mice was 16.7 % as well as rabbit, the efficiency of transgenose technology — 1.3 % and 0.8 %, respectively.
Key words: geneengineering construction, lactoferrin, microinjection, pronucleus, transgenic rabbits.
ГНУ Всероссийский НИИ физиологии, биохимии |
Поступила в редакцию
16 июля 2008 года |