УДК 636.4:636.082.12:577.21
СОСТОЯНИЕ ХРОМОСОМНОГО АППАРАТА У СВИНЕЙ, ТРАНСГЕННЫХ ПО ГЕНУ СОМАТОЛИБЕРИНА ЧЕЛОВЕКА MT1/RhGH
Л.К. ЭРНСТ1, П.М. КЛЕНОВИЦКИЙ2, В.А. БАГИРОВ1, Н.А. ВОЛКОВА2,
Н.А. ЗИНОВЬЕВА2, И.В. ГУСЕВ2, С.С. ДАНЧ2, Г. БРЕМ3
В 11 поколениях свиней, трансгенных по гену mMT1/RhGH, и их нетрансгенных аналогов оценили степень цитогенетической изменчивости по частоте хромосомных аберраций и числу ядрышковых организаторов. Выявлено уменьшение доли аберрантных клеток у трансгенных животных с увеличением порядкового номера генерации. Отмечено достоверное превышение числа активных ядрышковых организаторов относительно контроля у трансгенных особей во всех обследованных поколениях.
Ключевые слова: аберрации, трансгенные свиньи, хромосомы, ядрышковый организатор.
Эксперименты по генетической трансформации животных выявили не только перспективность этого направления исследований (1-3), но и то, что взаимодействие генетической конструкции и генома клетки-хозяина сказывается на состоянии ее хромосомного аппарата: у 5-10 % животных при введении экзогенной ДНК отмечалась дестабилизация генома (1-4). Трансгенез сопровождался хромосомными перестройками (5), хромосомную изменчивость наблюдали у трансгенных свиней и кроликов (6, 7).
Возможна также модификация активности собственных резидентных генов под влиянием рекомбинантных конструкций. Действительно, у нескольких поколений свиней, трансгенных по mMT1/RhGH (ген соматолиберина человека), при вакцинации отмечали повышение иммунореактивности (8), что свидетельствует об усилении биосинтеза белка иммунокомпетентными клетками.
Известно, что с интенсивностью синтетических процессов связано состояние ядрышкообразующих районов хромосом (ЯОР), несущих гены рибосомальной РНК (рРНК), количеством которой лимитируется формирование клеточных рибосом (например, в фибробластах человека активность ядрышковых организаторов — ЯО достоверно коррелирует с содержанием зрелой рРНК) (9, 10). В норме для клеток каждого вида на каждой стадии онтогенеза характерно определенное число функционирующих ЯО (11), однако их число и активность варьируют в зависимости от активности генома. При микроскопировании транскрипционно активные кластеры генов рРНК визуализируют с помощью серебрения (12), которое, таким образом, может использоваться для выявления состояния ЯО у особей, трансгенных по генам соматотропного каскада. Оценка интенсивности обменных процессов у таких животных имеет важное значение, поскольку предполагается, что дополнительный синтез гормонов приведет к ее повышению.
Цель настоящей работы заключалась в изучении спонтанной цитогенетической изменчивости, активности ЯО и экспрессии генов рРНК у свиней, трансгенных по гену соматолиберина человека.
Методика. Исследования выполняли в 1995-2008 годах в экспериментальном хозяйстве Всероссийского НИИ животноводства (ВНИИЖ) «Кленово-Чегодаево» на помесных свиньях (крупная белая ½ ландрас). Анализировали метафазные хромосомы (препараты получали из лимфоцитов периферической крови по общепринятой методике с авторскими модификациями) (13, 14). В шести генерациях (II, III, IV, VI, X и XI) изучали активность ЯО у 57 потомков хряка 6331, трансгенного по гену соматолиберина человека, — 33 трансгенных (опыт) и 24 не унаследовавших генетическую конструкцию (контроль) особей. У 30 животных (как трансгенных особей, так и их аналогов) оценивали спонтанную изменчивость хромосом.
ЯО выявляли избирательным окрашиванием азотнокислым серебром (15), нарушения хромосомного аппарата — при окрашивании по Романовскому-Гимза. Препараты просматривали в микроскопе Nikon microphot-FX (Япония). Для документирования результатов использовали цифровую видеокамеру KC-583C (Тайвань), а также систему регистрации и обработки видеоизображений Image Scope 1 («Системы для микроскопии и анализа», Россия). Для статистической обработки результатов использовали метод Стьюдента.
 |
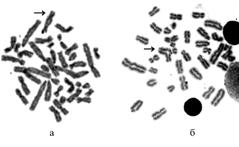
Рис. 1. Нормальный кариотип хряка 0422, трансгенного по гену соматолиберина человека (II генерация). |
Результаты. У обследован-ных животных, трансгенных по гену соматолиберина человека, в большинстве клеток содержалось 38 хромосом, то есть кариотип соответствовал видовой норме (рис. 1). При этом наблюдались различные хромосомные аберрации: у контрольных животных — в основном одиночные хроматидные пробелы и разрывы (в единичных клетках — изохроматидные разрывы), у трансгенных особей — разрывы и обменные перестройки хромосом, представленные дицентриками и транслокациями (рис. 2).
|
Рис. 2. Обменные хромосомные аберрации, выявленные в метафазах у свиней, трансгенных по гену соматолиберина человека: а — дицентрик, б — транслокация (отмечены стрелками). Увеличение ½100, микроскоп Nikon microphot-FX (Япония), цифровая видеокамера KC-583C (Тайвань), система регистрации Image Scope 1 («Системы для микроскопии и анализа», Россия). |
Наименьшую долю клеток с хромосомными аберрациями отмечали в контроле: в среднем она равнялась 3,71±0,37 % (пределы значений — от 3,1 до 4,0 %). У трансгенных особей II генерации этот показатель достигал величины 38,8 %, в III он достоверно снижался до 24,0 % (p < 0,001), в IV, VI, X и XI генерациях — оказался достоверно меньше, чем во II и III (p < 0,001) (рис. 3).
ЯОР, выявляемые при окрашивании азотнокислым серебром, у домашних свиней по локализации соответствуют зонам вторичных перетяжек на 8-й и 10-й парах хромосом (для животных европейских пород типично преобладание таких ЯОР на 10-й паре) (16, 17). По нашим данным, в хромосомах изученных свиней имелось от одного до четырех активных ЯО. У контрольных (нетрансгенных) животных преобладали метафазы с
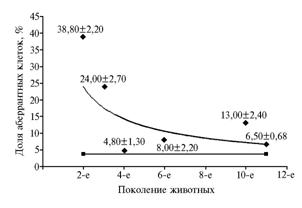 |
Рис. 3. Степень хромосомной изменчивости в поколениях свиней, трансгенных по гену соматолиберина человека. Ромбами и квадратами отмечены показатели соответственно для трансгенных и контрольных животных. |
двумя активными ЯО, которые располагались на 10-й паре хромосом в области вторичной перетяжки (рис. 4). У трансгенных подсвинков (рис. 5) отмечали различное чи-сло активных ЯО: в подавляющем большинстве метафаз ЯО четко выявлялись на обоих гомологах 10-й пары, и лишь в единичных случаях на одной из хромосом 10-й пары метка отсутствовала. Изменения в числе ЯО оказались связаны преимущественно с наличием дополнительных меток на 8-й паре хромосом.
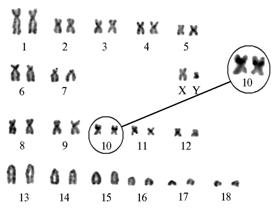 |
Рис. 4. Кариотип контрольного (нетрансгенного) хряка с активными ядрышковыми организаторами (ЯО). Окраска сернокислым серебром по W. Howell и D. Black (1980). Активные ЯО локализованы на хромосомах 10-й пары. |
Высказывалось мнение о различии между домашними свиньями европейского и азиатского корня по числу активных ЯО (16, 17), а обнаружение дополнительных активных кластеров генов рРНК у свиней европейских пород рассматривалось как следствие экспериментальной погрешности. В то же время была показана вариабельность числа хромосомных ЯО, выявляемых в лимфоцитах свиней, для большинства пород (18, 19). Кроме того, обследование европейских и азиатских домашних и диких животных выявило у свиней четкие породные различия по числу активных ЯО: наименьшее (в среднем более 2) отмечали у европейских домашних свиней (20).
В наших экспериментах число активных ЯО у всех обследованных свиней в среднем составило 2,29±0,09 (p < 0,001). При этом наблюдали значительные индивидуальные различия, причем достоверных различий между самцами и самками не обнаружили. Межклеточный и межиндивидуальный полиморфизм по среднему числу ЯО в метафазах у свиней ранее отмечала В.Н. Стефанова (21).
Уровень экспрессии локализованных в отдельных ЯОР рибосомных генов, который в клетках может варьировать (22, 23), принято оценивать полуколичественно по сумме баллов (24). Однако число активных центров синтеза рРНК у свиней в несколько раз ниже, чем у человека, в связи с чем на балльную оценку в большей степени влияет субъективный фактор. Поэтому при анализе экспрессии рибосомных генов мы основывались на подсчете числа активных ЯО (табл.).
Во всех обследованных генерациях число активных ЯО у трансгенных свиней было достоверно выше. Разность между показателями у трансгенных и контрольных особей колебалась от 0,34 (III и XI генерации) до
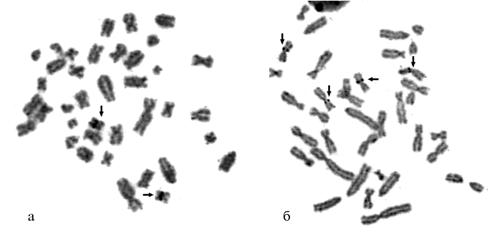 |
Рис. 5. Метафазы подсвинка, трансгенного по гену соматолиберина (XI генерация). Стрелками отмечены ядрышковые организаторы (ЯО): а — локализованные на 10-й паре хромосом, б — четыре активных ЯО на хромосомах 8-й и 10-й пар. Окраска азотнокислым серебром по W. Howell и D. Black (1980). Увеличение ½100, микроскоп Nikon microphot-FX (Япония), цифровая видеокамера KC-583C (Тайвань), система регистрации Image Scope 1 («Системы для микроскопии и анализа», Россия). |
0,88 (X генерация) и в среднем равнялась 0,48 (p < 0,01 при оценке по критерию Стьюдента).
| Среднее число активных ядрышковых организаторов (ЯО) в разных генерациях у свиней, трансгенных по mMT1/RhGH, и контрольных животных | |||
Генерация |
Среднее число ЯО, число обследованных животных |
||
трансгенные |
контроль |
разность |
|
II |
2,35±0,11, n = 7 |
1,94±0,05, n = 3 |
0,41±0,12** |
III |
2,31±0,05, n = 4 |
1,97±0,02, n = 4 |
0,34±0,06** |
IV |
2,80±0,20, n = 4 |
2,36±0,12, n = 6 |
0,44±0,23* |
VI |
2,52±0,08, n = 10 |
2,05±0,09, n = 5 |
0,47±0,12** |
X |
2,88±0,12, n = 4 |
2,00±0,07, n = 3 |
0,88±0,14*** |
XI |
2,29±0,03, n = 4 |
1,95±0,05, n = 3 |
0,34±0,06** |
В среднем |
2,51±0,04, n = 33 |
2,08±0,09, n = 24 |
0,43±0,10*** |
* p < 0,1; ** p < 0,01; *** p < 0,001. |
|||
Вероятно, активация дополнительных кластеров генов рРНК в лимфоцитах у свиней, трансгенных по гену соматолиберина человека, обусловлена повышенной секрецией соматотропина, которую стимулирует экзогенный соматолиберин, и участием первого в регуляции процессов клеточного метаболизма. Гормон роста способен усиливать белковый обмен, а также синтез нуклеиновых кислот, в том числе иРНК и тРНК (25, 26), что сопровождается ростом числа рибосом и полисом и, следовательно, неизбежным усилением синтеза рРНК. Детальный анализ механизма участия соматотропина в регуляции генной активности затруднен, поскольку гормон роста не имеет определенной периферической мишени. Активирующий эффект соматотропина, очевидно, проявляется при связывании со специфическими рецепторами клеток (для ряда гормонов показана зависимость функциональной активности от способности «сшивать» специфические поверхностные рецепторы клетки) (27). Не исключено, что ЯО-стимулирующее действие соматолиберина осуществляется при связывании соматотропина или инсулиноподобного фактора роста с инсулиновыми рецепторами. Возможно также, что в активации ЯО задействованы механизмы иммунного ответа, однако с таким объяснением плохо согласуются числовые вариации активных ЯОР в лимфоцитах у нетрансгенных особей, отмеченные нами и другими авторами у большинства обследованных пород свиней и других видов животных.
Итак, мы установили, что у трансгенных свиней возрастает число нарушений хромосомного аппарата, однако в потомстве первичной трансгенной особи в ряду генераций происходит стабильное снижение доли аберрантных клеток; аналогичные данные получены нами ранее на кроликах. Вероятнее всего, выявленный уровень хромосомной изменчивости обусловлен не интеграцией и экспрессией генной конструкции, а сопутствующей мутацией. Например, у человека известна мутация, приводящая к повышенной ломкости хромосом при пигментной ксеродерме. У обследованных животных в наших опытах мутация, подобная описанной, могла возникнуть при генно-иженерных манипуляциях с эмбрионами в процессе трансформации, однако она, скорее всего, не сцеплена с вводимой генной конструкцией. Более вероятно, что присутствие экзогена влияет на взаимодействия между реципиентным генотипом и внешними факторами. Изменение характера этого взаимодействия приводит к нестабильности хромосом. В любом случает дестабилизирующий эффект интеграции генной конструкции в геном организма-хозяина сказывается на состоянии его хромосомного аппарата, и этот эффект следует учитывать при сохранении и размножении трансгенных животных.
Л И Т Е Р А Т У Р А
1. B r e m G. Trangenic animals. Byotechnology, 1993, 2: 745-832.2. Э р н с т Л.К. Проблемы селекции и биотехнологии сельскохозяйственных животных. М., 1995.
3. З и н о в ь е в а Н.А., Э р н с т Л.К., Б р е м Г. Трансгенные животные и возможности их использования. М., 2001.
4. К л е н о в и ц к и й П.М., Н е к р а с о в А. А. Мутационные изменения у трансгенных животных. В сб. науч. тр. ВИЖ: Актуальные проблемы развития животноводства. Дубровицы, 1998, вып. 57, ч. 4: 184-191.
5. M a r x J.L. Making mutant mice by gene transfer. Science, 1985, 228: 1516-1517.
6. B a g i r o v V.A., K l e n o v i t s k y P.M., Z i n o v´ e v a N.A. Analysis of chromosome aberrations in transgenic pigs and rabbits. In: Book of аbstracts of the 54th Annual Meeting of the European Association for Animal Production. Animal Genetics. Rome, Italy, 2003: 14.
7. Z i n o v´ e v a N., K l e n o v i t s k y P., D o z e v A. e.a. Comparative study of chromosomal status in transgenic and nontrangenic rabbits. In: Proc. Intern. conf. «Actual problems of DNA-technologies and cell engineering of agricultural animals». Dubrovitzy, 2001: 125-126.
8. Э р н с т Л.К. Генетические основы селекции сельскохозяйственных животных. М., 2004.
9. С т е н т Г., К э л и д е р Р. Молекулярная генетика. М., 1986.
10. M o r t o n C., B r o w n J.A., H o l m e s W.A. e.a. Stain intensity of human nucleolus organizer region reflects incorporation of uridine in to mature ribosomal RNA. Expl. Cell Res., 1983, 145(2): 405-413.
11. П р о к о ф ь е в а - Б е л ь г о в с к а я А.А. Материальные основы наследственности. В кн.: Основы цитогенетики человека /Под ред. А.А. Прокофьевой-Бельговской. М., 1969: 9-63.
12. M i l l e r D. A., B r e g W. R., W a r b u r t o n D. e.a. Regulation of rRNA gene expression in a human familial 14p+ marker chromosome. Hum. Genet., 1978, 43(2): 289-297.
13. Г р а ф о д а т с к и й А.С., Р а д ж а б л и С.И. Хромосомы сельскохозяйственных и лабораторных млекопитающих. Атлас. Новосибирск, 1988.
14. К л е н о в и ц к и й П.М., М о и с е й к и н а Л.Г., Ж и в а л е в И.К. Лабораторный практикум по цитогенетике животных. Элиста, 1997.
15. H o w e l l W., B l a c k D. Controlled silver staining of nucleolus organizer regions with a protective colloidal developer: in a one step method. Experientia, 1980, 36: 1014-1015.
16. Г р а ф о д а т с к и й А.С. Ядрышкообразующие районы хромосом домашней свиньи. Цит. и ген., 1981, 15(5): 29-31.
17. M e l l i n k C.H.M., B o s m a A.A., d e H a a n N.A. e.a. Distribution of rRNA genes in breeds of domestic pig studied by non-radioactive in situ hybridization and selective silverstaining. Genet. Select. Evol., 1991, 23(1): 168-172.
18. M a y r B., S c h w e i z e r D., G e b e r G. NOR activity, heterochromatin differentiation, and Robertsonian polymorphism in Sus scrofa L. J. Heredity, 1984, 75(1): 79-80.
19. M e l l i n k C.H.M., B o s m a A. A., d e H a a n N.A. e.a. Numerical variation of nucleolar organizer regions after silver staining in domestic and wild Suidae (Mammalia). Anim. Genet., 1992, 23(3): 231-239.
20. L i u W.S., L u X.Z., Q i u H. Number and distribution of silverstained nucleolar organizer regions and evolutionary relationships in domestic pig. Anim. Genet., 1995, 26(5): 293-298.
21. С т е ф а н о в а В.Н. Количественная характеристика ядрышкообразующих районов хромосом свиней. Бюл. ВНИИРГЖ, Л.-Пушкин, 1983, 67: 6-10.
22. С о з а н с к и й О.А., К о н о в а л о в а Т.В., Я в о р о в с к а я О. М. и др. Структурная стабильность ядрышкообразующих районов хромосом человека. В сб.: Хромосомы человека: в норме и патологии. М., 1989: 63-73.
23. D e C a p o a A., A l e i x a n d r e C., F e l l i M.P. e.a. Inheritance of ribosomal gene activity and level of DNA methylation individual gene clusters in a three generation family. Hum. Genet., 1991, 88(2): 146-152.
24. Л я п у н о в а Н.А., Е г о л и н а Н.А., М х и т а р о в а Е.В. и др. Межиндивидуальные и межклеточные различия суммарной активности рибосомных генов, выявляемых Ag-окраской ядрышкообразующих районов акроцентрических хромосом человека. Генетика, 1988, 26(7): 1282-1288.
25. K o s t y o J.L. Rapid effect of growth hormone on amino acid transport and protein synthesis. Ann. N.Y. Acad. Sci., 1980, 148(2): 284-312.
26. K o s t y o J.L., N u t t i n g D.K. Growth hormone and protein metabolism. In: Handbook of physiology. Washington DC, American Physiology Society, 1979, vol. IV, part 2: 187-210.
27. К у л ь б е р г А.Я. Молекулярная иммунология. М., 1985.
THE STATE OF CHROMOSOMAL APPARATUS IN PIGS TRANSGENIC ON MT1/RhGH GENE OF HUMAN SOMATOLIBERIN
L.K. Ernst1, P.M. Klenovitskii2, V.A. Bagirov1, N.A. Volkova2,
N.A. Zinov’eva2, I.V. Gusev2, S.S. Danch2, G. Brem3
In 11 generations of pigs transgenic on mMT1/RhGH gene and their untransgenic analogs the authors evaluated the degree of cytogenetic variability on the frequency of chromosomal aberra-tions and the amount of nucleolar organizers. It was revealed that the part of aberrant cells in transgenic animals is reduced with an increasing of generation number. The reliable exceeding of amount of active nucleolar organizers was marked in comparison with control in transgenic animals in all examined generations.
Key words: aberrations, transgenic pigs, chromosomes, nucleolus organizer.
1Российская академия сельскохозяйственных наук, |
Поступила в редакцию |