doi: 10.15389/agrobiology.2019.1.47rus
УДК 631.872:631.427.22:574.472
Исследования выполнены с использованием оборудования ЦКП «Геномные технологии, протеомика и клеточная биология» ВНИИСХМ. Работы были проведены за счет финансовой поддержки гранта РНФ 18-16-00073.
ТАКСОНОМИЧЕСКИЙ СОСТАВ И ОРГАНИЗАЦИЯ МИКРОБНОГО СООБЩЕСТВА ДЕРНОВО-ПОДЗОЛИСТЫХ ПОЧВ ПОСЛЕ ВНЕСЕНИЯ СОЛОМЫ ЗЕРНОВЫХ КУЛЬТУР И ИСПОЛЬЗОВАНИЯ ПРЕПАРАТА БАРКОН
О.В. ОРЛОВА1, Е.Л. ЧИРАК1, Н.И. ВОРОБЬЕВ1, О.В. СВИРИДОВА1, Т.О. ЛИСИНА1, Е.Е. АНДРОНОВ1, 2, 3
Современная концепция воспроизводства почвенного органического вещества требует закрепления углерода растительных остатков в почве посредством образования устойчивых органических соединений. В этой связи важна роль биопрепаратов, ускоряющих разложение соломы. В настоящем исследовании впервые установлено, что инокуляция соломы препаратом Баркон (комплексная ассоциация микроорганизмов, разработанная во Всероссийском НИИ сельскохозяйственной микробиологии) способствует формированию деструктивных микробных биосистем с набором наиболее эффективных микроорганизмов из почвенного сообщества и упорядоченным действием по разложению растительных остатков соломы. Показано, что наибольшее влияние на состав микробных сообществ, ведущих разложение соломы, оказывают свойства почвы, а не биопрепарат, вид или глубина заделки соломы. Целью работы была оценка таксономического состава почвенного микробного сообщества, разлагающего солому зерновых культур, и роли микроорганизмов, входящих в состав биопрепарата Баркон, в изменении микробиома. В полевом и лабораторных опытах изучали микробные сообщества пахотных дерново-подзолистых почв, разлагающие солому зерновых культур. Солому (ржаная, пшеничная и овсяная) измельчали и инокулировали биопрепаратом Баркон. Функционирование микробного сообщества оценивали по количеству и активности микроорганизмов, агрохимическим показателям почвы. Состав бактериального сообщества почв определяли высокопроизводительным секвенированием библиотек гена 16S рРНК. Скорость разложения соломы контролировалось соотношением в ней С:N, которая составила ряд ржаная солома < пшеничная < овсяная. Применение Баркона увеличило скорость разложения соломы на 18-42 % по сравнению с микрофлорой почвы к 3 мес компостирования. Биопрепарат оказался более эффективен при заделке соломы в слой 0-5 см, чем на 9-12 см. Влияние Баркона на численность, биомассу микроорганизмов и дыхание было малозаметно на фоне роста этих показателей при внесении соломы. Отсутствие роста эмиссии углекислоты с увеличением скорости разложения соломы при внесении Баркона свидетельствовало о секвестрации углерода в почве. Обработка биопрепаратом способствовала формированию микробных деструктивных сообществ с наибольшей эффективностью преобразования соломы и перевода ее в лабильные органические соединения, а затем и в гумусовые вещества почвы. Применение Баркона по сравнению с внесением неинокулированной соломы повышало содержание общего углерода в почве на 4,8-18,4 %. На состав микробных сообществ, ведущих разложение, действовали все изученные факторы (почва, солома, биопрепарат, глубина заделки и время разложения), при этом наиболее значимым был вид почвы. В более кислых дерново-подзолистых почвах при равном содержании гумуса в таксоне Acidobacteria преобладали 1-я и 2-я группы, при величине рН близкой к нейтральной преобладала 6-я группа. Индикатором внесения соломы для дерново-подзолистой почвы во всех опытах был рост числа актинобактерий из семейства Micrococcaceae, особенно в вариантах с инокуляцией соломы биопрепаратом Баркон. При разложении соломы в почве по сравнению с незаделанной наблюдали некоторое ослабление действия Баркона на образование гумификационной трофической цепи, о чем свидетельствовало отсутствие прироста лабильных гумусовых веществ. На основании расширенных таксономических данных о составе почвенного микробного сообщества было установлено, что минорные группы микроорганизмов участвуют наравне с мажорными в образовании сетевых фрактальных структур.
Ключевые слова: микробное сообщество, солома, биопрепараты, Баркон, индекс фрактальных структур.
Разложение растительных остатков и формирование устойчивого к воздействию микроорганизмов органического вещества (гумуса) в пахотных почвах играет важную роль в глобальном круговороте углерода в биосфере. Использование соломы в качестве органического удобрения приобретает существенное значение во всем мире, особенно в связи с развитием технологии no-till (1-5). Например, из-за резкого сокращения в России ресурсов, необходимых для традиционных органических удобрений, потребность в них для воспроизводства гумуса почв может быть удовлетворена лишь на 17-20 %. Известен положительный эффект от внесения соломы на питательный режим, физическое состояние почв, процессы гумусообразования, численность и активность почвенных микроорганизмов (2, 3, 5-7). Однако солома используется недостаточно по причине ее длительного разложения, при этом в почве создается дефицит минерального азота и выделяются фитотоксичные соединения, накапливаются фитопатогены. Решением может стать обработка соломы биопрепаратами для ускорения ее разложения и исключения возможных негативных последствий, что особенно важно для технологии no-till (8-10). Без обработки соломы специальными микроорганизмами лишь 10-20 % ее преобразуется в гумус при внесении в почву. Однако современная агроэкологическая концепция воспроизводства почвенного органического вещества (ПОВ) предполагает закрепление в почве углерода органических субстратов (секвестрация) со снижением их минерализации до СО2 (1, 11), поэтому важно, чтобы биопрепараты для биодеградации соломы усиливали включение углерода пожнивных остатков в почвенное органическое вещество (2, 6, 12).
Одной из актуальных задач в условиях нестабильного климата и нарастающей деградации почв становится управление биологической составляющей почвы с целью увеличения производства сельскохозяйственной продукции, поскольку возможности химизации земледелия и «зеленой революции» снижаются (12). Значимость биоразнообразия и суммарной деятельности микроорганизмов для функционирования почв в целом хорошо изучена, но недостаточно исследовано влияние на биологические процессы наличия и соотношения определенных видов и родов микроорганизмов (таксономическая структура), а также самоорганизации микробного сообщества в конкретной почвенной разности (13-16).
Изучение закономерностей формирования структуры микробного сообщества и его взаимосвязи со свойствами и функционированием почвы — одно из важнейших направлений современной науки (12-14, 16, 17). Задачу осложняет так называемая избыточность микробного комплекса, когда одну функцию (разложение целлюлозы, фиксация азота, денитрификация) осуществляют многие микроорганизмы. Уменьшение численности или исчезновение какого-либо вида микроорганизмов может не сказаться на общем характере процесса в почве (определенной почвенной функции), поскольку их роль переходит к другим (13). По этой причине состав почвенного микробного сообщества не определяют при оценке питательного режима почв, расчете планируемого урожая или составлении моделей крупномасштабных циклов в стабильных условиях (13, 14). Однако в настоящее время, когда нормой становятся резкие изменения климата в течение сезона (аномальное тепло или холод, засуха или избыток осадков) на фоне деградации почв, информация о составе и структуре микробного сообщества может снизить неопределенность предсказаний, касающихся результата биодеградации растительных остатков и даже прогноза урожая (13, 14, 16).
Разложение растительных остатков в почве определяется многими факторами (химический состав, физические свойства почв, гидротермические условия), поэтому наблюдаются значительные различия в скорости процесса, качестве конечных продуктов, коэффициентах гумификации и других показателях (1, 18-20). В настоящее время существуют три основных гипотезы о влиянии биологического фактора и химического состава на конечный результат биотрансформации растительных остатков (18). Согласно химической гипотезе, независимо от исходного состава остатков и микробного деструкционного сообщества, на конечной стадии трансформации будут получены одинаковые соединения (например, гумус одного типа). По другой гипотезе, в зависимости от начального химического состава растительных остатков получаются различные гумусовые вещества. Согласно третьей гипотезе, соединения образуются в зависимости от состава микробного сообщества, ведущего разложение.
Один из способов контролировать состав микробного сообщества, разлагающего солому, — внесение биопрепаратов. Интродуцированные микроорганизмы часто работают только на начальном этапе, а затем их количество снижается, и состояние микробоценоза возвращается к исходному (21, 22). Однако существует вариант, когда изменения в составе микробного сообщества после внесения биопрепарата сохраняются до конца разложения. Последнее возможно не только как результат прямого воздействия количества внесенных микроорганизмов, но и за счет способности биопрепарата изменять связи между ними, составляя трофические цепи по-новому. В обоих случаях возможно получение на выходе субстратов, различающихся количественно и качественно. Этот вопрос изучен недостаточно, хотя очень важен для оценки направленности почвенно-биологических процессов и роли повторного внесения биопрепарата (22).
Препарат Баркон (Всероссийский НИИ сельскохозяйственной микробиологии) представляет собой ассоциацию микроорганизмов, осуществляющую деструкцию лигно-целлюлозных субстратов и последующую их трансформацию в гумусовые вещества (23). Использование препарата оказывает стимулирующее действие на микробиологические процессы трансформации соломы, увеличивая численность микроорганизмов, микробную биомассу, коэффициент гумификации соломы, устраняет ее фитотоксичность (6, 23-25). При обработке соломы (стерни) Барконом без заделки в почву микроорганизмы, участвующие в трансформации растительных остатков, образуют гумификационную трофическую цепь, обеспечивая более эффективное включение в гумусообразовательные процессы как внесенных, так и нативных микроорганизмов.
В настоящем исследовании впервые установлено, что инокуляция соломы Барконом способствует формированию деструктивных микробных биосистем с набором наиболее эффективных микроорганизмов из почвенного сообщества и упорядоченным действием по разложению растительных остатков соломы. Показано, что наибольшее влияние на состав микробных сообществ, ведущих разложение соломы, оказывают свойства почвы, а не биопрепарат, вид или глубина заделки соломы.
Целью работы была оценка таксономического состава почвенного микробного сообщества, разлагающего солому зерновых культур, и роли микроорганизмов, входящих в состав биопрепарата Баркон, в изменении микробиома.
Методика. В лабораторных и полевом опытах изучали состав и функционирование микробного сообщества пахотных дерново-подзолис-тых почв при внесении соломы зерновых культур, инокулированной биопрепаратом Баркон (23). Солому, измельченную на кусочки (1-2 см), обрабатывали препаратом согласно рекомендациям разработчиков (1 мл препарата + 25 мл воды на 10 г сухой соломы). Контролем служили варианты без внесения соломы (абсолютный контроль) и с соломой, обработанной водой.
В лабораторном опыте 1 солому мягкой пшеницы (зольность 3,5±0,2 %, N — 0,7±0,03 %, С:N — 69) инокулировали биопрепаратом Баркон или почвенной суспензией из 1 разведения (10 г почвы в 90 мл воды) и компостировали вне почвы в течение 1 мес. В почву, отобранную из пахотного горизонта дерново-подзолистой почвы (Ленинградская обл., п. Белогорка; Сгум. — 1,27±0,02 %, Nобщ. — 0,11±0,003 %, рНсол. 4,92±0,03), вносили прокомпостированную солому из расчета 3 г/кг почвы, равномерно перемешивая. Опыт проводили в стеклянных сосудах объемом 250 мл, при постоянной влажности 60 % ППВ и температуре 25±2 °С. Продолжительность компостирования с почвой составляла 3 мес, повторность — 2 сосуда на каждый срок анализа, последний срок — 3 сосуда.
В лабораторном опыте 2 пластиковые сосуды объемом 1,5 л наполняли окультуренной дерново-подзолистой почвой из пахотного горизонта (г. Санкт-Петербург—Пушкин, совхоз «Детскосельский»; Сгум. — 4,02±0,06 %, Nобщ. — 0,316±0,02 %, рНсол. 5,63±0,01). Солому ржи (зольность 3,4±0,04 %, N — 0,25±0,02 %, С:N — 193) обрабатывали Барконом или водой и через 1 ч вносили в сосуды из расчета 3 г/кг почвы. Исследовали два варианта заделки соломы: поверхностный (0-3 см) и глубинный (9-12 см). Повторность опыта 5-кратная, длительность проведения — 62 сут при постоянной влажности 60 % ППВ и температуре 25±2 °С. В статье приведены данные по 5 вариантам из 13.
В полевом опыте 3 солому овса (зольность 4,9 %, N — 1,40±0,01 %, С:N — 34) обрабатывали Барконом или водой, перемешивали с почвой (Сгум. — 1,96 %, Nобщ. — 0,194 %, рНсол. 5,62) из расчета 3 г/кг, помещали в капроновые мешочки и укладывали в почву на глубину 0-5 и 10-15 см (опытное поле Всероссийского НИИ сельскохозяйственной микробиологии, г. Пушкин). Повторность 9-кратная, длительность опыта — 1 мес.
Анализы соломы и почвы (из смешанного образца) проводили общепринятыми методами (26, 27) в 3-5-кратной повторности. Содержание неразложившейся соломы в почве определяли методом флотации в 0,5 н. Na2SO4 (28), количество общего углерода — посредством мокрого озоления с бихроматом калия, лабильного водорастворимого органического углерода — по методике Э. Шульц (29). Подвижные гумусовые соединения из почв выделяли 0,1 н. пирофосфатом Na (рН 7,0 или 10,0). Содержание углерода в вытяжках оценивали на спектрофотометре Ultraspec («LKB», Швеция) при λ = 340 нм (30). Дыхание почвы измеряли на газовом хроматографе Цвет 110 (ОАО «Цвет», Россия), детектор — катарометр, газ-носитель — гелий. Микробную биомассу в почве определяли методом субстрат-индуцированного дыхания (31) как суммарную (грибы + бактерии) и грибную биомассу (обработка стрептомицином и рифампицином, 16 мг антибиотика на 1 г почвы). В опыте 1 определяли только грибную биомассу, в опыте 3 — только численность грибов. Азот и углерод микробной биомассы оценивали регидратационным методом (32). Численность физиологических групп микроорганизмов (аммонифицирующие, амилолитические, целлюлозоразлагающие, гумусразлагающие, микромицеты) учитывали при посеве почвенной суспензии на плотные питательные среды (33).
Структуру бактериального сообщества почв определяли с применением высокопроизводительного секвенирования библиотек гена 16S рРНК для отдельных сроков: 2 мес для лабораторных опытов (без повторностей, из смешанных образцов по вариантам), 3 и 17 сут в слое 0-5 см для полевого опыта (повторность 3-кратная).
Таксономический состав бактериального сообщества устанавливали с применением высокопроизводительного секвенирования библиотек гена 16S рРНК. Для этого выделяли из почвы ДНК с использованием наборов MoBio («Qiagen», Германия) (34), библиотеки готовили с помощью ПЦР с универсальными праймерами для гена 16S рРНК F515 и R806 (35). Секвенирование выполняли на приборе GS Junior («Roche», США), результаты обрабатывали в программе QIIME (36).
Биоразнообразие микробных сообществ оценивали по индексу разнообразия Шеннона и коэффициенту сходства Серенсена-Чекановского. При обработке в программе Statistica v6 («StatSoft, Inc.», США) использовали стандартные методы многомерной статистики: метод главных компонент, дисперсионный, корреляционный, фрактальный анализ, граф-анализ. С помощью оригинальных компьютерных программ проводили необходимые вычисления, использующие процедуры дисперсионного, корреляционного и фрактального анализов (37-40). В таблицах и тексте приведены средние значения (М) с доверительными интервалами при уровне значимости р ≤ 0,05 (t0,05 × SEM). Для сравнения библиотек (с малыми частотами) оценивали вероятность того, что частота членства в таксоне будет одинаковой для двух библиотек (41).
Вероятность наблюдаемой разницы (значимость) в присвоении к таксону T оценивали по формуле:
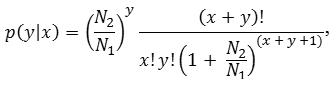
где N1 и N2 — общее количество последовательностей для библиотек 1 и 2, x и y — количество последовательностей, назначенных T, соответственно из библиотек 1 и 2. Одно из основополагающих предположений для этого уравнения состоит в том, что x и y малы относительно N1 и N2 (менее 5 % от общего числа), а N1 и N2 являются относительно большими (более 500).
Результаты. Поскольку связь между содержанием азота в растительных остатках и скоростью их биотрансформации (44, 43) общеизвестна, то, скорее всего, существенные различия в убыли соломы в разных опытах связаны именно с содержанием в ней азота. Влияние состава микробного сообщества на скорость биодеградации в такой степени маловероятно: убыль по массе за 1 мес для пшеничной соломы (опыт 1) при постоянных гидротермических условиях составляла 2,6-3,5 %, для соломы овса в полевых условиях (опыт 3) — от 20,0 до 31,8 % при близких значениях содержания общего углерода в почве. Медленнее всего разлагалась ржаная солома (опыт 2): за 2 мес потеря ее массы была сопоставима с показателем за 1 мес для пшеничной.
За 1 мес компостирования почвы с соломой применение Баркона не оказывало статистически значимого влияния на скорость разложения соломы, независимо от ее вида, глубины заделки и плодородия почвы. Разложение под влиянием биопрепарата существенно ускорялось только к 3-му мес (опыты 1 и 2): потери массы соломы были на 18-42 % выше по сравнению с нативной почвенной микрофлорой. В опыте 2 была выявлена эффективность Баркона при биодеградации в верхних слоях почвы: убыль соломы в слое 0-3 см оказалась больше на 14,8 %, а в слое 9-12 см — меньше на 7,6 % относительно варианта с нативной микрофлорой. Разложение соломы в полевых условиях также протекало несколько быстрее в слое 0-5 см (убыль соломы 30,8-31,8 %), чем в нижнем слое (20,0-30,0 %). Причиной меньшей эффективности глубокой заделки соломы, инокулированной Барконом, может быть то, что в состав препарата входят аэробные микроорганизмы (23, 24). При создании в нижних слоях факультативно анаэробных условий (в отдельных нишах), в том числе в результате активности микроорганизмов, Баркон работает хуже, а за счет изменения трофических связей микробного сообщества даже ухудшает ситуацию относительно варианта без биопрепарата.
В опыте 1 с предварительным компостированием пшеничной соломы применение Баркона за 30 сут увеличило образование водорастворимых гумусоподобных соединений относительно варианта с нативной микрофлорой: индекс светопоглощения составил 9,0±0,2 против 8,0±0,1, коэффициент Е465/Е665 (гумусированность) — 2,7±0,0 и 1,9±0,4. Следует отметить, что как в контроле, так и под действием Баркона одинаково изменялись зольность (с 3,5±0,2 до 5,3±0,6 %), содержание азота (с 0,7±0,05 до 1,07±0,08 %), фосфора (с 0,06±0,0 до 0,16±0,03 %), соотношение С:N (с 69 до 28). Именно с влиянием Баркона при предварительном компостировании мы связываем повышение содержания новообразованных лабильных гумусовых веществ на 25,6 % в опыте 1 по сравнению с их количеством при применении почвенного инокулюма (табл. 1). В варианте солома + Баркон при разложении шло образование гумусоподобных соединений (рост Слаб.), вероятно, менее доступных для микроорганизмов, что и приводило к увеличению содержания общего углерода в почве. Напротив, в варианте солома + почвенный инокулюм биомасса микроорганизмов возрастала на 67,4 % (табл. 2) и после отмирания из-за узкого соотношения С:N (3,4-5,8) в меньшей степени включалась в гумус. Кроме того, в этом варианте либо микробное сообщество усиленно разлагало не только солому, но и лабильные гумусовые вещества, либо их образовывалось меньше, в результате чего количество было ниже даже относительно контроля. Поскольку биомасса микроорганизмов характеризовалась низким С:N, гумусовые вещества, возможно, содержали больше азота, что выразилось в росте содержания общего азота в почве.
При заделке соломы в почву сразу после обработки Барконом (опыты 2 и 3) не наблюдали роста новообразованных гумусовых соединений (см. табл. 1), хотя нельзя сделать однозначный вывод, что это не было связано с типом соломы. Тем не менее применение Баркона повышало содержание общего углерода в почве относительно вариантов без биопрепарата за счет усиления процессов трансформации соломы, в том числе гумификационных. Например, комплексный показатель гумификации (44) при внесении соломы (опыт 2) в контроле составил 2,87, в варианте с биопрепаратом — 3,21. Баркон несколько ослабил негативные последствия внесения соломы на содержание минеральных форм азота в почвах с низким содержанием органического вещества (опыты 1 и 3). Это можно рассматривать как преимущество Баркона, поскольку его использование не требует обязательного внесения минерального азота для разложения соломы (2, 3), что особенно ценно, так как обычно биопрепарат применяется после уборки зерновых, когда азот не нужен для растений.
Внесение соломы ожидаемо увеличивало дыхание микроорганизмов во всех опытах (см. табл. 1). Влияние Баркона на этот показатель на фоне неинокулированной соломы было несущественным. Только в опыте 2 отмечали тенденцию к росту выделения углекислоты из почвы. Усиления дыхания не наблюдали и в экспериментах с Барконом, проведенных другими исследователями (6).
На почвах с низким содержанием общего углерода (опыты 1 и 3) внесение соломы увеличило численность основных групп микроорганизмов в 2 раза и более (табл. 2), что согласуется с данными о большей эффективности удобрений и препаратов на бедных почвах (2, 12, 45). При внесении соломы происходит кратковременная вспышка развития r-стратегов (2, 46): в опыте 3 на 3-и сут наблюдали рост численности аммонифицирующих и амилолитических микроорганизмов, который прекращался уже на 17-е сут. Обработка соломы препаратом не привела к существенным изменениям численности целлюлозолитических микроорганизмов, за исключением опыта 2. В опыте 3 влияние биопрепарата было еще более слабым и не носило постоянного характера. Так, на 17-е сут при внесении Баркона наблюдали некоторое снижение численности целлюлозолитических микроорганизмов в слое 0-5 см.
Баркон влиял на сукцессию микроорганизмов. Так, в опыте 1 коэффициент корреляции между численностью гумусразлагающих микроорганизмов и содержанием остаточной соломы в вариантах с Барконом и почвенным инокулюмом менял направленность (-0,87 против 0,71). Значительное влияние на тесноту и направленность связи между динамикой физиологических групп и количеством оставшейся в почве соломы наблюдали и для других микроорганизмов: коэффициенты корреляции для вариантов с Барконом и без составляли соответственно 0,20 и -0,78 (целлюлозоразлагающие), -0,38 и 0,36 (амилолитические).
Во всех опытах не было обнаружено существенного влияния внесения соломы, препарата и глубины внесения на численность и/или биомассу грибов (см. табл. 2). Возможно, это связано с тем, что в пахотных почвах в процессе разложения растительных остатков возрастает роль бактерий (45). В наших опытах в исследуемые сроки наблюдали некоторое возрастание численности бактерий, в то время как численность грибов менялась незначительно или снижалась: их доля от суммарной биомассы составляла от 14 до 22 %. При внесении соломы увеличивалась не только численность, но и биомасса почвенных микроорганизмов, а влияние обработки биопрепаратом было несущественным (см. табл. 2). Под действием Баркона микробная биомасса скорее уменьшалась, но возрастала ее активность, выражаемая в величине потоков азота через биомассу (служит функцией количества и активности микроорганизмов и отражает работу микроорганизмов в почве) (32). Меньший размер потоков азота в опыте 2 был вызван слабым разложением соломы ржи и низким содержанием в ней азота, поскольку для разложения соломы в окультуренной высокогумусной почве бактериям требуется больше доступного азота (43).
Наличие взаимосвязи между структурой микробного сообщества и агрономическими свойствами почвы при разложении соломы следует из двух дендрограмм (39), полученных для опыта 1, из которых первая была построена по микробиологическим (численность, биомасса, активность) и агрохимическим показателям, а вторая — по таксономическому составу микробного сообщества почв. Дендрограммы имели идентичную структуру кластеров (данные не представлены). Полученные результаты показали, что обработка биопрепаратом Баркон имела сильное влияние на структуру микробного сообщества, поскольку этот вариант не вошел в один кластер с соломой, разлагавшейся почвенным инокулюмом.
Основную массу бактериального сообщества исследованных почв составляли представители фил Actinobacteria и Proteobacteria, существенное количество микроорганизмов принадлежало филам Acidobacteria, Chloroflexi, Firmicutes, Gemmatimonadetes (табл. 3).
Микробный препарат Баркон содержал значительное число видов микроорганизмов (рис. 1), не совпадающее с почвенным микробиомом. Например, в Барконе было почти на порядок меньше типичных почвенных обитателей — Acidobacteria. В то же время в биопрепарате по сравнению с почвой была выше доля Bacilli, Sphingobacteria и Gemmatimonadetes. Биопрепарат Баркон предназначен для разложения целлюлозосодержащих отходов, поэтому в его бактериальном сообществе много актиномицетов (Cellulomonas, Corynebacterium, Micrococcaceae), разлагающих целлюлозу и другие труднодоступные органические соединения, причем различия с почвой составляли как минимум порядок.
При анализе бактериального сообщества дерново-подзолистых почв было выявлено, что микробиомы в трех опытах существенно различались между собой (см. табл. 3). Все три почвы сформировали отдельные кластеры, то есть наибольшее влияние на структуру микробного сообщества оказывал фактор почв (см. табл. 3). Этот вывод отличается от утверждения о том, что главным фактором в формировании микробного сообщества, разлагающего солому, служат климатические условия, а не тип почвы (47). Однако внесение соломы, применение биопрепарата, срок анализа и глубина заделки также оказывали значительное влияние на состав микробного сообщества. Например, при использовании Баркона по сравнению с почвенным инокулюмом (опыт 1) снижалось количество Firmicutes (значимость различий 2,58×10-12) (41), Bacteroidetes (6,34×10-5), Proteobacteria (1,26×10-12) и возрастала доля Acidobacteria (8,07×10-11), Actinobacteria (1,2×10-4) и архей (7,8×10-4).
При анализе полученных данных особое внимание уделяли нескольким наиболее важным таксонам, так как значительная часть микроорганизмов не принимала прямого участия в разложении соломы. Следует отметить, что для каждой почвы был характерен свой, не всегда совпадающий набор семейств в каждом таксоне. Так, чувствительным индикатором для величины рН почв может быть не только представленность класса Acidobacteria, но и его состав (48). В наших опытах установлено, что при близком содержании Сорг. в более кислых почвах в этом таксоне преобладали Acidobacteria 1-й и 2-й групп (соответственно 60 и 18 %), в почвах с величиной рН, близкой к нейтральной, преобладала 6-я группа — 30 % (для опыта 1 — 1-3 %), а 1-ю и 2-ю группы не идентифицировали. Acidobacteria 6-й группы положительно отзывались на внесение соломы на кислой почве (наблюдался рост с 1 до 3 %).
Актиномицеты играют существенную роль в минерализации трудноразлагаемых субстратов, в том числе соломы (2, 17, 49). Индикаторной группой на внесение соломы для дерново-подзолистой почвы во всех опытах служило семейство Micrococcaceae. Его представители входят в состав биопрепарата Баркон (23). Наблюдаемое в опыте 3 на 3-и сут существенное возрастание доли Micrococcaceae от всех актинобактерий в вариантах с соломой (рис. 2) сохранялось на 17-е сут, хотя значительно падало (10, 17 и 26 % соответственно для контроля, соломы и соломы + Баркон). Повышенная доля бактерий этого семейства отмечалась и в опыте 1 на 61-е сут (см. рис. 2). Спорообразующие микроорганизмы из филы Firmicutes также могут принимать участие в разложении свежего органического вещества. Биопрепарат оказывал на ее состав значительное действие, уменьшая количество родов (см. рис. 2). Наибольшее влияние наблюдали в первые дни после внесения соломы и биопрепарата (опыт 3), но оно сохранялось и для более поздних сроков: в опыте 1 число родов в контроле и соломе с почвенным инокулюмом составляло 17, в варианте с Барконом — 10. В опыте 2 с богатой органическим веществом почвой влияние Баркона проявилось только при его заделке в нижний слой: число родов в этой филе для соломы и соломы с Барконом составляло соответственно 15 и 11.
Соотношение грамположительных и грамотрицательных бактерий характеризует олиготрофность почвенных процессов. Известно, что грамотрицательные бактерии требуют более богатого субстрата (свежего органического вещества). При разложении соломы увеличивается их количество, особенно Alphaproteobacteria и Gammaproteobacteria (46, 48). В наших опытах, за исключением первого, не было обнаружено увеличения грамотрицательных бактерий в зависимости от внесения соломы. Даже в опыте 3 при внесении легкоразлагаемой соломы овса мы не обнаружили увеличения доли грамотрицательных бактерий. Причина может быть как в различиях с методами, используемыми другими исследователями (метод жирных кислот), так и в высокой доле некультивируемых микроорганизмов.
Для оценки влияния изучаемых факторов на разнообразие микробных сообществ использовали индекс Шеннона. В опыте 2 при внесении соломы он ожидаемо возрастал относительно контроля. Баркон несколько снижал разнообразие микробного сообщества почвы при разложении соломы в нижнем слое (контроль — 5,04; солома в слое 0-3 и 9-12 см — соответственно 5,47 и 5,57, Баркон — 6,22 и 5,17). В опытах 1 и 3 существенных различий по индексу Шеннона между вариантами не наблюдали. Коэффициент сходства Серенсена-Чекановского показал, что таксономический состав микробного сообщества биопрепарата (для опыта 1) значительно различался с любыми почвенными вариантами (0,54-0,59 против 0,72-0,75). Для опыта 2 состав микробного сообщества, разлагающего солому в верхнем слое, имел наибольшее сходство с контролем (0,82), тогда как обработка Барконом и разложение в нижнем слое снижали коэффициент сходства до 0,67-0,70. Следовательно, при обработке биопрепаратом наибольшие различия по составу микробных сообществ по обоим коэффициентам были при заделке соломы в нижний слой.
При анализе данных таксономического состава по методу главных компонент были показаны существенные различия между почвой и биопрепаратом в опыте 1 (рис. 3, А). Значительными оказались и изменения в структуре микробного сообщества, разлагающего солому, при внесении Баркона. Различия между повторностями были сравнимы с различиями по вариантам (см. рис. 3, В), хотя и на низком уровне (не более 9 %), особенно для варианта с соломой на 17-е сут. Вероятно, это связано с наличием вокруг кусочков разлагающейся соломы дейтритосферы (46, 50, 51). Тем не менее влияние Баркона на 3-е сут было достаточно четким. Для опыта 2 показано значительное различие микробных сообществ в разных слоях (см. рис. 3, Б).
Фрактальный анализ молекулярно-генетических данных, представленных в форме фрактального портрета (23, 37, 38), сводился к под счету числа первичных фрактальных групп (ПФГ). При поиске ПФГ на портрете последовательно анализируется расположение фрактальных триплетов, в которые входят точки, отличающиеся целыми частями логарифма частот встречаемости и расположенные на одной прямой. Абсолютно точное расположение трех точек на одной прямой — исключительная ситуация. Поэтому все найденные ПФГ характеризуются не только таксономическими параметрами групп ОТЕ, но и погрешностью (h) расположения трех точек на одной прямой. Мы предполагаем, что сообщество микроорганизмов, в котором присутствует большее число ПФГ, обладает большей согласованностью и эффективностью совместной преобразовательной деятельности микроорганизмов.
В качестве показателя эффективности совместной преобразовательной деятельности сообщества микроорганизмов предлагается вычислять индекс фрактальных структур микробного сообщества по следующей формуле:
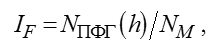
где NПФГ(h) — число разных групп ОТЕ (оперативная таксономическая единица) в первичных фрактальных группах, выделенных на фрактальном портрете микробного сообщества для ln(h) <= -5…-3; NM — общее число групп ОТЕ, объединяющие индивидуальные ОТЕ с близкими частотами встречаемости.
Для успешной утилизации соломы микроорганизмы формируют биосистемы с фрактальной организацией сетевых структур, в которых распределены преобразовательные биохимические роли микроорганизмов и согласуется порядок совместных преобразовательных действий. При неудачной сборке деструктивной биосистемы (например, при отсутствии необходимых микроорганизмов) эффективность преобразований растительных субстратов в почве оказывается низкой, что приводит к снижению индекса фрактальных структур микробного сообщества. Например, в опыте 3 с неинокулированной соломой на 17-е сут индекс фрактальных структур был меньше (IF = 0,80), чем в этом же опыте в варианте с соломой и Барконом на 17-е сутки (IF= 0,83) (табл. 3). Это означает, что микроорганизмы препарата встраиваются в почвенные деструктивные биосистемы при отсутствии в ней необходимых микроорганизмов.
Для формирования деструктивных биосистем микроорганизмам необходимо некоторое время, чтобы настроится на совместную работу, распределить трансформирующие роли и установить порядок преобразовательных действий. Поэтому в опыте 3 на 3-и сут почвенное микробное сообщество (с внесением соломы и Барконом) еще полностью не настроилось (IF= 0,79), а настроилось на 17-е сут (IF= 0,83). Если сравнивать варианты опыта 2, различающиеся глубиной внесения соломы, инокулированной Барконом, то эффективность деструктивной микробной биосистемы была больше при внесении соломы в верхние (см. рис. 3; IF= 0,68), чем в нижние слои почвы (IF= 0,58). Вероятное объяснение заключается в том, обстоятельством, что применение Баркона достигает лучших результатов по формированию деструктивных микробных биосистем, если в составе биосистем превалируют аэробные микроорганизмы, которые могут достаточном количестве получать энергию для биохимических преобразований растительных субстратов посредством окисления органических веществ.
В опыте 1 индексы фрактальных структур (см. табл. 3) в контроле и при инокуляции соломы почвенной вытяжкой были меньше (IF= 0,44 и 0,52), чем при использовании соломы, инокулированной Барконом (IF = 0,75). То есть микроорганизмы в процессе приготовления этого биопрепарата образовали сетевые структуры, готовые к совместной преобразовательной биохимической деятельности.
Таким образом, обработка биопрепаратом Баркон способствует формированию микробных деструктивных сообществ с наибольшей эффективностью преобразования соломы и перевода ее в лабильные органические соединения, а затем и в гумусовые вещества почвы. При разложении соломы в почве по сравнению с незаделанной наблюдается некоторое ослабление действия Баркона на образование гумификационной трофической цепи, о чем свидетельствует отсутствие прироста лабильных гумусовых веществ в соответствующих вариантах. Наибольшее влияние на состав микробных сообществ, ведущих разложение соломы, оказывает вид почвы, меньшее — ее химические, физические, биохимические характеристики. Наличие взаимосвязи комплекса почвенно-микробиологических данных (численность и биомасса микроорганизмов, дыхание) с таксономическим составом микробоценоза подтверждает высокую реакцию состава микробного сообщества на различные воздействия при сохранении корового компонента микробиома, характерного для конкретной почвы. Впервые по микробным профилям почвенных образцов показано, что в вариантах с инокуляцией соломы биопрепаратом Баркон возрастает доля семейства Micrococcaceae, представители которого служат одними из составляющих микробных компонентов этого биопрепарата. Установлено, что минорные группы микроорганизмов участвуют наравне с мажорными в образовании сетевых фрактальных структур. Показано, что микробиологический препарат повышает индекс фрактальных структур микробного сообщества, особенно в верхних слоях пахотного горизонта, то есть создает условия для эффективной утилизации соломы в почве, увеличивая скорость переработки соломы в гумусовые соединения.
Авторы благодарят А.Ю. Колодяжного, Ю.П. Москалевскую и Н.В. Патыку (Украина) за участие в выполнении опыта 2.
1. Агрохимические характеристики дерново-подзолистой почвы при внесении соломы и использовании биопрепарата Баркон (M±t0,05 ×SEM) |
|||||
Вариант |
Собщ., % |
Nобщ., % |
Сумма N-мин., |
С-СО2, |
С-лабильный гумус, мг/кг |
в конце опыта |
среднее за опыт |
||||
Опыт 1 (лабораторный) |
|||||
Контроль |
1,24±0,02 |
0,106±0,003 |
48,7±3,0 |
8,6±1,3 |
699±25 |
Солома + почвенный |
1,25±0,05 |
0,111±0,001 |
19,8±0,2 |
23,6±1,8 |
636±51 |
Солома + Баркон |
1,48±0,06 |
0,106±0,005 |
25,7±1,0 |
25,8±0,9 |
737±55 |
Опыт 2 (лабораторный) |
|||||
Контроль |
3,78±0,05 |
0,313±0,001 |
26,9±0,8 |
8,8±0,1 |
7250±120 |
Солома, 0-3 см |
3,83±0,04 |
0,310±0,001 |
22,4±0,8 |
17,7±1,6 |
8110±320 |
Солома, 9-12 см |
3,81±0,14 |
0,306±0,010 |
18,1±1,7 |
13,8±0,8 |
7620±280 |
Солома + Баркон, 0-3 см |
3,84±0,03 |
0,305±0,010 |
22,9±0,0 |
20,7±1,9 |
6790±10 |
Солома + Баркон, 9-12 см |
3,89±0,08 |
0,307±0,010 |
21,8±1,5 |
15,2±3,2 |
7040±500 |
Опыт 3 (полевой) |
|||||
Контроль, 0-5 см |
1,85±0,05 |
0,178±0,001 |
15,3±0,1 |
8,4±1,8 |
1354±5 |
Контроль, 10-15 см |
1,88±0,01 |
0,178±0,001 |
24,6±1,0 |
6,6±1,0 |
1335±22 |
Солома, 0-5 см |
1,98±0,05 |
0,187±0,002 |
15,3±0,1 |
22,6±3,9 |
1403±7 |
Солома, 10-15 см |
1,89±0,09 |
0,167±0,002 |
17,8±1,0 |
27,4±3,7 |
1413±9 |
Солома + Баркон, 0-5 см |
2,13±0,08 |
0,179±0,001 |
19,5±0,1 |
30,0±2,3 |
1369±14 |
Солома + Баркон, 10-15 см |
1,98±0,08 |
0,182±0,002 |
24,6±2,0 |
25,3±2,0 |
1357±22 |
Примечание. Описание опытов см. в разделе «Методика». Лабильный гумус — содержание С в 0,1 н. пирофосфатной вытяжке, для опытов 1 и 2 — рН 7,0; для опыта 3 — рН 10,0. |
|||||
2. Численность, содержание и активность биомассы микроорганизмов в дерново-подзолистой почве при внесении соломы и использовании биопрепарата Баркон (M±t0,05 ×SEM) |
||||||||
Вариант |
Аммони-фицирующие, млн КОЕ/г почвы |
Амилолитические, млн КОЕ/г почвы |
Гумусразлагающие, млн КОЕ/г почвы |
Целлюлозо-разлагающие, тыс. КОЕ/г почвы |
Микромицеты, тыс. КОЕ/г почвы |
Сб.м., мг/кг |
Nб.м., мг/кг |
Поток N, мг/кг |
Опыт 1 (лабораторный, 2 мес) |
||||||||
Контроль |
3,4±0,2 |
3,1±0,1 |
1,4±0,1 |
0,95 |
– |
344±4 |
55,3±12,2 |
54,0±4,1 |
Солома + почвенный |
6,0±0,1 |
8,2±0,4 |
4,2±0,4 |
15 |
– |
576±56 |
98,7±19,9 |
181,0±7,2 |
Солома + Баркон |
6,8±0,2 |
7,8±0,8 |
4,4±0,4 |
15 |
– |
344±52 |
102,0±9,3 |
25,0±3,4 |
Опыт 2 (лабораторный, 2 мес) |
||||||||
Контроль |
12,0±0,8 |
8,7±0,6 |
6,3±0,6 |
15,8±2,1 |
23,5±3,5 |
571±60 |
43,9±0 |
87,0±6,5 |
Солома, |
16,4±0,3 |
14,0±1,4 |
6,8±1,0 |
65,8±8,1 |
26,5±3,5 |
697±52 |
53,0±4,2 |
112,0±4,6 |
Солома, |
12,9±0,8 |
14,1±1,1 |
9,5±0,7 |
61,8±14,0 |
20,4±2,1 |
807±39 |
53,4±4,9 |
87,0±2,3 |
Солома + Баркон, |
14,3±0,5 |
13,4±1,5 |
8,6±1,0 |
127,2±16,1 |
30,4±3,7 |
626±34 |
45,9±2,7 |
129,0±2,1 |
Солома + Баркон, |
13,8±1,0 |
13,8±1,6 |
8,7±0,9 |
98,9±14,0 |
13,0±1,4 |
603±72 |
41,9±5,6 |
99,0±9,6 |
Опыт 3 (полевой, 3 сут/17 сут) |
||||||||
Контроль, |
18,0±5,9/19,6±7,9 |
9,2±2,8/9,2±4,5 |
4,3±0,2/5,5±1,3 |
8,0±2,8/10,4±2,3 |
13,6±4,2/18,8±4,2 |
562±1/410±12 |
28,8±0/35,2±0 |
253,0±2,3 |
Контроль, 10-15 см |
18,6±6,8/32,1±3,3 |
9,7±2,0/9,5±4,6 |
4,9±0,5/8,1±0,8 |
6,7±0,5/8,5±0,8 |
14,5±1,1/24,0±5,3 |
498±25/460±61 |
27,9±0/38,2±0 |
262,0±13,8 |
Солома, |
107,1±20,2/27,6±3,4 |
67,8±16,7/20,3±8,4 |
8,8±0,3/12,0±2,4 |
7,3±2,4/10,3±3,4 |
10,9±3,6/23,8±6,6 |
694±48/597±118 |
35,2±1,2/54,0±4,8 |
513,0±5,9 |
Солома, |
59,3±0,7/46,4±0 |
69,4±1,5/23,2±0 |
9,8±0,4/14,5±0,8 |
4,7±1,3/3,9±0,8 |
12,5±3,3/23,2±2,7 |
557±60/640±6 |
24,6±6,1/60,6±11 |
821,0±7,8 |
Солома + Баркон, |
70,6±2,1/46,8±12,1 |
54,1±3,5/21,1±5,6 |
11,7±0,5/12,2±1,7 |
11,3±0,8/8,2±1,3 |
16,5±3,2/27,6±2,3 |
525±61/694±14 |
27,2±0/54,0±4,8 |
758,0±4,9 |
Солома + Баркон, |
57,3±3,5/61,2±20,2 |
44,0±13,7/28,1±9,3 |
11,3±0,6/11,90 |
9,7±1,4/7,0±2,3 |
14,5±4,7/29,3±0 |
442±86/710±10 |
25,9±9,3/59,7±9,5 |
858,0±13,1 |
Примечание. Описание опытов см. в разделе «Методика». Сб.м. — С биомассы микроорганизмов, Nб.м. — N биомассы микроорганизмов. Прочерк означает, что показатель не определяли. Поток азота через микробную биомассу (32) был рассчитан за все время опыта: опыт 1 — 103 сут, опыт 2 — 92 сут, опыт 3 — 31 сут. Целлюлозоразлагающие микроорганизмы в опыте 1 определяли методом предельных разведений. |
||||||||
3. Распределение бактерий в дерново-подзолистой почве по мажорным таксонам (% от общего числа операционных таксономических единиц, ОТЕ) при внесении соломы и использовании биопрепарата Баркон (M±t0,05 ×SEM) |
|||||||||||
Вариант |
Мажорные таксоны (различный ранг) |
IF |
|||||||||
Archaea |
Acido-bacteria |
Actino-bacteria |
Bacte-roidetes |
Chloroflexi |
Firmicutes |
Gemma-timonadetes |
Plancto-mycetes |
Рroteo-bacteria |
прочие |
||
Опыт 1 (лабораторный) |
|||||||||||
Контроль |
0,5 |
18,5 |
17,0 |
0,7 |
0,03 |
3,5 |
2,0 |
1,3 |
27,7 |
28,8 |
0,44±0,03 |
Солома + Баркон |
1,3 |
23,7 |
12,6 |
1,8 |
0,10 |
1,8 |
1,8 |
1,6 |
32,8 |
22,5 |
0,75±0,03 |
Солома + почвенный инокулюм |
0,3 |
16,9 |
9,5 |
3,5 |
0,03 |
5,2 |
1,1 |
1,3 |
41,7 |
20,5 |
0,52±0,03 |
Опыт 2 (лабораторный) |
|||||||||||
Контроль |
1,0 |
4,1 |
24,5 |
0,3 |
3,5 |
3,9 |
3,6 |
1,2 |
55,5 |
2,4 |
0,60±0,03 |
Солома, 0-3 см |
1,4 |
5,4 |
26 |
0,5 |
3,7 |
3,1 |
3,8 |
1,9 |
51,1 |
3,1 |
0,58±0,03 |
Солома, 9-12 см |
1,1 |
3,6 |
32,4 |
0,8 |
4,2 |
4,6 |
3,6 |
2,6 |
44,2 |
2,9 |
0,62±0,04 |
Солома + Баркон, 0-3 см |
1,2 |
3,5 |
24,7 |
7,6 |
3,5 |
2,5 |
4,2 |
1,8 |
46,9 |
4,1 |
0,68±0,04 |
Солома + Баркон, 9-12 см |
1,1 |
4 |
28,9 |
0,7 |
4,5 |
3,5 |
4,8 |
1,0 |
49,0 |
2,5 |
0,58±0,04 |
Опыт 3 (полевой) |
|||||||||||
Контроль, 3 сут |
1,9 |
5,8 |
28,6 |
2,0 |
5,2 |
4,6 |
5,3 |
2,0 |
39,3 |
5,3 |
0,78±0,03 |
Солома, 3 сут |
1,7 |
5,5 |
30,7 |
2,6 |
5,5 |
4,7 |
4,2 |
2,3 |
37,6 |
5,2 |
0,88±0,03 |
Солома + Баркон, 3 сут |
2,4 |
5,3 |
34,9 |
3,8 |
4,9 |
5,1 |
4,1 |
2,2 |
32,8 |
4,5 |
0,79±0,03 |
Контроль, 17 сут |
2,7 |
6,8 |
28,7 |
2,9 |
6,2 |
6,3 |
5,8 |
2,5 |
32,5 |
5,6 |
0,83±0,03 |
Солома, 17 сут |
2,2 |
6,9 |
25,6 |
3,8 |
5,4 |
6,2 |
4,7 |
2,4 |
35,9 |
6,9 |
0,80±0,03 |
Солома + Баркон, 17 сут |
2,9 |
6,0 |
29,9 |
3,1 |
5,6 |
5,6 |
4,8 |
2,5 |
34,2 |
5,4 |
0,83±0,03 |
Примечание. Описание опытов см. в разделе «Методика». Архейные филы в силу их относительно малой численности представлены всем доменом. IF — индекс фрактальных структур, рассчитан по полным данным таксономии (на уровне родов). |
|||||||||||
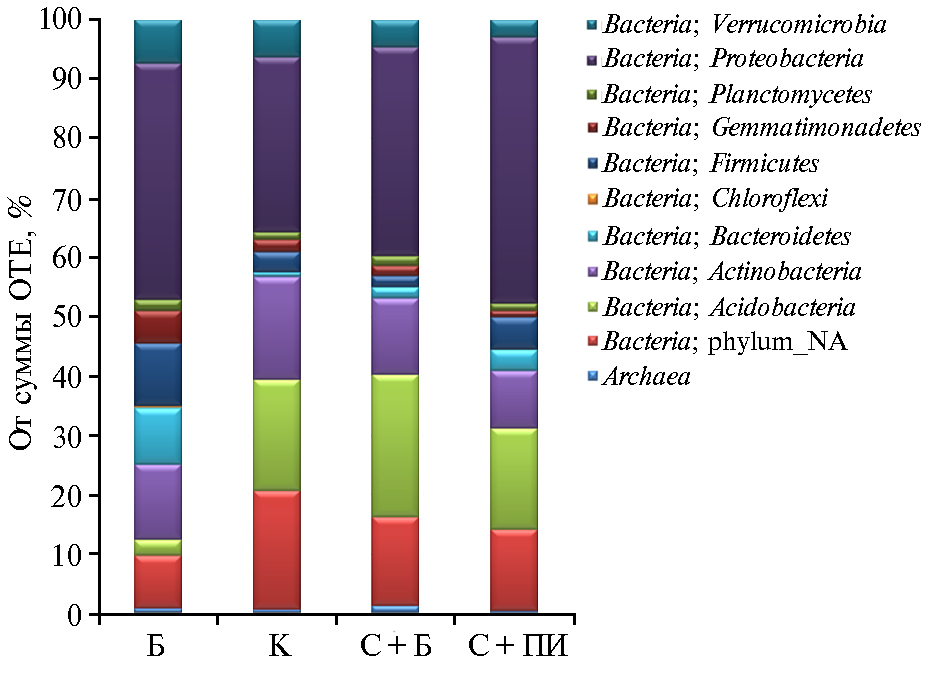
Рис. 1. Состав бактериального микробного сообщества биопрепарата Баркон и дерново-подзолистой почвы при внесении пшеничной соломы и использовании Баркона в опыте 1: Б — Баркон, К — контроль (почва), С + Б — солома + Баркон, С + ПИ — солома + почвенный инокулюм.
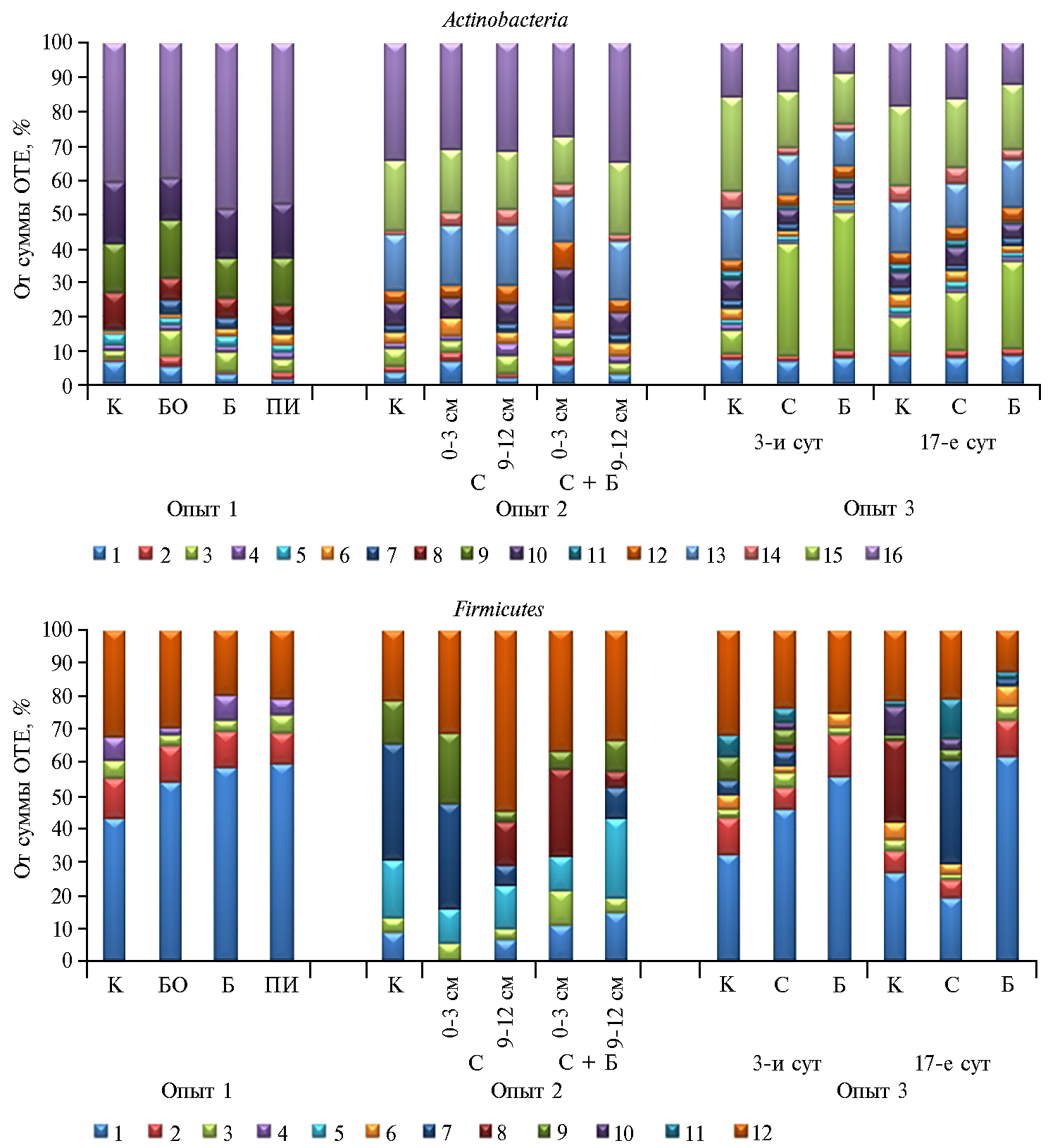
Рис. 2. Состав отдельных фил на уровне семейств в опытах (доля от суммы операционных таксономических единиц — ОТЕ) при внесении в дерново-подзолистую почву соломы и использовании биопрепарата Баркон: К — контроль, БО — без обработки, Б — Баркон, С — солома, ПИ — почвенный инокулюм. Семейства Actinobacteria: 1 — Intrasporangiaceae, 2 — Microbacteriaceae, 3 — Micrococcaceae, 4 — Micromonosporaceae, 5 — Mycobacteriaceae, 6 — Pseudonocardiaceae, 7 — Streptomycetaceae, 8 — Thermomonosporaceae, 9 — Conexibacteraceae, 10 — Solirubrobacteraceae, 11 — Geodermatophilaceae, 12 — Nocardioidaceae, 13 — Gaiellaceae, 14 — Patulibacteraceae, 15 — Solirubrobacterales, 16 — прочие. Семейства Firmicutes: 1 — Bacillaceae, 2 — Paenibacillaceae, 3 — Clostridiaceae, 4 — Planococcaceae, 5 — Carnobacteriaceae, 6 — Alicyclobacillaceae, 7 — Staphylococcaceae, 8 — Lactobacillaceae, 9 — Streptococcaceae, 10 — Veillonellaceae, 11 — [Tissierellaceae], 12 — прочие. Описание опытов см. в разделе «Методика».
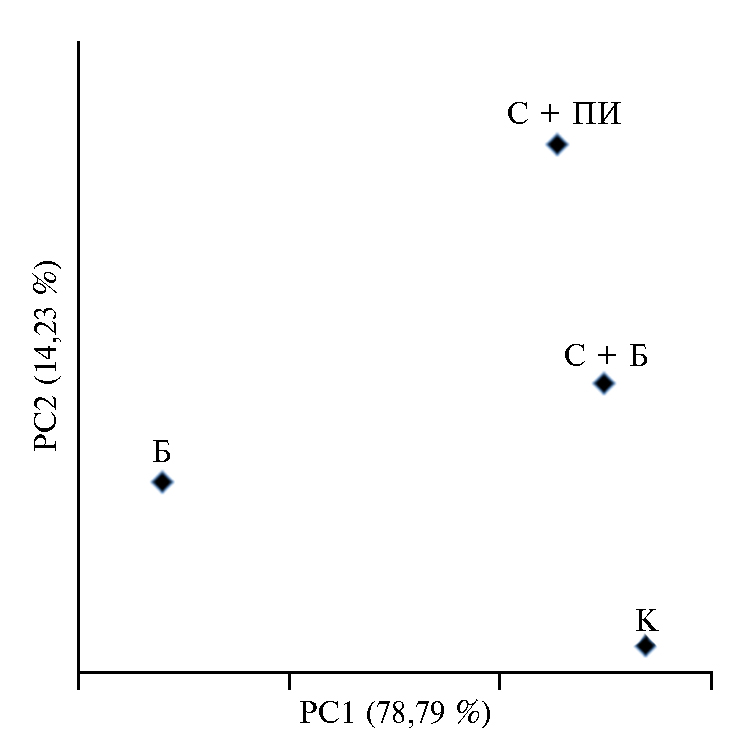
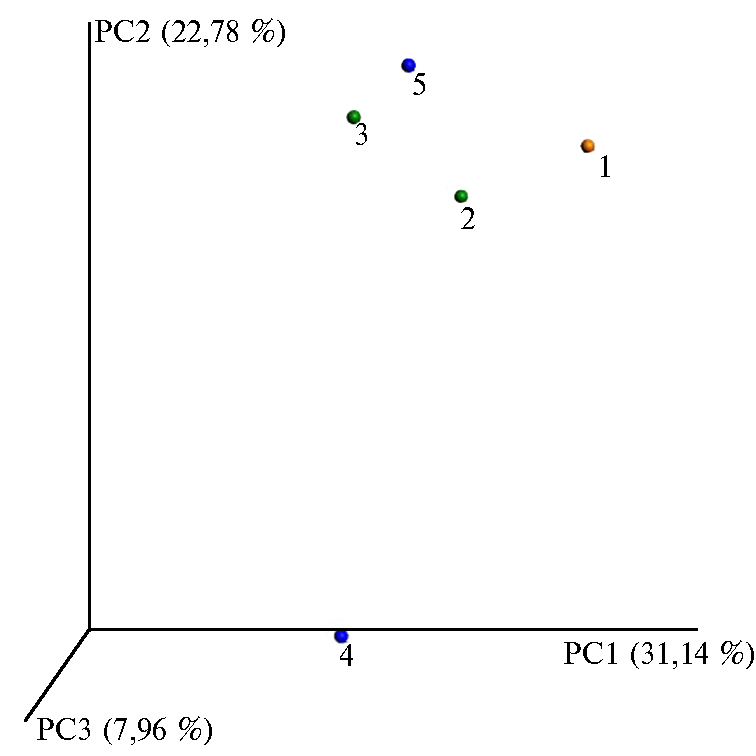
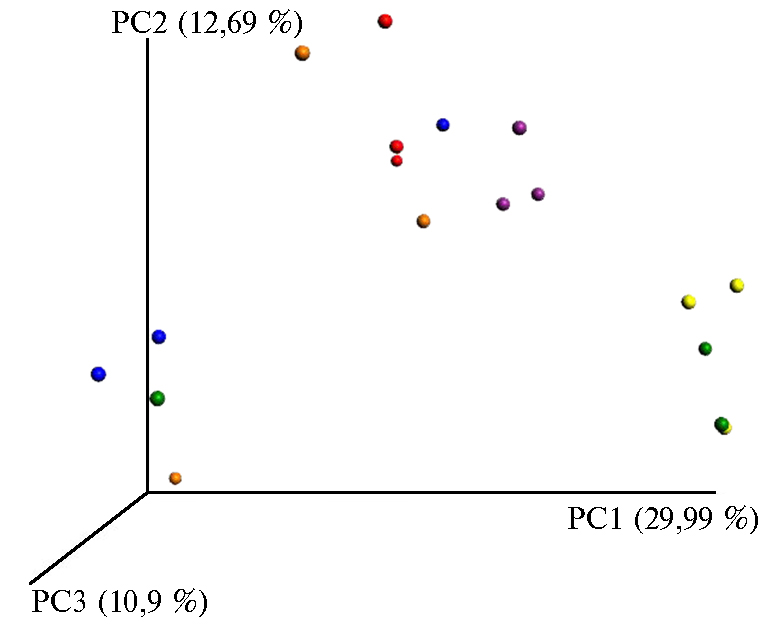
Рис. 3. Анализ различий между пробами методом главных компонент.
А (опыт 1): К — контроль, Б — Баркон, С + Б — солома + Баркон, С + ПИ — солома + почвенный инокулюм.
Б (опыт 2): 1 — контроль, 2 — солома в слое 0-3 см, 3 — солома в слое 9-12 см, 4 — солома + Баркон в слое 0-3 см, 5 — солома + Баркон в слое 9-12 см.
В (опыт 3): цветные обозначения  — соответственно контроль на 17-е сут, контроль на 3-и сут, солома на 17-е сут, солома на 3-и сут, солома + Баркон на 17-е сут, солома + Баркон на 3-и сут. Описание опытов см. в разделе «Методика».
— соответственно контроль на 17-е сут, контроль на 3-и сут, солома на 17-е сут, солома на 3-и сут, солома + Баркон на 17-е сут, солома + Баркон на 3-и сут. Описание опытов см. в разделе «Методика».
ЛИТЕРАТУРА
- Fageria N.K. Role of soil organic matter in maintaining sustainability of cropping systems. Commun. Soil Sci. Plant, 2012, 43(16): 2063-2113 (doi: 10.1080/00103624.2012.697234).
- Использование соломы как органического удобрения /Под ред. Е.Н. Мишустина. М., 1980.
- Mahmoodabadi M., Heydarpour E. Sequestration of organic carbon influenced by the application of straw residue and farmyard manure in two different soils. InternationalAgrophysics, 2014, 28(2): 169-176 (doi: 10.2478/intag-2014-0005).
- Голубев И.Г., Шванская И.А., Коноваленко Л.Ю., Лопатников М.В. Рециклинг отходов в АПК: справочник. М., 2011.
- Surekha K., Reddy K.P.C., Kumari A. P.P., Sta Cruz P.C. Effect of straw on yield components of rice (Oryza sativa L.) under rice‐rice cropping system. J. Agron. Crop Sci., 2006, 192(2): 92-101 (doi: 10.1111/j.1439-037X.2006.00192.x).
- Русакова И.В., Воробьев Н.И. Использование биопрепарата Баркон для инокулирования соломы, применяемой в качестве удобрения. Достижения науки и техники АПК, 2011, 08: 25-28.
- Zhang P., Wei T., Jia Z., Han Q., Ren X., Li Y. Effects of straw incorporation on soil organic matter and soil water-stable aggregates content in semiarid regions of Northwest China. PloS ONE, 2014, 9(3): e92839 (doi: 10.1371/journal.pone.0092839).
- Li P., Zhang D. D., Wang X. J., Wang X., Cui Z. Survival and performance of two cellulose-degrading microbial systems inoculated into wheat straw-amended soil. J. Microbiol. Biotechn., 2012, 22(1): 126-132 (doi: 10.4014/jmb.1102.02021).
- Шершнева О.М., Тарасов С.А. Использование микробиологических препаратов для ускорения деструкции соломы. Вестник Курской государственной сельскохозяйственной академии, 2014, 6: 41-45.
- Pfender W.F., Fieland V.P., Ganio L.M., Seidler R.J. Microbial community structure and activity in wheat straw after inoculation with biological control organisms. Applied Soil Ecology, 1996, 3(1): 69-78 (doi: 10.1016/0929-1393(95)00068-2).
- Семенов В.М., Иванникова Л.А., Тулина А.С. Стабилизация органического вещества в почве. Агрохимия, 2009, 10: 77-96.
- Hatfield J.L., Walthall C.L. Soil biological fertility: Foundation for the next revolution in agriculture? Commun. Soil Sci. Plant., 2015, 46(6): 753-762 (doi: 10.1080/00103624.2015.1005227).
- Nannipieri P., Ascher J., Ceccherini M.T., Landi L., Pietramellara G., Renella G. Microbial diversity and soil functions. Eur. J. Soil Sci., 2003, 54(4): 655-670 (doi: 10.1046/j.1351-0754.2003.0556.x).
- McGuire K.L., Treseder K.K. Microbial communities and their relevance for ecosystem models: decomposition as a case study. Soil Biology and Biochemistry, 2010, 42(4): 529-535 (doi: 10.1016/j.soilbio.2009.11.016).
- Young I.M., Crawford J.W. Interactions and self-organization in the soil-microbe complex. Science, 2004, 304(5677): 1634-1637 (doi: 10.1126/science.1097394).
- Crawford J.W., Deacon L., Grinev D., Harris J.A., Ritz K., Singh B.K., Young I. Microbial diversity affects self-organization of the soil-microbe system with consequences for function. Journal ofthe Royal Society Interface, 2012, 9(71): 1302-1310 (doi: 10.1098/rsif.2011.0679).
- Marschner P., Kandeler, E., Marschner, B. Structure and function of the soil microbial community in a long-term fertilizer experiment. Soil Biology and Biochemistry, 2003, 35(3): 453-461 (doi: 10.1016/S0038-0717(02)00297-3).
- Wickings K., Grandy S., Reed S., Johnson N. The origin of litter chemical complexity during decomposition. Ecology Letters, 2012, 15(10): 1180-1188 (doi: 10.1111/j.1461-0248.2012.01837.x).
- Sonnleitner R., Lorbeer E., Schinner F. Effects of straw, vegetable oil and whey on physical and microbiological properties of a chernozem. Applied Soil Ecology, 2003, 22(3): 195-204 (doi: 10.1016/S0929-1393(02)00159-2).
- Tenney F.G., Waksman S.A. Composition of natural organic materials and their decomposition in the soil: IV. The nature and rapidity of decomposition of the various organic complexes in different plant materials, under aerobic conditions. Soil Sci., 1929, 28(1): 55-84.
- Тихонович И.А., Кожемяков А.П., Чеботарь В.К., Круглов Ю.В., Кандыбин Н.В., Лаптев Г.Ю. Биопрепараты в сельском хозяйстве (Методология и практика применения микроорганизмов в растениеводстве и кормопроизводстве). М., 2005.
- Бикташева Л.Р., Белоногова Н.В., Селивановская С.Ю., Галицкая П.Ю. Эффективность интродукции микроорганизмов, применяемых для направленного изменения свойств компостов. Учебные записки Казанского университета. Серия естественные науки, 2016, 158(4): 493-506.
- Свиридова О.В., Воробьев Н.И., Проворов Н.А., Орлова О.В., Русакова И.В., Андронов Е.Е., Пищик В.Н., Попов А.А., Круглов Ю.В. Выравнивание почвенных условий для развития растений при деструкции растительных остатков микробными препаратами. Сельскохозяйственная биология, 2016, 51(5): 664-672 (doi: 10.15389/agrobiology.2016.5.664rus).
- Свиридова О.В., Михалева Л.В., Воробьев Н.И., Кочетков В.В. Разложение коры хвойных деревьев грибами и бактериями. Микология и фитопатология, 2001, 35(6): 38-47.
- Орлова О.В., Андронов Е Е., Воробьев Н И, Колодяжный А.Ю., Москалевская Ю.П., Патыка Н.В., Свиридова О.В. Состав и функционирование микробного сообщества при разложении соломы злаковых культур в дерново-подзолистой почве. Сельскохозяйственная биология, 2015, 50(3): 305-314 (doi: 10.15389/agrobiology.2015.3.305rus).
- Агрохимические методы исследования почв /Под ред. А.В. Соколова. М., 1975.
- Справочник по анализу органических удобрений /Под ред. А.И. Еськова. М., 2000.
- Сафонов А.П. К методике подготовки образцов почв для определения гумуса. В кн.: Гумус и азот в земледелии нечерноземной зоны РСФСР. Л., 1987: 14-16.
- Шульц Э., Кершенс М. Характеристика разлагаемой части органического вещества почв и ее трансформации при помощи экстракции горячей водой. Почвоведение, 1998, 7: 890-894.
- Паников Н.С., Горбенко А.Ю., Светлов С.В. Способ определения суммарного содержания водорастворимых органических веществ в почве. Патент № 1318909 (СССР) МКП G 01 N 33/24. МГУ им. М.В. Ломоносова (СССР). № 3949440/30-15. Заявл. 06.09.85. Опубл. 23.06.87. Бюл. № 23.
- West A.W., Sparling G.P. Modification to the substrate-induced respiration method to permit measurement of microbial biomass in soils of different water contents. J. Microbiol. Meth., 1986, 5(3-4): 177-189 (doi: 10.1016/0167-7012(86)90012-6).
- Благодатский С.А., Благодатская Е.В., Горбенко А.Ю., Паников Н.С. Регидратационный метод определения биомассы микроорганизмов в почве. Почвоведение, 1987, 4: 64-72.
- Основные микробиологические и биохимические методы исследования почв: Методические указания. Л., 1987.
- Андронов Е.Е., Пинаев А.Г., Першина Е.В., Чижевская Е.П. Научно-методические рекомендации по выделению высокоочищенных препаратов ДНК из объектов окружающей среды. Метод. указ. СПб, 2011.
- Bates S.T.D., Berg-Lyons J.G., Caporaso W.A., Walters A. W., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil. The ISME Journal, 2010, 5: 908-917 (doi: 10.1038/ismej.2010.171).
- Caporaso J.G., Bittinger K., Bushman F.D., DeSantis T.Z., Andersen G.L., Knight R. PyNAST: a flexible tool for aligning sequences to a template alignment. Bioinformatics, 2010, 26(2): 266-267 (doi: 10.1093/bioinformatics/btp636).
- Воробьев Н.И., Свиридова О.В., Патыка Н.В., Думова В.А., Мазиров М.А., Круглов Ю.В. Фрактально-таксономический портрет микробного сообщества как биондикатор вида почвенных деструктивных процессов. Мат. Межд. конф. «Биодиагностика в экологической оценке почв и сопредельных сред». М., 2013: 38.
- Воробьев Н.И., Проворов Н.А., Свиридова О.В., Пищик В.Н., Семенов А.М., Никонов И.Н. Фрактально-таксономический портрет и индекс сетевой организации почвенных микробных сообществ. Мат. Всерос. симп. «Современные проблемы физиологии, экологии и биотехнологии микроорганизмов» /Под ред. А.И. Нетрусова, Н.Н. Колотилова. М., 2014: 55.
- Воробьев Н.И., Свиридова О.В., Кутузова Р.С. Методические рекомендации по использованию граф-анализа в исследованиях биосистем, состоящих из биотических и абиотических компонентов. СПб—Пушкин, 2006.
- Воробьев Н.И., Проворов Н.А., Пищик В.Н., Свиридова О.В. Программа двухфакторного дисперсионного анализа биологических данных. Программа зарегистрирована в ФГУ ФИПС в отделе регистрации программ для ЭВМ № 2014661477 от 30.10.2014.
- Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naïve bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Appl. Environ. Microbiol., 2007, 73(16): 5261-5267 (doi: 10.1128/AEM.00062-07).
- Илялетдинов А.Н. Микробиологические превращения азотсодержащих соединений. Алма-Ата, 1976.
- Fog K. The effect of added nitrogen on the rate of decomposition of organic matter. Biological Reviews, 1988, 63(3): 433-462 (doi: 10.1111/j.1469-185X.1988.tb00725.x).
- Бакина Л.Г. Роль фракций гумусовых веществ в почвенно-экологических процессах. Автореф. докт. дис. СПб, 2012.
- Мишустин Е.Н. Микроорганизмы и плодородие почвы. М., 1956.
- Bastian F., Bouziri, L., Nicolardot, B., Ranjard, L. Impact of wheat straw decomposition on successional patterns of soil microbial community structure. Soil Biology and Biochemistry, 2009, 41(2): 262-275 (doi: 10.1016/j.soilbio.2008.10.024).
- Sun B., Wang X., Wang F., Jiang Y., Zhang X.X. Assessing the relative effects of geographic location and soil type on microbial communities associated with straw decomposition. Appl. Environ. Microbiol., 2013, 79(11): 3327-3335 (doi: 10.1128/AEM.00083-13).
- Sait M., Davis K.E.R., Janssen P.H. Effect of pH on isolation and distribution of members of subdivision 1 of the phylum Acidobacteria occurring in soil. Appl. Environ. Microbiol., 2006, 72(3): 1852-1857 (doi: 10.1128/AEM.72.3.1852-1857.2006).
- Griffiths B.S., Ritz K., Ebblewhite N., Dobson G. Soil microbial community structure: effects of substrate loading rates. Soil Biology and Biochemistry, 1998, 31(1): 145-153 (doi: 10.1016/S0038-0717(98)00117-5).
- Nicolardot B., Bouziri L., Bastian F., Ranjard L. A microcosm experiment to evaluate the influence of location and quality of plant residues on residue decomposition and genetic structure of soil microbial communities. Soil Biology and Biochemistry, 2007, 39(7): 1631-1644 (doi: 10.1016/j.soilbio.2007.01.012).
- Kramer S., Dibbern D., Moll J., Huenninghaus M., Koller R., Krueger D., Marhan S., Urich T., Wubet T., Bonkowski M., Buscot F. Resource partitioning between bacteria, fungi, and protists in the detritusphere of an agricultural soil. Front. Microbiol., 2016, 7: 1524 (doi: 10.3389/fmicb.2016.01524).