doi: 10.15389/agrobiology.2019.1.3rus
УДК 632
ФИТОПЛАЗМЕННЫЕ БОЛЕЗНИ: ИСТОРИЧЕСКИЙ ОБЗОР К 50-ЛЕТИЮ ОТКРЫТИЯ ФИТОПЛАЗМОЗОВ
Д.З. БОГОУТДИНОВ1, Т.Б. КАСТАЛЬЕВА2, Н.В. ГИРСОВА2, Л.Н. САМСОНОВА3
Фитоплазменные болезни были известны задолго до открытия их возбудителя. С начала 1930-х годов на постсоветском пространстве была признана инфекционная природа заболевания, известного под названием «столбур томатов». Предпринимались попытки найти переносчика этого заболевания (И.К. Корачевский, 1934; В.Л. Рыжков с соавт., 1934). В 1945 году был обнаружен вектор болезни — циксиида Hyalesthes obsoletus Sign. (К. Сухов с соавт., 1946). В течение нескольких десятилетий в нашей стране и за рубежом безуспешно велись поиски возбудителя инфекционных болезней растений с симптомами карликовости, пожелтения, изменений в листьях и генеративных органах, не способного расти на искусственных питательных средах. Открытие было сделано только в 1967 году японскими исследователями (Y. Doi с соавт., 1967). Возбудителем заболевания оказался ранее неизвестный фитопатоген из класса Molliсutes, сходный с патогенами микоплазмы животных. Позже было установлено, что жизненный цикл фитоплазм связан как с клетками флоэмы растений, в которых они размножаются, так и с насекомыми-переносчиками из отряда Hemiptera, которые питаются соком растений, а также способны поддерживать размножение фитоплазм в своем организме и даже передавать их потомству. Фитоплазмы, как и другие Molliсutes, не имеют клеточной стенки. Они обладают минимальным геномом, известным среди клеточных организмов, что обусловливает их обязательное паразитическое существование. В бывшем СССР фитоплазменные болезни широко изучались во Всесоюзном научно-исследовательском институте защиты растений и в других учреждениях. Для этого использовали методы электронной микроскопии, иммунологические исследования, осуществляли успешное культивирование патогена на искусственных питательных средах. Спустя три десятилетия итальянские ученые смогли добиться культивирования инфекционного агента на искусственных средах и подтвердили его принадлежность к фитоплазме, секвенировав ДНК (А. Bertaccini с соавт., 2010; N. Contaldo с соавт., 2012, 2013). В 1990-е годы с внедрением молекулярно-генетических методов был сделан шаг вперед в области диагностики и изучения свойств фитоплазм. Их таксономия была разработана на основе консервативного гена 16S рибосомальной РНК и получила дальнейшее развитие с привлечением других консервативных и менее консервативных генов (I.-M. Lee с соавт., 1993; B. Schneider с соавт., 1993, 1997; I.-M. Lee с соавт., 1998, 2010; М. Martini с соавт., 2007). Выявлены факторы вирулентности фитоплазмы, которые влияют на растение-хозяина и делают его более привлекательным для насекомых-переносчиков, участвующих в распространении фитоплазм в природе. В последние годы получено много данных об организации геномов различных фитоплазм, уделяется внимание изучению метаболизма фитоплазм, что важно для понимания взаимодействия в системе хозяин—патоген—вектор (К. Oshima с соавт., 2004; Х. Bai с соавт., 2006; А. Hoshi с соавт., 2009; А. Sugio с соавт., 2011; А. MacLean с соавт., 2011; К. Sugawara с соавт., 2013; Z. Orlovskis с соавт., 2016). В России применение молекулярно-генетических методов диагностики позволило определить фитоплазменный характер заболеваний неясной этиологии, что дает ключ к разработке методов борьбы с ними. Важное значение имеет профилактика заболеваний: получение здорового посадочного материала, использование устойчивых сортов и агроприемов, которые способствуют пространственной изоляции от источников инфекции, уничтожение сорняков, использование биопрепаратов и биологических агентов, способных производить антибиотические вещества (группы тетрациклина).
Ключевые слова: фитоплазмы, фитоплазменные болезни, желтухи, ведьмина метла, stolbur, переносчики фитоплазм, таксономия фитоплазм, маркерные гены.
На 2017 год пришлось несколько юбилейных дат в области фитопатологии: 125-летие открытия вирусов Д.И. Ивановским, 110-летие со времени организации А.А. Ячевским фитопатологической лаборатории в России и 50 лет с открытия фитоплазм и вироидов, причем заболевания, вызванные обоими этими патогенами, были известны и рассматривались как вирусные задолго до обнаружения их возбудителей. Фитопатогены, получившие в 1994 году название фитоплазмы, были обнаружены в 1967 году японскими вирусологами. Это открытие могло случиться на 10 лет раньше в США, но по досадным причинам не произошло. Во флоэме растений, пораженных болезнями типа желтух (ведьмина метла, карликовость), были обнаружены не вирусы, а бактериальные полиморфные тела, напоминающие микоплазму ― возбудителя плевропневмонии крупного рогатого скота (плевропневмониеподобные организмы, pleuropneumonia like-organisms, PPLO = PLT) (1). Они также были выявлены у переносчиков болезни ― цикадок (сем. Cicadellidae), а в дальнейшем и у листоблошек (сем. Psyllidae).
В бывшем СССР задолго до открытия фитоплазм были известны такие заболевания растений, как столбур пасленовых, желтуха астровых, ведьмина метла люцерны, ведьмина метла картофеля и древесных, карликовость зерновых. Чаще всего по сходству симптомов их относили к вирусным, но иногда считали неинфекционными. После революционного открытия Д.И. Ивановским в 1892 году нового микроорганизма, вызывающего мозаичную болезнь табака, последовала череда открытий так называемых фильтрующихся вирусов ― возбудителей болезней человека и животных, однако в области фитопатологии вирусологические исследования получили продолжение только в 1920-е годы после посещения А.А. Ячевским США. Он описал ряд вирусных заболеваний картофеля (Solanum tuberosum L.), среди которых в 1926 году была и ведьмина метла (2). До 1930-х годов исследования в области вирусных заболеваний сводились к описанию вирусоподобных симптомов у растений разных видов в разных регионах и сравнению их с заболеваниями, описанными в зарубежных обзорах. В 1930-1940-х годах были организованы первые вирусологические лаборатории и получены данные по инфекционности ряда заболеваний, считавшихся вирусными, в том числе столбура пасленовых и закукливания злаков, которые были отнесены к группе желтух.
Впервые болезнь, получившую название столбур (искаженное от украинского «стовбур» — ствол), наблюдали на томатах с симптомами одревеснения плодов в конце 1920-х годов. Это слово в дальнейшем стало международным термином для обозначения фитоплазм, принадлежащих к группе 16SrXII. В 1934 году И.К. Корачевский описал характерные симптомы столбура на томатах (3). Посредством прививки томата, больного столбуром, на здоровое растение была доказана инфекционная природа заболевания (4). Болезнь не передавалась ни семенами, ни инокуляцией сока в ткани здорового растения. В то же время наблюдались случаи быстрого распространения столбура, приводящие к массовому заражению плантаций. И.К. Корачевский пытался найти переносчика болезни среди насекомых, однако испытание тлей, трипсов, клопов и некоторых видов цикадовых не дало результатов, поэтому причину стали искать в воздействии различных абиотических факторов на физиологию томатов. Это был значительный шаг назад в понимании природы столбура (5).
В 1945 году К.С. Сухов и А.М. Вовк, поняв, что экологические гипотезы причины болезни ведут по ложному пути, принялись настойчиво искать переносчика. Они определили весь видовой состав насекомых отряда Hemiptera (полужесткокрылые) подотряда Auchenorrhyncha (шеехоботные, или Cicadinea (цикадовые), которые посещали томаты. Это были насекомые из семейств Cixiidae (2 вида), Delphacidae (свинушки, 3 вида), Aphrophoridae (пенницы, 1 вид), Cicadellidae (цикадки, 11 видов). Всего было проверено 17 видов цикадовых и несколько редко встречавшихся видов (без определения видовой принадлежности). Удалось выявить только один вид-переносчик — Hyalesthes obsoletus (Sign.) из семейства Cixiidae (циксииды) (6). В последующие годы эти данные нашли подтверждение (7, 8). Открытие советских ученых стало важным шагом в объяснении эпифитотиологии (эпидемиологии) широко распространенных и вредоностных в Евразии заболеваний экономически значимых культур, вызываемых фитоплазмами группы столбура.
Впервые инфицирование картофеля предположительно столбуром было зафиксировано в Крыму в 1935 году (9). В 1940 году показано, что этой болезнью с помощью прививки можно заразить картофель (10). Первые вспышки столбура на картофеле зарегистрированы в 1943 году в Киргизии и в 1944 году в Московской области (11). С того времени термин «столбур» широко используют для описания заболеваний с характерными симптомами пожелтения и покраснения листовой пластинки и отставания в росте (12). В 1945 году от 40 до 70 % посадок картофеля в Краснодарском крае пострадали от столбура. Болезнь вызвала серьезное снижение урожайности культуры и привела к катастрофическим экономическим потерям (12). Заболевание имело серьезное экономическое влияние и в других регионах Российской Федерации, особенно в Поволжье (7), а также в союзных республиках бывшего СССР: в Крыму (4, 5, 13, 14), на Украине (15, 16), в Молдавии (17), Армении (18), Грузии (19, 20), Азербайджане (21, 22) и в Центральноазиатских республиках (23-25).
В Грузии был обнаружен новый вид переносчика столбура томатов — циксиида Hyalesthes mlokosiewiczi Sign. (сем. Cixiidae) (26). Ее личинок, нимф и имаго, отловленных на инфицированных столбуром растениях вьюнка полевого (Convolvulus arvensis L.) и пересаживали под изоляторы на здоровые томаты, где эти насекомые какое-то время питались. Через 21-23 сут после кормления появились первые симптомы инфицирования (20, 26).
Длительное время в отечественной фитопатологической литературе велась дискуссия об экологической или грибной природе столбурного увядания картофеля. Даже в настоящее время фитопатологи, впервые сталкиваясь со столбурным увяданием картофеля (Solanum tuberosum L.), перца (Capsicum annuum L.) или баклажана (Solanum melongena L.), связывают его с поражением исключительно грибами родов Fusarium, Rhizoctonia, Verticillium или Colletotrihum (27). Этот факт объясняется тем, что инфицированные фитоплазмами растения овощных и зерновых культур более подвержены поражению возбудителями корневых гнилей и сосудистого увядания, а также грибных пятнистостей листьев, например альтернариозом и кладоспориозом (28).
В 1955 году А.М. Вовк и Г.С. Никифорова предприняли первую в СССР попытку определить размеры и форму возбудителя столбура пасленовых в соке больного томата с помощью электронной микроскопии (31).
В США в штате Делавер основной причиной усыхания персиковых деревьев в 1890-1900 годах были желтухи персиков. В начале 1930-х годов L.O. Kunkel обнаружил переносчика болезни ― цикадку Macropsis trimaculata (Fitch) (32). A. Hartzell изучал экологию переносчика и при электронно-микроскопическом исследовании фиксированных срезов сосудов персика с признаками желтухи и M. trimaculata обнаружил наличие плазмоподобных тел и включений. Однако из-за их лабильности, специфической морфологии и отличия от фитовирусов идентифицировать возбудителя ему не удалось (33, 34).
Американский фитовирусолог K. Maramorosch инъецировал цикадок Macrosteles fascifrons Stal. соком растений астры, больных желтухой, а также вытяжкой из цикадки-переносчика и показал возможность размножения возбудителя заболевания и в растении, и в переносчике (35, 36). В одном из экспериментов к вытяжкам добавлялись антибиотики (пенициллин, стрептомицин и тетрациклин). Экспериментатор был уверен, что они не должны влиять на инфицирование, поскольку считалось, что инфекционный агент — вирус. Однако в случае применения тетрациклина заражения не происходило. Не найдя объяснения этому факту, автор списал его на действие высоких температур в теплице. Эксперимент повторен не был.
В 1966 году K. Maramorosch посетил лабораторию известного вирусолога и иммунолога W. Henle в Филадельфии. Он привез с собой электронно-микроскопические фотографии слюнных желез цикадок. Работавший в том же институте специалист по электронной микроскопии Т. Hummeler, посмотрев эти фотографии, обратил внимание автора снимков на наличие на них структур, сходных с микоплазмами. Однако K. Maramorosch не придал этому значения, поскольку не был знаком с работой по успешному культивированию Mycoplasma pneumonia, не знал, что означает слово «микоплазма» и даже не поинтересовался этим (37, 38).
В 1967 году, во время ежегодного совещания Японского общества фитопатологов E. Shikata — бывший сотрудник K. Maramorosch из Университета Хоккайдо — изучил тезисы статьи Y. Doi с соавт., в которой говорилось о микоплазмоподобных организмах (МПО), обнаруженных в шелковице (род Morus) с симптомами карликовости. E. Shikata заподозрил, что подобные микроорганизмы были на электронно-микроскопических фотографиях патогена желтухи астр, сделанных им в 1954 году, когда он работал в лаборатории K. Maramorosch, и попросил прислать ему пластинки. Негативы были найдены, но ввиду отсутствия на них вирусов не отправлены по запросу (37).
Ключевую роль в распознании фитоплазм сыграл ветеринар из Токийского университета K. Koshimizu. Изучив в 1967 году электронные микрофотографии, сделанные Y. Doi, он обнаружил сходство видимых на них структур с микоплазмами и предложил испытать на деревьях действие тетрациклина. Y. Doi не оставил эту информацию без внимания. С подачи Y. Doi его руководитель H. Asuyama поручил другому своему сотруднику T. Ishii провести эксперимент по оздоровлению больных саженцев шелковицы тетрациклином, что и было сделано с положительным результатом. В итоге на ежегодном совещании в г. Саппоро (Япония) были представлены три доклада, которые и ознаменовали открытие МПО, позднее получивших название «фитоплазмы», у растений (39-41).
В мае 1968 года во Франции появилась первая работа J. Giannotti с соавт. по определению МПО в лесной яблоне с признаками пролиферации (42). Исследователи не делали ссылок на публикации японских ученых, представляя свою работу как пионерскую. Позже J. Giannotti опубликовал данные по культивированию МПО на искусственных питательных средах. Однако другим ученым, в частности J. Bové и R. Davis, не удалось повторить культивирование МПО. Попытка культивировать фитоплазмы в лаборатории K. Maramorosch также не имела успеха из-за образования псевдоколоний, формируемых при избытке лошадиной сыворотки (43). Несколько неудачных попыток, предпринятых в разных лабораториях, привели к принятию международным комитетом микоплазмологов постулата о невозможности культивирования микоплазм на искусственных питательных средах. Однако позднее K. Maramorosch выразил надежду, что сотрудничество фитоплазмологов с другими микробиологами в конечном итоге приведет к возможности культивирования этих прихотливых микроорганизмов (37).
После открытия фитоплазм во всем мире начался активные электронно-микроскопические исследования возбудителей желтух растений и их тетрациклиновой терапии. Число работ, посвященных растительным микоплазмам, стало прогрессивно возрастать: в 1967 году вышли 4 работы, в 1968 ― 29, в 1969 ― 61, в 1970 ― 90, и к 1974 году число обнаруженных фитоплазмозов растений достигло 50. В СССР изучение микоплазмоподобных болезней проводились в Институте микробиологии АН СССР, в украинском Институте микробиологии и вирусологии им. Д.К. Заболотного, во Всесоюзном НИИ защиты растений (ВИЗР), где лабораторию вирусных и микоплазменных болезней возглавлял ученик К.С. Сухова — профессор Ю.И. Власов, и в некоторых других научных учреждениях.
Целью исследований, проводимых в ВИЗР, было изучение закономерностей распространения фитоплазмозов в биоценозах и разработка методов борьбы с ними. Классическая схема циркуляции возбудителя столбура в природе была описана еще К.С. Суховым и А.М. Вовк (1949) в Краснодарском крае. Они же отмечали природноочаговый характер болезни. В дальнейшем в эту схему вносились коррективы и дополнения, в основном касающиеся видового состава переносчиков и резерваторов инфекции (44, 45). Было показано, что, кроме циксииды Hyalesthes obsoletus, болезнь распространяют Phylaenus spumarius L. (сем. Aphrophoridaе — пенницы), Aphrodes bicinctus Schrank и Cicadella viridis L. (сем. Cicadellidae — цикадовые), а также циксиида Pentastiridius leporinus L. (46). Цикадки получают инфекцию при питании на зараженных многолетних растениях ― вьюнке полевом Convolvulus arvensis L., гебелии лисохвостой Goebelia alopecuroides (L.) Bunge, бодяке полевом Cirsium arvense (L.) Scop. и др. Миграция цикадок с сорных и дикорастущих растений на сельскохозяйственные культуры происходит, когда условия питания насекомых в природном очаге становятся неблагоприятными, например при усыхании дикорастущих растений в сухую жаркую погоду.
В 1970-1990-х годах в Астраханской, Волгоградской областях, на Северном Кавказе, а также в Армении и Узбекистане распространенность столбура на томатах в некоторые сезоны достигала 50-60 %. Кроме того, были распространены ведьмина метла на картофеле (Solanum tuberosum L.) и люцерне (Medicágo satíva L.) и филлодия на клеверах (Trifolium L.). Ведьмина метла люцерны часто встречалась в Казахстане, Киргизии, Узбекистане и Поволжье. В результате исследований этих болезней, выполненных сотрудниками ВИЗР, республиканских институтов защиты растений и других организаций, был расширен список переносчиков и резерваторов инфекции, изучены свойства возбудителя, обоснованы меры профилактики и борьбы с болезнями с учетом их природноочагового характера, изданы методические указания с практическими рекомендациями (47, 48).
В 1970-1980-х годах лаборатория вирусных и микоплазменных болезней ВИЗР вела активное сотрудничество со многими институтами в СССР и других странах. В совместных работах участвовали специалисты из Армении, Грузии, Украины. Плодотворным было сотрудничество со специалистом из Institut national de la recherche agronomique (INRА, Париж, Франция) доктором J. Giannotti в 1981-1985 годах. Французских ученых заинтересовала богатая коллекция образцов растений, инфицированных фитоплазмами, собранная в разных регионах СССР (Астраханская, Волгоградская области, Армения, Узбекистан) с томатов, картофеля, баклажанов и других культур. Электронная микроскопия показала наличие в них инфекционного агента, принадлежащего к классу Molliсutes. Французские исследователи предложили использовать искусственную питательную среду для изучения микробиологических свойств патогенов.
Мы уже указывали, что после нескольких неудачных попыток вырастить фитоплазмы на искусственных питательных средах их некультивтивируемость стали считать неопровержимым фактом. Тем не менее в 1980-е годы в ВИЗР активно занимались культивированием микроорганизмов из класса Molliсutes (рис. 1). Выделенные на средах микроорганизмы были серологически родственны Acholeplasma laidlawii и Spiroplasma citri. Теперь трудно утверждать, относились ли они к фитоплазмам, но в то время исследователи были в этом уверены, разрабатывали сложные питательные среды для их культивирования (49, 50). Это были первые работы советских ученых, посвященные возможности культивирования фитоплазм, подтвержденные в XXI веке итальянскими фитоплазмологами с использованием молекулярно-генетических методов.
Начиная с 2010 года, в Италии стали появляться работы, показавшие возможность добиться роста фитоплазм из различных 16Sr групп на специальных коммерческих средах c использованием в качестве инокулюма фрагментов побегов барвинка Catharanthus roseus (L.) G. Don. Рост колоний фитоплазмы на агаре обычно происходит в течение 2-5 сут, хотя до этого требуется относительно длительное время для инкубации в жидкой среде. При равных условиях фитоплазмы и микоплазмы образуют морфологически сходные колонии размером 0,1-0,2 мм. Однако количественные показатели не могут служить дифференциальной характеристикой, поскольку способны изменяться в широких пределах и зависят от вида, штамма микоплазмы, состава среды, температуры и времени культивирования. Методом полимеразной цепной реакции (ПЦР) было выявлено наличие ДНК фитоплазмы в культивированных микроорганизмах, использованных в качестве источника ДНК-матрицы. Идентификация с помощью анализа полиморфизма длины рестрикционных фрагментов (ПДРФ — restriction fragment length polymorphism, RFLP) и прямое секвенирование ампликонов также подтвердили, что это фитоплазма (51-53).
До 1990-х годов точное определение таксономической принадлежности патогена, вызывающего столбур или аналогичные болезни, было невозможно. В начале 1990-х годов появились молекулярные методы идентификации. На базе гена 16S рРНК были разработаны специфичные олигонуклеотидные праймеры, позволившие с помощью ПЦР амплифицировать 16S рДНК фитоплазм широкого круга растений-хозяев, инфицированных фитоплазмами (54, 55). Стало возможным определять, дифференцировать и классифицировать фитоплазмы, используя ПДРФ-анализ. Амплифицированную с помощью ПЦР 16S рДНК фитоплазмы подвергают воздействию эндонуклеаз рестрикции (каждой в отдельности), в результате чего получают фрагменты ДНК разной длины, которые затем разделяют электрофорезом в полиакриламидном геле и сравнивают с опубликованными картами рестрикции. Длина фрагментов и их число зависят от количества сайтов рестрикции для используемой эндонуклеазы в молекуле ампликона. В последнее время ампликоны чаще подвергают прямому секвенированию и дальнейшему виртуальному in silico (компьютерному) расщеплению и разделению ДНК-фрагментов. Была разработана новая система классификации фитоплазм, основанная на различиях первичной структуры ДНК, кодирующей ген 16S рРНК (54-56).
За два последующих десятилетия фитоплазмы были обнаружены у многих растений с заболеваниями неизвестной этиологии с характерными симптомами пожелтения. Развитие виртуального ПДРФ-анализа (компьютерная имитация ПДРФ) позволяет проанализировать большое количество последовательностей гена 16s ррнк фитоплазм, депонированных в GenBank (https://www.ncbi.nlm.nih.gov/genbank/), и значительно облегчает возможность обновлять их список (57). В настоящее время этот список содержит около 50 групп и свыше 100 подгрупп 16S рРНК фитоплазм (16Sr) (58). Было показано, что 16Sr группы соответствуют филогенетическим кладам, установленным методом филогенетического анализа последовательности полноразмерного 16S рРНК гена, что указывает на обоснованность классификации на основе ПДРФ-анализа (рис. 2).
С 2006 года (сначала в рамках российско-американского сотрудничества по проекту Международного научно-технического центра — МНТЦ, International Science and Technology Center, ISTC, Астана, Республика Казахстан, а затем российских программ) во Всероссийском НИИ фитопатологии продолжается работа по определению и идентификации фитоплазм с использованием ПЦР/ПДРФ-анализа. Осуществлен мониторинг фитоплазменных болезней, поражающих картофель в восьми экономических районах Российской Федерации: Северном, Северо-Западном, Центральном, Центрально-Черноземном, Северо-Кавказском, Уральском и Западно-Сибирском. За 7 лет исследований проверено свыше 1200 образцов с симптомами фитоплазменного инфицирования. Идентифицированы фитоплазмы, принадлежащие к пяти 16Sr группам и восьми подгруппам: 16SrI-B, 16SrI-C, 16SrI-P, 16SrII-A, 16SrIII-B, 16SrVI-A, 16SrVI-C и 16SrXII-A. Показано, что симптомы типа столбура на картофеле может вызывать как фитоплазма группы столбура (16SrXII-A), так и фитоплазмы, принадлежащие к другим группам (16SrI, 16SrIII, 16 SrVI) (60).
Мониторинг фитоплазменных болезней бобовых в четырех российских регионах (Северном, Центральном, Поволжском и Западно-Сибир-ском) показал, что большинство инфицированных растений клевера имели типичные симптомы филлодии клевера, краевого пожелтения клевера и пролиферации клевера. На растениях других родов и видов встречались эти же заболевания, но их симптомы могли существенно различаться. Инфицированная люцерна проявляла типичные симптомы ведьминой метлы. Всего на бобовых идентифицированы фитоплазмы, принадлежащие к четырем группам и шести подгруппам, причем чаще встречались фитоплазмы подгруппы краевого пожелтения клевера (16SrIII-B) и филлодии клевера (16SrI-С), реже — подгруппы столбура (16SrXII-A) и пролиферации клевера (16SrVI-A), в единичных случаях были идентифицированы фитоплазмы подгрупп 16SrI-B и 16SrIII-F (61). Кроме картофеля и бобовых, фитоплазма была выделена из культурных и дикорастущих растений более чем 30 семейств, среди которых, наряду с травянистыми, были кустарниковые и древесные. К числу наиболее редко встречавшихся групп фитоплазм относится фитоплазма группы ведьминой метлы арахиса (16SrII), выделенная из картофеля и полыни (Artemisia vulgaris L.) в 2009 году, фитоплазма группы желтух вяза (16SrV) — из вяза крупнолистного(Ulmus laevis Pall) и фитоплазма группы пролиферации яблони (16SrХ) — из груши (Pyrus com-munis L.) (62). Более 20 видов насекомых из отряда Hemiptera, собранных в Московской области, были проверены в течение нескольких лет на фитоплазмоносительство. У восьми видов цикадок и трех видов пенниц (Aphrophoridae) обнаружены фитоплазмы группы 16SrI (подгруппы 16SrI-B, 16SrI-C и 16SrI-P), 16SrIII (подгруппа 16SrIII-O), 16SrVI и 16SrXII-A. Преобладали цикадки Euscelis incisus Krs., Macrosteles laevis Rib. и Aphrodes bicinctus Schrk. (60, 61). В Поволжье выявлена носатка Dictyophara europaeaL. как носитель фитоплазмы группы 16SrIX, циксииды Hyalesthes obsoletusSign. и Pentastiridius leporinusL.как носители фитоплазмы подгруппы 16SrXII-A и Psammotettix striatusL., инфицированная фитоплазмой группы 16SrIII. Все перечисленные виды насекомых отряда Hemipteraмогут быть потенциальными переносчиками фитоплазм в Центральном регионе России и в Поволжье (62).
Способностью к переносу фитоплазм обладают только флоэмно-питающиеся виды, главным образом из подотрядов Cicadinea (пенницы, цикадки, горбатки, циксииды, носатки) и Sternorrhyncha (псиллиды). Предполагается, что специфичность связи переносчика и фитоплазмы определяется взаимодействием главного антигенного белка мембраны фитоплазм (Amp) и микрофиламентного комплекса насекомого, что определяет переход фитоплазм через стилет в кишечник, а затем в гемолимфу и слюнные железы, в которых происходит размножение фитоплазм и достижение инфекционного титра. Этот период называют латентным. Так, для большинства представителей цикадовых из семейства Cixiidae (Hyalesthes obsoletus Signoret, Pentastiridius leporinus Linnaeus, Cixius wagneri China, Reptalus panzeri Löwи др.) характерна специфическая связь с фитоплазмами группы столбура (16SrXII), а инкубационный период может составлять 20 сут.
Четырнадцать последовательностей российских изолятов фитоплазм картофеля (EU333397, EU333398, EU333400, EU344884, KP864663-KP864669, KP864672-KP864675) и 42 последовательности фитоплазм бобовых (KX773491-KX773530, KY587524 и KY587525) были депонированы в базе данных GenBank (рис. 3) (60, 61).
Рабочая группа по таксономии фитоплазм IRPCM Phytoplasma/Spiroplasma Working Team — Phytoplasma Taxonomy Group (2004) рекомендовала при наименовании новых видов использовать термин Candidatus Phytoplasma в том случае, если речь идет об уникальной последовательности гена 16S рРНК который имеет менее 97,5 % сходства с ранее описанным видом Ca. Phytoplasma. Из-за высокой консервативности 16S рДНК многие биологически и экологически разные штаммы фитоплазмы, которые могли бы рассматриваться как новые таксоны, не считаются ими с учетом указанного критерия. В этом случае для определения видовой принадлежности необходимо принимать во внимание дополнительные уникальные биологические свойства, такие как специфичность антител, круг растений-хозяев, специфичные переносчики, а также молекулярные критерии.
Для более тонкой дифференциации фитоплазм стали прибегать к анализу последовательности генов, которые менее консервативны, чем ген 16S рибосомальной РНК. Например, ПДРФ-анализгена рибосомального белка (rp-ген) позволяет дифференцировать штаммы в пределах 16Sr группы (63). Ген домашнего хозяйства Tuf, кодирующий фактор элонгации EF-Tu (elongation factor Tu), представляет собой консервативный ген, часто используемый для дифференциации и классификации фитоплазм. Однако ПДРФ-анализ его последовательности позволил различать три штамма внутри подгруппы 16SrXII-A и 5 — внутри группы 16SrI (64). Обнаружена приуроченность этих штаммов к растениям-хозяевам — крапиве двудомной Urtica dioica L., вьюнку полевому Convolvolus arvensis L. и повою заборному Calystegia sepium (L.) R. Br. (65). Сообщалось и о различной географической распространенности tuf типов фитоплазмы (66).
Другой ген домашнего хозяйства — secY, кодирующий транслокацию рибосомной субъединицы, также успешно используется в качестве маркера для выявления более тонких различий внутри групп и подгрупп фитоплазм. С его помощью можно дифференцировать генетически близкие, но экологически разные штаммы, которые не удается различить, анализируя ген 16S рРНК (67). ПДРФ-анализ амплифицированных фрагментов, содержащих последовательность groEL гена фитоплазмы, который кодирует белки теплового шока из семейства HSP60, позволил дифференцировать восемь разных штаммов, отнесенных ранее по классификации рибосомального гена к одной подгруппе 16SrI-B (68). Последовательность межгенной области 16S-23S рРНК также была использована для дифференциации фитоплазм (69, 70). Показатель генетического разнообразия фитоплазм значительно увеличивается, если проводить анализ генов vmp1 и stamp, кодирующих мембранные белки фитоплазм (71, 72).
В 2004 году у штамма OY-М фитоплазмы Candidatus Phytoplasma asteris секвенировали полный геном. Его размер составил 800 тыс. п.н. Это был минимальный набор генов, необходимый для существования облигатного внутриклеточного паразита. Как оказалось, в геноме фитоплазмы закодировано даже меньше метаболических функций, чем в геноме микоплазм. Кроме того, у изучаемой фитоплазмы не обнаружили пентозофосфатного цикла и субъединиц АТФ-синтазы, которые, как считалось, необходимы для жизни. Возможно, это стало следствием внутриклеточного паразитизма в среде, богатой питательными веществами (73). Ахолеплазмы (Acholeplasmas) и фитоплазмы отличаются от микоплазм и спироплазм тем, что триплет UGA служит у них терминирующим кодоном (стоп-кодон), тогда как у остальных прокариот, включая большинство Mollicutes, этот триплет кодирует аминокислоту триптофан.
Как и многие патогенные микроорганизмы растений, фитоплазмы производят факторы вирулентности (то есть эффекторы), которые вмешиваются в нормальные процессы жизнедеятельности хозяина, изменяя их в пользу патогена. Первым был описан белок, выделенный из лука (Allium sp.), инфицированного фитоплазмой, которая вызывала его пожелтение, — «tengusu inducer» (TENGU) (74). По флоэме он транспортируется в другие клетки, в том числе верхушечной и пазушных меристем, и вызывает образование характерных симптомов — ведьмину метлу и карликовость. На N-конце TENGU имеется сигнальный пептид из 11 аминокислот, который отщепляется in vivo в процессе протеолиза сериновой протеазой растения. Предполагается, что этот фрагмент на N-конце белка непосредственно индуцирует развитие наблюдаемых симптомов (75).
Через 2 года появилось сообщение о расшифровке генома еще одного штамма фитоплазмы Ca. Phytoplasma asteris AY-WB — возбудителя ведьминой метлы салата (Lactuca sativa L.). Если первый штамм принадлежал к подгруппе 16SrI-B, то второй — к подгруппе 16SrI-А. Это самая многочисленная подгруппа, вызывающая более 100 экономически значимых болезней (76). Было показано, что штамм AY-WB использует для воздействия на растение-хозяина по крайней мере два белковых эффектора (SAP54 и SAP11), в результате чего растение становится более пригодным для колонизации насекомыми-переносчиками. Именно от них всецело зависит распространение фитоплазм в природе (77-79).
Была сконструирована последовательность генома для четырех фитоплазм, принадлежащих к группе 16SrIII (Х-болезни), — штамма МА, вызывающего ведьмину метлу клюквы Vaccinium subgen. Oxycoccus (Hill) A. Gray, штамма JR1, вызывающего филлодию клевера (Trifolium L.) в Италии, фитоплазмы, индуцирующей ветвление пуансеттии (Euphorbia pulcherrima Willd. ex Klotzsch), и фитоплазмы желтухи молочая (Euphorbia antiquorum L.). У всех четырех штаммов, несмотря на их принадлежность к разным подгруппам группы 16SrIII, геномы оказались сходными и включали высококонсервативную часть (идентичность последовательности ДНК составила 92-98 % на 500 тыс. п.н.) и мелкие штаммоспецифичные участки. Гены, кодирующие функциональные белки, которые обеспечивали взаимодействие с растением-хозяином (мембранный транспорт, протеазы, ДНК-метилазы, эффекторы и др.), отличались друг от друга и от штаммов других видов (80).
Немецкий исследователь М. Kube сравнил четыре фитоплазмы — штаммы OY и AY-WB Candidatus Phytoplasma asteris, а также Ca. P. australiense и Ca. P. mali. Полный набор генов, необходимых для гликолиза, был обнаружен у всех фитоплазм, кроме Сa. Р. mali (81), поэтому возник вопрос об альтернативном пути получения АТФ. У фитоплазм отсутствует набор генов биосинтеза стеролов, цикла трикарбоновых кислот, фосфотрансферазы, синтеза нуклеотидов de novo и синтеза аминокислот. Это объясняет необходимость локализации патогена в ситовидных трубках, поскольку именно их сок содержит необходимые метаболиты. И хотя его состав меняется в зависимости от вида растения, в нем всегда присутствует большое количество углеводов. Несмотря на разницу в размере геномов, набор функциональных белков у всех фитоплазм одинаков (82).
В последние годы разработаны методы диагностики фитоплазмозов, продолжает совершенствоваться таксономия фитоплазм, появилась база данных, расширяющая возможности изучения предполагаемых факторов вирулентности, получено много сведений об организации геномов различных фитоплазм (83-86). Основу борьбы с фитоплазменными заболеваниями составляют методы профилактики: получение здорового посадочного материала, использование устойчивых сортов и агроприемов, определяющих устойчивость как к возбудителю, так и к его переносчикам, пространственная изоляция от источников заражения, уничтожение резерваторов инфекции и переносчиков, применение биопрепаратов и биологических агентов, способных вырабатывать антибиотические вещества группы тетрациклина.
Таким образом, за 50 лет, прошедших со времени открытия возбудителя фитоплазменных болезней, наблюдается значительный прогресс в изучении этих патогенов: кратно увеличился список растений хозяев и переносчиков заболеваний, изучены и продолжают исследоваться генетические аспекты вредоносности, появились работы, посвященные метаболизму фитоплазм, что важно для понимания взаимодействия в системе хозяин—патоген—переносчик. Изучение фитоплазменных заболеваний подтвердило их широкое распространение и катастрофическую вредоносность. Исследования, проведенные в России в последнее десятилетие, свидетельствуют о том, что фитоплазмы поражают различные культуры, что требует углубления научных работ и объединения усилий вирусологов и практических специалистов, связанных с сельским и лесным хозяйством.
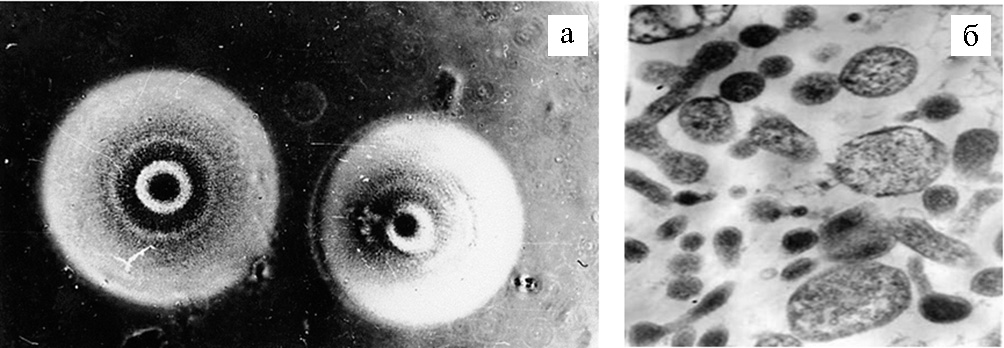
Рис. 1. Рост возбудителя столбура на искусственной питательной среде в виде колоний типа яичницы-глазуньи (×480) (а); возбудитель столбура томата на срезе под электронным микроскопом (×20000) (б). Фото Л.Н. Самсоновой (44).
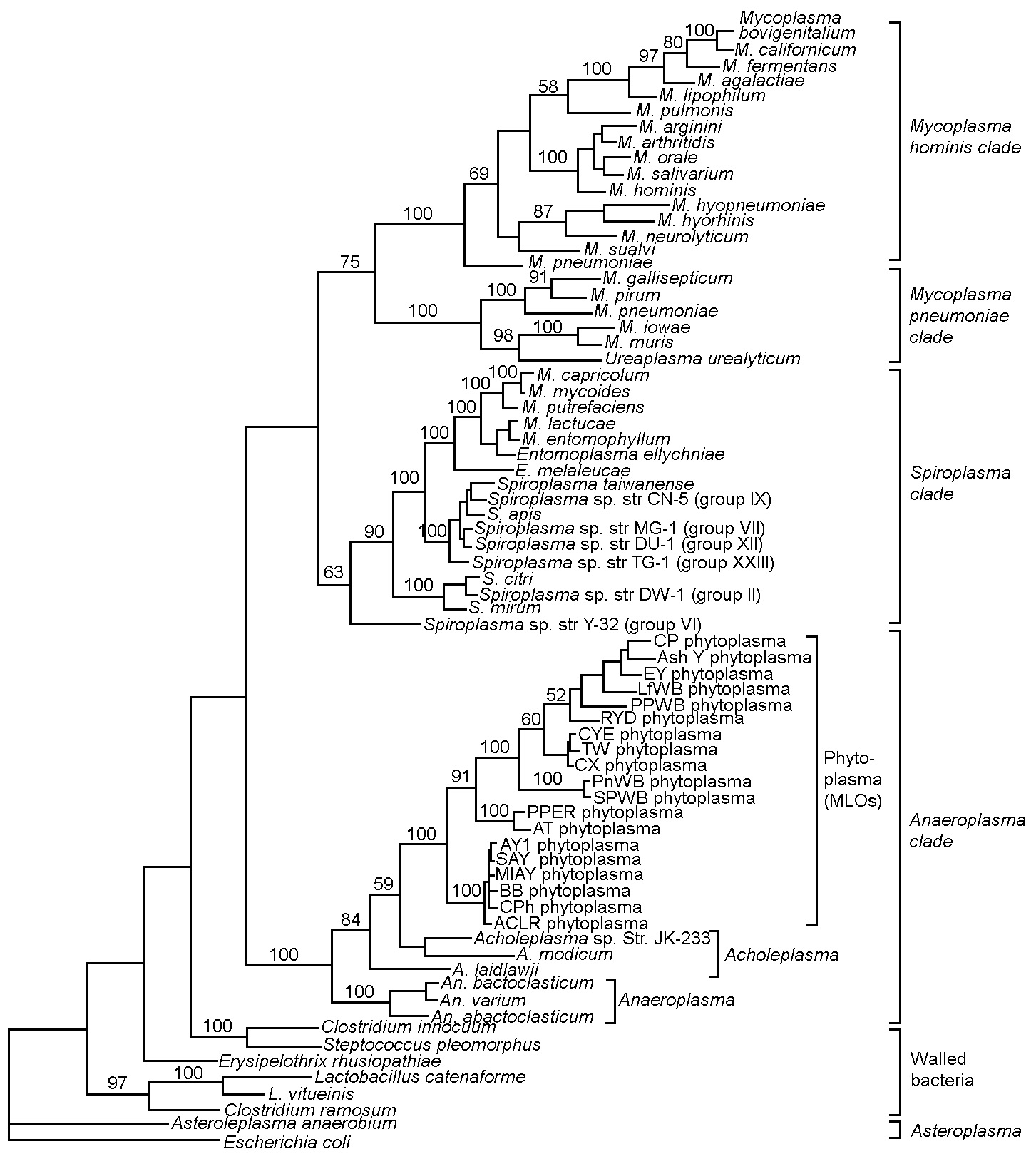
Рис. 2. Филогенетическое древо, построенное по методу максимальной экономии (parsimony analysis) на основе полной последовательности гена 16S рРНК для 46 членов класса Mollicutes и нескольких представителей бактерий, имеющих клеточную стенку. Escherichia coli использована в качестве внешней группы. Длина ветвей пропорциональна числу изменений в последовательности. Значения bootstrap-анализа для внутреннего узла указаны на ветвях дерева (59).
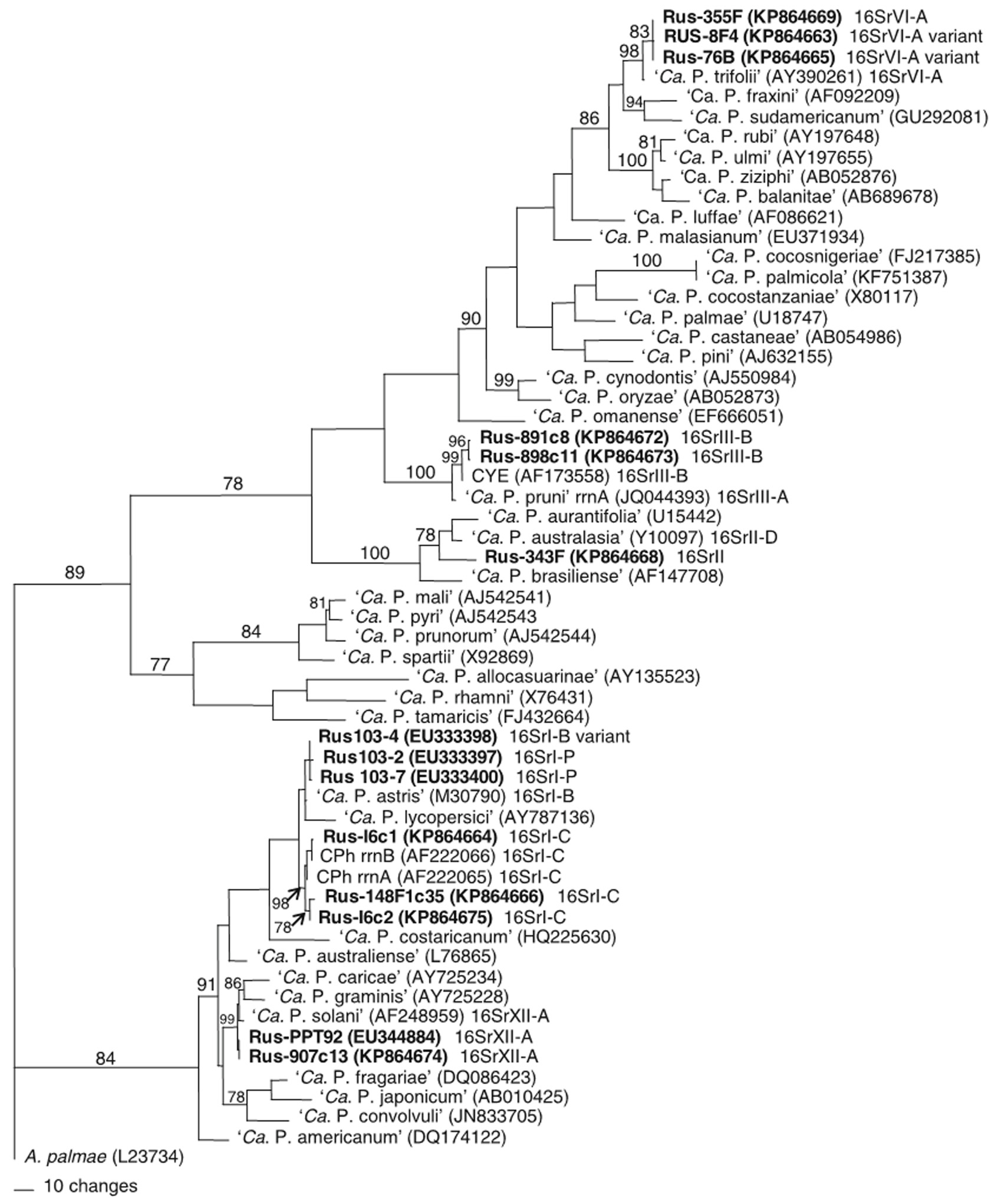
Рис. 3. Филогенетическое древо, построенное по методу максимальной экономии (parsimony analysis) на основе частичной последовательности гена 16S рРНК для российских штаммов фитоплазмы картофеля вида Candidatus Phytolasma. Acholeplasma palmae была использована в качестве внешней группы для укоренения дерева. Длина ветвей пропорциональна числу изменений в последовательности. Значения bootstrap-анализа указаны на основных ветвях дерева. В скобках приведены номера, под которыми последовательности депонированы в GenBank. Номера российских изолятов выделены жирным шрифтом (60).
ЛИТЕРАТУРА
- Edward D.G. The pleuropneumonia group of organisms: a review, together with some new observations. J. Gen. Microbiol., 1954, 10: 27-64.
- Ячевский А.А. Ведьмины метлы картофеля. Материалы по микологии и фитопатологии, 1926, 5(2): 1-12.
- Корачевский И.К. Вирусные болезни томата в Крыму. В сб.: Вирусные болезни в Крыму и на Украине /Под ред. В.Л. Рыжкова. Симферополь, 1934: 39-58.
- Рыжков В.Л., Корачевский И.К. Вирусные болезни помидоров в опытах по искусственному заражению. В сб.: Вирусные болезни в Крыму и на Украине /Под ред. В.Л. Рыжкова. Симферополь, 1934: 7-30.
- Корачевский И.К. Изыскание мер борьбы со столбуром в овощеводстве. В сб.: Вирусные болезни растений и меры борьбы с ними. М.-Л., 1941: 255-263.
- Сухов К.С., Вовк А.М. Цикадка Hyalesthes obsoletus Sign., переносчик столбура пасленовых. Доклады АН СССР, 1946, 53(2): 153-156.
- Сухов К.С., Вовк А.М. Столбур пасленовых. M.-Л., 1949.
- Развязкина Г.М. О распространении вируса столбура в природе. Микробиология, 1950, 19(3): 256-259.
- Корачевский И.К., Семенькова А.В. О пораженности пасленовых и вьюнковых вирусом столбура. В сб.: Вирусные болезни растений /Под ред. М.С. Дунина. М., 1938, сб. 2: 118-124.
- Понер В.М. О восприимчивости различных видов и сортов пасленовых к столбуру. В сб.: Вирусные болезни растений и меры борьбы с ними. М.-Л., 1941: 227-244.
- Сухов К.С., Вовк А.М. Столбур пасленовых и меры борьбы с ним. М., 1946: 31-37.
- Сухов К.С., Развязкина Г.М. Биология вирусов и вирусные болезни растений. М., 1955: 49-53.
- Корачевский И.Г. Столбурное заболевание растений. Труды ВАСХНИЛ, 1936, 5: 82-91.
- Гольдин М.И., Париевская А.П. Материалы по столбуру томатов в Крыму. Микробиология, 1950, 11(6): 405-415.
- Проценко А.Е. Вирусы столбура помидоров и желтухи астр. В сб.: Вирусные болезни сельскохозяйственных растений и меры борьбы с ними. М., 1964: 307-311.
- Milkus B., Clair D., Idir S., Habili N., Boudon-Padieu E. First detection of stolbur phytoplasms in grapevines (Vitis vinifera cv. Chardonnay) affected with grapevine yellows in the Ukraine. Plant Pathology, 2005, 54(2): 236 (doi: 10.1111/j.1365-3059.2005.01121.x).
- Сербинов Б.И. Разработка мер борьбы со столбуром томата в Молдавской ССР. В сб.: Вирусные болезни растений и меры борьбы с ними. М.-Л., 1941: 264-268.
- Хачатрян Г.А. Столбурное увядание картофеля в Армении и его передача при помощи прививок. Известия АН Армянской ССР, 1950, 3(12): 1113-1120.
- Эристави Е.М., Сакварелидзе Н.А., Титвинидзе С.С. Столбур томатов в Грузии. Труды Института защиты растений АН Грузинской ССР, 1952, 8: 111-141.
- Самуджева Э.М. К изучению биологических особенностей переносчика столбура — цикады Hyalesthes mlokosiewiczi Sign. Труды Института защиты растений АН Грузинской ССР, 1953, 9: 15-28.
- Гольдин М.И., Багдасарян А.Э. Столбур томата в Азербайджане. Защита растений, 1969, 2: 22-23.
- Balakishiyeva G., Danet J.L., Gurbanov M., Mamedov A., Kheyr-Pour A., Fossac X. First report of phytoplasma infections in several temperate fruit trees and vegetable crops in Azerbaijan. J. Plant Pathology, 2010, 92(4 Supplement): 115.
- Гольдин М.И., Юрченко М.А. Столбур томатов и другие вирусные заболевания типа желтух в районе Алма-Аты. Труды Института микробиологии и вирусологии АН Казахской ССР, 1961, 5: 139-147.
- Исамухамедов М.З. Столбур пасленовых в Узбекистане. Узбекский биологический журнал, 1969, 3: 13-15.
- Власов Ю.И. Новые данные о вирусных болезнях растений в Средней Азии. Защита растений, 1960, 1: 22-23.
- Самуджева Э.М. Некоторые данные по изучению переносчика столбура томатов в Грузии. Труды Института защиты растений АН Грузинской ССР, 1949, 6: 161-162.
- Замалиева Ф.Ф., Зайцева Т.В., Рыжих Л.Ю., Салихова З.З. Фузариозное увядание картофеля и рекомендации по защите. Защита картофеля, 2015, 2: 3-9.
- Богоутдинов Д.З. Роль сорных растений в резервации возбудителей болезней пасленовых культур. Вестник защиты растений, 2012, 1: 74-75.
- Богоутдинов Д.З. Роль цикадовых в агроценозах пасленовых культур. Защита и карантин растений, 2012, 5: 45.
- Фоминых Т.С., Богоутдинов Д.З. Диагностика вирусных, вироидных и фитоплазменных болезней овощных культур и картофеля. СПб—Пушкин, 2017.
- Вовк А.М., Никифорова Г.С. Исследования вируса столбура в электронном микроскопе. Доклады АН СССР, 1955, 102(4): 839-840.
- Kunkel L.O. Insect transmission of peach yellows. Contribution Boyce Thompson Institute, 1933, 5: 19-28.
- Hartzell A. Movement of intracellular bodies associated with peach yellows. Contribution Boyce Thompson Institute, 1937, 8(5): 375-388.
- Hartzell A. Bionomics of the plum and peach leafhopper, Macropsis trimaculata. Contribution Boyce Thompson Institute, 1937, 9: 121-136.
- Maramorosch K. Direct evidence of the multiplication of aster-yellows virus in its insect vector. Phytopathology, 1952, 42: 59-64.
- Maramorosch K. Viruses that infect and multiply in both plants and insects. Transactions New York Academy Sciences (Serie II), 1958, 20: 383-395.
- Maramorosch K. Historical reminiscences of phytoplasma discovery. Bulletin of Insectology, 2011, 64(Supplement): 5-8.
- Chanock R., Hayflick L., Barile M.F. Growth on artificial medium of an agent associated with atypical pneumonia and its identification as a PPLO. PNAS USA, 1962, 48: 41-49.
- Doi Y., Teranaka M., Yora K., Asuyama H. Mycoplasma or PLT grouplike microrganisms found in the phloem elements of plants infected with mulberry dwarf, potato witches’ broom, aster yellows or pawlownia witches’ broom. Japanese Journal of Phytopathology, 1967, 33(4), 259-266 (doi: 10.3186/jjphytopath.33.259).
- Ishiie T., Doi Y., Yora K., Asuyama H. Suppressive effects of atibiotics of tetracycline group on symptom developement of mulberry dwarf disease. Japanese Journal of Phytopathology, 1967, 33, 267-275 (doi: 10.3186/jjphytopath.33.267).
- Nasu S., Sugiura M., Wakimoto T., Iida T.T. On the etiologic agent of rice yellow dwarf disease. Annals Phytopathological Society Japan, 1967, 33: 343-344.
- Giannotti J., Marchou G., Vago C. Microorganisms de type mycoplasma dans les cellules liberiennes de Malus sylvestris L., atteinte de la maladie des proliferations. Comte Rendu Academie Science, 1968, 267: 78-77.
- Maramorosch K., Hirumi H., Plavsic-Banjac B. Artifact pseudocolonies on solid agar media inoculated with aster yellows and healthy plant material. Phytopathology, 1971, 61: 902.
- Власов Ю.И. Вирусные и микоплазменные болезни растений. М., 1992.
- Власов Ю.И. Природная очаговость вирусных и фитоплазменных (микоплазменных) болезней растений. СПб, 1999.
- Богоутдинов Д.З. Фитоплазмы картофеля и методы их изучения. Самара, 2000.
- Власов Ю.И., Якуткина Т.А., Богатыренко Т.Н., Самсонова Л.Н. Основные принципы и методы диагностики микоплазменных болезней растений (Методические указания). Л., 1977.
- Самсонова Л.Н., Цыпленков А.Е., Якуткина Т.А. Диагностика вирусных и фитоплазменных болезней овощных культур и картофеля. СПб, 2001.
- Paghosyan A., Lebsky V. Aislamiento y studio ultrastructural de tres cepas de fitoplasmas causanties de enferrmedades tipo “stolbur” en Solanaceae. Fitopatologia Colombiana, 2004, 28(1): 21-30.
- Скрипаль И.Г., Малиновская Л.А. Среда СМИМВ-72 для выделения и культивирования фитопатогенных микоплазм. Микробиологический журнал, 1983, 45(6): 64-71.
- Bertaccini A., Contaldo N., Calari A., Paltrinieri S., Windsor H.M., Windsor D. Preliminary results of axenic growth of phytoplasmas from micropropagated infected periwinkle shoots. 18th Congress of the International Organization for Mycoplasmology (IOM). Chianciano Terme, 2010: 147-153.
- Contaldo N., Bertaccini A., Paltrinieri S., Windsor H.M., Windsor D. Axenic сulture of plant pathogenic phytoplasmas. Phytopathologia Mediterranea, 2012, 51(3): 607-617.
- Contaldo N., Bertaccini A., Paltrinieri S., Windsor D., Windsor H. Cultivation of several phytoplasmas from a micropropagated plant collection. Petria, 2013, 23: 13-18.
- Lee I.-M., Hammond R.W., Davis R.E., Gundersen D.E. Universal amplification and analysis of pathogen 16S rDNA for classification and identification of mycoplasma-like organisms. Phytopathology, 1993, 83: 834-842 (doi: 10.1094/Phyto-83-834).
- Schneider B., Ahrens U., Kirkpatrick B.C., Seemüller E. Classification of plant-pathogenic mycoplasma-like organisms using restriction-site analysis of PCR-amplified 16S rDNA. J. Gen. Microbiol., 1993, 139(3): 519-527 (doi: 10.1099/00221287-139-3-519).
- Lee I.-M., Gundersen-Rindal D.E., Davis R.E., Bartoszyk I.M. Revised classification scheme of phytoplasmas based on RFLP analyses of 16S rRNA and ribosomal protein gene sequences. International Journal of Systematic and Evolutionary Microbiology, 1998, 48: 1153-1169 (doi: 10.1099/00207713-48-4-1153).
- Wei W., Davis R.E., Lee I.-M., Zhao Y. Computer-simulated RFLP analysis of 16S rRNA genes: identification of ten new phytoplasma groups. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 1855-1867 (doi: 10.1099/ijs.0.65000-0).
- PM 7/133 (1) Generic detection of phytoplasmas. OEPP/EPPO Bulletin, 2018, 48(3): 414-424 (doi: 10.1111/epp.12541).
- Gundersen D.E., Lee I.-M., Rehner S.A., Davis R.E., Kingsbury D.T. Phytogeny of mycoplasmalike organisms (phytoplasmas): a basis for their classification II. J. Bacteriology, 1994, 176(17): 5244-5254 (doi: 10.1128/jb.176.17.5244-5254.1994).
- Girsova N.V., Bottner-Parker K.D., Bogoutdinov D.Z., Meshkov Y.I., Mozhaeva K.A., Kastalyeva T.B., Lee I.-M. Diverse phytoplasmas associated with potato stolbur and other related potato diseases in Russia. Eur. J. Plant Pathol., 2016, 145: 139-153 (doi: 10.1007/s10658-015-0824-3).
- Girsova N.V., Bottner-Parker K.D., Bogoutdinov D.Z., Kastalyeva T.B., Meshkov Y.I., Mozhaeva K.A., Lee I.-M. Diverse phytoplasmas associated with leguminous crops in Russia. Eur. J. Plant Pathol., 2017, 149(3): 599-610 (doi: 10.1007/s10658-017-1209-6).
- Кастальева Т.Б., Богоутдинов Д.З., Боттнер-Паркер К.Д., Гирсова Н.В., Ли и.м. О разнообразии фитоплазмозов сельскохозяйственных культур в России: патогены и их переносчики. Сельскохозяйственная биология, 2016, 51(3): 101-109 (doi: 10.15389/agrobiology.2016.3.367rus).
- Martini M., Lee I.-M., Bottner K.D., Zhao Y., Botti S., Bertaccini A., Harrison N.A., Carraro L., Marcone C., Khan J., Osler R. Ribosomal protein gene-based filogeny for finer differentiation and classification of phytoplasmas. International Journal of Systematic and Evolutionary Microbiology, 2007, 57: 2037-2051 (doi: 10.1099/ijs.0.65013-0).
- Schneider B., Gibb K.S., Seemüller E. Sequence and RFLP analysis of the elongation factor Tu gene used in differentiation and classification of phytoplasmas. Microbiology, 1997, 143: 3381-3389 (doi: 10.1099/00221287-143-10-3381).
- Langer M., Maixner M. Molecular characterisation of grapevine yellows associated phytoplasmas of the stolburgroup based on RFLP-analysis of non-ribosomal DNA. Vitis, 2004, 43: 191-199.
- Pasquini G., Ferretti L., Gentili A., Bagnoli B., Cavalieri V., Barba M. Molecular characterization of stolbur isolates collected in grapevines, weeds and insects in central and southern Italy. Bulletin of Insectology, 2007, 60: 355-356.
- Lee I.-M., Bottner K.D., Zhao Y., Davis R.E., Harrison N.A. Phylogenetic analysis and delineation of phytoplasmas based on SecY gene sequences. International Journal of Systematic and Evolutionary Microbiology, 2010, 60: 2887-2897 (doi: 10.1099/ijs.0.019695-0).
- Mitrovič J., Contaldo N., Paltrinieri S., Mejia J.F., Mori N., Bertaccini A., Duduk B. The use of groEL gene for characterisation of aster yellows phytoplasmas in field collected samples. Bulletin of Insectology, 2011, 64(Supplement): 17-18.
- Smart C.D., Schneider B., Blomquist C.L., Guerra L.J., Harrison N.A., Ahrens U., Lorenz K.H., Seemüller E., Kirkpatrick B.C. Phytoplasma-specific PCR primers based on sequences of the 16S-23S rRNA spacer region. Appl. Environ. Microbiol., 1996, 62: 2988-2993.
- Lenz O., Markova J., Sarkisova T. Discriminating 16Sr groups of phytoplasmas by an oligonucleotide microarray targeting 16S-23S spacer region. Bulletin of Insectology, 2011, 64(Supplement): 31-32.
- Cimerman A., Pacifico D., Salar P., Marzachi C., Foissac X. Striking diversity of vmp1, a variable gene encoding a putative membrane protein of the Stolbur phytoplasma. Appl. Environ. Microbiol., 2009; 75: 2951-2957 (doi: 10.1128/AEM.02613-08).
- Fabre A., Danet J.-L., Foissac X. The stolbur phytoplasma antigenic membrane protein gene stamp is submitted to diversifying positive selection. Gene, 2011, 472: 37-41 (doi: 10.1016/j.gene.2010.10.012).
- Oshima K., Kakizawa S., Nishigawa H., Jung H.-Y., Wei W., Suzuki S., Arashida R., Nakata D., Miyata S., Ugaki M., Namba S. Reductive evolution suggested from the complete genome sequence of a plant-pathogenic phytoplasma. Nature Genetics, 2004, 36: 27-29 (doi: 10.1038/ng1277).
- Hoshi A., Oshima K., Kakizawa S., Ishii Y., Ozeki J., Hashimoto M., Komatsu K., Kagiwada S. A unique virulence factor for proliferation and dwarfism in plants identified from a phytopathogenic bacterium. PNAS USA, 2009, 106(15): 6416 -6421 (doi: 10.1073/pnas.0813038106).
- Sugawara K., Honma Y., Komatsu K., Himeno M., Oshima K., Namba S. The alteration ofplant morphology by small peptides released from the proteolytic processing of the bacterial peptide TENGU. Plant Physiol., 2013, 162(4): 2004-2015 (doi: 10.1104/pp.113.218586).
- Bai X., Zhang J., Ewing A., Miller S.A., Radek A.J., Shevchenko D.V., Tsukerman K., Walunas T., Lapidus A., Campbell J.W., Hogenhout S.A. Living with genome instability: the adaptation of phytoplasmas to diverse environments of their insect and plant hosts. J. Bacteriol., 2006, 188: 3682-3696 (doi: 10.1128/JB.188.10.3682-3696.2006).
- Sugio A., Kingdom H.N., MacLean A.M., Grieve V.M., Hogenhout S.A. Phytoplasma protein effector SAP11 enhances insect vector reproduction by manipulating plant development and defense hormone biosynthesis. PNAS USA, 2011, 108(48): 1254-1263 (doi: 10.1073/pnas.1105664108).
- MacLean A.M., Sugio A., Makarova O.V., Findlay K.C., Grieve V.M., Toth R., Nicolaisen M., Hogenhout S.A. Phytoplasma effector SAP54 induces indeterminate leaf-like flower development in Arabidopsis plants. Plant Physiol., 2011, 157(2): 831-841 (doi: 10.1104/pp.111.181586).
- Orlovskis Z., Hogenhout S.A. A bacterial parasite effector mediates insect vector attraction in host plants independently of developmental changes. Frontier Plant Science, 2016, 7: 885 (doi: 10.3389/fpls.2016.00885).
- Saccardo F., Martini M., Palmano S., Ermacora P., Scortichini M., Loi N., Firrao G. Genome drafts of four phytoplasma strains of the ribosomal group 16SrIII. Microbiology, 2012, 158(11): 2805-2814 (doi: 10.1099/mic.0.061432-0).
- Kube M., Schneider B., Kuhl H., Dandekar T., Heitmann K., Migdoll A.M., Reinhardt R., Seemuller E. The linear chromosome of the plant-pathogenic mycoplasma ‘Candidatus Phytoplasma mali’. BMC Genomics,2008, 9: 306 (doi: 10.1186/1471-2164-9-306).
- Kube M. Insights in host dependency encoded within phytoplasma genomes. Bulletin of Insectology, 2011, 64(Supplement): 9-11.
- Lee I.-M., Shao J., Bottner-Parker K.D., Gundersen-Rindal D.E., Zhao Y., Davis R.E. Draft genome sequence of “Candidatus Phytoplasma pruni” strain CX, a plant-pathogenic bacterium. Genome Announcements, 2015, 3(5): e01117-15 (doi: 10.1128/genomeA.01117-15).
- Chang S.-H., Cho S.-T., Chen C.-L., Yang J.-Y., Kuo C.-H. Draft genome sequence of a 16SrII-A subgroup phytoplasma associated with purple coneflower (Echinacea purpurea) witches’ broom disease in Taiwan. Genome Announcements, 2015, 3(6): e01398-15 (doi: 10.1128/genomeA.01398-15).
- Zamorano A., Fiore N. Draft genome sequence of 16SrIII-J phytoplasma, a plant pathogenic bacterium with a broad spectrum of hosts. Genome Announcements, 2016, 4(3): e00602-16 (doi: 10.1128/genomeA.00602-16).
- Fischer A., Santana-Cruz I., Wambua L., Olds C., Midega C., Dickinson M., Kawicha P., Khan Z., Masiga D., Jores J., Schneider B. Draft genome sequence of “Candidatus Phytoplasma oryzae” strain Mbita1, the causative agent of Napier grass stunt disease in Kenya. Genome Announcements, 2016, 4(2): e00297-16 (doi: 10.1128/genomeA.00297-16).