УДК 634.11:581.19
ДИНАМИКА ИЗМЕНЕНИЯ КИНЕТИЧЕСКИХ ХАРАКТЕРИСТИК НАДФ- ЗАВИСИМОЙ ИЗОЦИТРАТДЕГИДРОГЕНАЗЫ ПРИ СОЗРЕВАНИИ ПЛОДОВ ЯБЛОНИ
САБИНА НОВРУЗ ОМАРОВА, ЯШАР АДИЛЬ ОМАРОВ, ЗИЯДДИН МАХМУД МАМЕДОВ, АКИФ АЛЕКПЕР КУЛИЕВ
Изучали изменения активности и кинетических характеристик НАДФ-зависимой изоцитратдегидрогеназы (НАДФ-ИДГ) из субэпидермальной ткани плодов яблони при послеуборочном созревании. Выявлено, что процесс созревания плодов сопровождался повышением активности фермента на 28 %. Ионы Mn2+ и Mg2+ активировали НАДФ-ИДГ, однако сродство фермента к Mg2+ и, соответственно, степень его активации в присутствии этого катиона были выше. Фермент проявлял кинетику Михаэлиса-Ментена. Значения Км фермента из предклимактерических и климактерических плодов для НАДФ, изоцитрата и Mg2+ различались незначительно. ГТФ, АТФ и УТФ в комплексе с Mg2+ ингибировали активность НАДФ-ИДГ на обеих стадиях созревания, однако по мере созревания их ингибирующее действие ослабевало. Соответствующие нуклеотиддифосфаты активировали НАДФ-ИДГ, причем их эффект усиливался на более поздних стадиях созревания.
Ключевые слова: НАДФ-зависимая изоцитратдегидрогеназа, созревание плодов, яблоки, двухвалентные катионы, нуклеозидфосфаты.
НАДФ-зависимая изоцитратдегидрогеназа (изоцитрат:НАДФ+-ок-сидоредуктаза, КФ 1.1.1.42) (НАДФ-ИДГ) катализирует окислительное декарбоксилирование изолимонной кислоты в 2-оксоглутаровую кислоту, причем в отличие от своего НАД-зависимого аналога из цикла Кребса осуществляет как прямую, так и обратную реакцию (1). НАДФ-ИДГ изучена во многих прокариотических и эукариотических организмах. Известен субъединичный состав и кинетические свойства фермента из бактерий (2), грибов (3) и тканей млекопитающих (4). Однако число работ по исследованию свойств и механизмов регуляции НАДФ-ИДГ у высших растений невелико. Охарактеризованы лишь НАДФ-ИДГ из листьев этиолированного гороха (1) и трансгенного табака (5), семян кукурузы (6), корневых клубеньков люцерны (7), проростков огурца (8).
Функции НАДФ-ИДГ в клетках эукариотических организмов, в том числе растений, пока что полностью не установлены. Возможно, фермент действует в качестве одного из основных поставщиков НАДФН для биосинтетических реакций. Это особенно важно в условиях ограниченного функционирования пентозофосфатного пути (9, 10). НАДФ-ИДГ также снабжает клетку 2-оксоглутаратом, необходимым для процесса ассимиляции аммиака, что, вероятно, играет важную роль как в биосинтезе аминокислот, так и в обезвреживании аммиака (11). К значимой роли НАДФ-ИДГ в организме может быть отнесено и обеспечение ею клетки НАДН посредством трансгидрогеназной реакции.
Из плодовых растений ферментный препарат НАДФ-ИДГ впервые был получен у лимона (12), есть также работа, посвященная изучению этого фермента в плодах банана (13). Двумя указанными сообщениями число доступных нам исследований НАДФ-ИДГ из сочных плодов ограничивается. Имеется также несколько публикаций, посвященных выделению и изучению этого фермента у овощных культур — в частности, из плодов томата (14), проростков тыквы (15) и огурцов (8) и др. НАДФ-ИДГ яблок относится к практически неисследованным ферментам сочных плодов. По нашему мнению, изучение этого фермента может иметь большое значение в выяснении биохимических основ процессов созревания и старения.
Учитывая это, мы задались целью получить активный ферментный препарат НАДФ-ИДГ из субэпидермальной ткани плодов яблони и проследить за динамикой изменения активности, некоторых кинетических характеристик и свойств НАДФ-ИДГ при созревании плодов яблони.
Методика. Объектами исследования служили плоды яблони (Malus domestica Borkh.) сорта Ренет Симиренко предклимактерической и климактерической стадии зрелости, выращенные в садовых угодьях Губинского района Республики Азербайджан. До использования плоды хранили в холодильной камере при 4 °С и относительной влажности 80 %.
Для получения препарата НАДФ-ИДГ среднюю пробу субэпидермальной ткани массой 100 г гомогенизировали в экстрагирующей среде (1:4), состоящей из 30 мМ Трис-НCl буфера (рН 9,0), 2 мМ ЭДТА, 5мМ MgCl2, 14 мМ 2-меркаптоэтанола (МЭ), 5 % поливинилпирролидона (ПВП), 1 % полиэтиленгликоля (ПЭГ). Гомогенат фильтровали через двойной слой капроновой ткани в химический стакан, помещенный в ледяную баню. Фильтрат центрифугировали в течение 15 мин при 17 000 g.
Процедуру очистки ферментного препарата начинали с высаливания сульфатом аммония (насыщенность — 40-80 %). Осадок, полученный после высаливания, растворяли в 5 мл стандартного буфера (10 мМ фосфат калия, рН 8,2, 5 % глицерол, 14 мМ МЭ, 1 мМ MgCl2) и диализовали против 1 л стандартного буфера в течение ночи при 4 °С. Обессоленный препарат пропускали через ДЭАЭ-целлюлозную колонку (4x30 см), предварительно уравновешенную стандартным буфером. Для элюции адсорбированных белков использовался линейный градиент KCl с концентрацией от 0 до 0,4 М в стандартном буфере. Фракции с активностью НАДФ-ИДГ собирали, концентрировали сульфатом аммония и диализовали против стандартного буфера. Дальнейшую очистку ферментного препарата проводили аффинной хроматографией на колонке (2x10 см) Matrex Red Gel A («Amicon», Danvers, США), уравновешенной стандартным буфером. Затем колонку промывали 10 мл буфера, белки элюировали с использованием буфера с линейным градиентом НАДФ от 0 до 1 мМ и изоцитрата от 0 до 25 мМ. Фракции проверялись на активность НАДФ-ИДГ, активные собирали, концентрировали сульфатом аммония и диализовали, как описано выше.
Активность фермента оценивали спектрофотометрически по поглощению при l = 340 нм. Инкубационная смесь для определения активности состояла из 30 мМ Трис-HCl буфера (рН 8,2), 2,5 мМ MgCl2, 12 мкМ изоцитрата, 10 мкМ НАДФ. Контрольная кювета не содержала субстрат. Реакцию инициировали внесением ферментного препарата, измерение начинали спустя 20 мин после начала реакции (температура инкубации 20 °С). Концентрацию белка определяли по методу M.M. Bradford (16). Активность оценивали на фоне разных концентраций коферментов (катионы Mg и Mn), субстратов (изоцитрат, НАДФ+), а также нуклеозидтри- (АТФ, ГТФ и УТФ) и нуклеозиддифосфатов (АДФ, ГДФ и УДФ) в среде.
Статистическую обработку данных осуществляли по Г.Ф. Лакину (17) (погрешность не превышала 5 %).
Результаты. При выделении НАДФ-ИДГ из субэпидермальной ткани яблок получили ферментный препарат из предклимактерических и климактерических плодов, очищенный соответственно в 661 и 1108 раз, с удельной активностью около 172 и 222 нмоль НАДФНš(минšмг белка)-1 (табл. 1). Препарат использовали в дальнейшем для изучения кинетических характеристик НАДФ-ИДГ.
Созревание плодов — сложный физиологический процесс, сопровождающийся изменением активности у ряда ключевых ферментов метаболизма, в связи с чем оценили этот показатель у НАДФ-ИДГ как основного фермента обмена изоцитрата. По мере созревания плодов яблони наблюдалось некоторое увеличение ферментативной активности, достигавшей максимального значения на 30-е сут с превышением первоначального значения на 28 % (данные не приведены). Отмеченное повышение ферментативной активности НАДФ-ИДГ представляется закономерным, поскольку во всех растительных объектах, у которых изучена НАДФ-ИДГ, наблюдался подобный рост активности при переходе плодов из незрелых в более зрелые (12-14).
| 1. Характеристика препарата НАДФ-изоцитратдегидрогеназы из субэпидермальной ткани предклимактерических и климактерических плодов яблони сорта Ренет Симиренко на разных этапах очистки | |||||
Этап очистки |
Количество |
Активность |
Выход, % |
Степень очистки |
|
общая, нмоль НАДФН·мин-1 |
удельная, нмоль |
||||
П р е д к л и м а к т е р и ч е с к и е п л о д ы |
|||||
Гомогенат |
830 |
161,10 |
0,26 |
100 |
½1 |
Осаждение (NH4)2SO4 |
243 |
156,40 |
0,62 |
97,0 |
½3 |
ДЭАЭ-целлюлоза |
11 |
123,70 |
11,20 |
77,0 |
½43 |
Matrex Red Gel A |
0,25 |
43,00 |
172,00 |
26,0 |
½661 |
К л и м а к т е р и ч е с к и е п л о д ы |
|||||
Гомогенат |
1027 |
204,50 |
0,20 |
100 |
x1 |
Осаждение (NH4)2SO4 |
249 |
183,20 |
0,74 |
89,0 |
x4 |
ДЭАЭ-целлюлоза |
8 |
104,10 |
13,00 |
51,0 |
x65 |
Matrex Red Gel A |
0,30 |
66,50 |
221,70 |
32,5 |
x1108 |
|
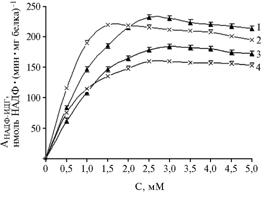
Рис. 1. Активность НАДФ-изоцитратдегидрогеназы из субэпидермальной ткани плодов яблони сорта Ренет Симиренко на разных стадиях созревания в присутствии двухвалентных катионов: 1 и 2 — соответственно Mn2+ и Mg2+, климактерические плоды, 3 и 4 — соответственно Mn2+ и Mg2+, предклимактерические плоды. |
В серии экспериментов по оценке влияния двухвалентных катионов на активность НАДФ-ИДГ из плодов яблони была продемонстрирована необходимость присутствия в среде ионов Mg или Mn. Оптимальные концентрации ионов Mg и Mn для предклимактерических плодов составили соответственно 2,5 и 3,0 мМ, для плодов на климактерической стадии — 1,5 и 2,5 мМ. Несмотря на то, что активность НАДФ-ИДГ в плодах обеих стадий зрелости в присутствии ионов Mn2+ была выше таковой при соответствующих концентрациях Mg2+, значение Км для ионов Mg2+ оказалось несколько ниже, чем для ионов Mn2+ (табл. 2). Кривые насыщения для этих катионов имели вид гиперболы (рис. 1). Полученные результаты согласуются с данными литературы о том, что фермент требует присутствия в среде двухвалентных ионов металлов (Mn2+ или Mg2+) (15). Однако важно подчеркнуть, что для большинства растительных НАДФ-ИДГ предпочтительнее наличие ионов Mn2+ (18).
При определении оптимального количества субстрата для НАДФ-ИДГ из субэпидермальной ткани яблок оказалось, что фермент из предкли-
| 2. Кинетические характеристики НАДФ-изоцитратдегидрогеназы из субэпидермальной ткани предклимактерических и климактерических плодов яблони сорта Ренет Симиренко | ||||||
Субстрат, кофактор |
Vmax, ед.·мг-1 |
Км, мкМ |
Каталитическая эффективность, |
|||
1 |
2 |
1 |
2 |
1 |
2 |
|
Изоцитрат |
185±2,5 |
227±3,2 |
3,8 |
2,9 |
48,70 |
78,30 |
П р и м е ч а н и е. Vmax и Км — соответственно максимальная скорость реакции и константа Михаэлиса, 1 и 2 — предклимактерические и климактерические плоды. |
||||||
мактерических плодов проявлял наибольшую активность при концентрации изоцитрата, равной 12 мкМ, что на несколько единиц выше оптималь-
|
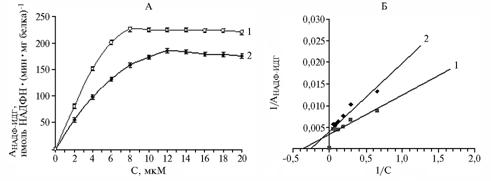
Рис. 2. Активность НАДФ-изоцитратдегидрогеназы (АНАДФ-ИДГ) из субэпидермальной ткани плодов яблони сорта Ренет Симиренко на разных стадиях созревания в зависимость от концентрации изоцитрата в среде: А и Б — соответственно прямые и обратные координаты; 1 и 2 — климактерические и предклимактерические плоды. |
ной концентрации субстрата (8 мкМ) для фермента из климактерических плодов (рис. 2). Значения Км исследуемого фермента для изоцитрата, вычисленные в вариантах с предклимактерическими и климактерическими плодами как по графику Михаэлиса-Ментена (см. рис. 2, А), так и по Лайнуиверу-Берка (см. рис. 2, Б), различались незначительно, составив соответственно 3,8 и 2,9 мкМ. При этом оптимальные концентрации кофермента для
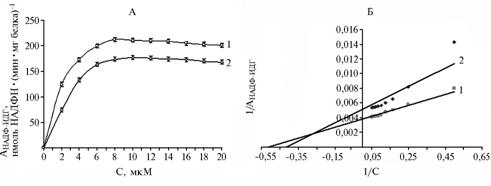 |
Рис. 3. Активность НАДФ-изоцитратдегидрогеназы (АНАДФ-ИДГ) из субэпидермальной ткани плодов яблони сорта Ренет Симиренко на разных стадиях созревания в зависимость от концентрации НАДФ+ в среде: А и Б — соответственно прямые и обратные координаты; 1 и 2 — климактерические и предклимактерические плоды. |
НАДФ-ИДГ из предклимактерических и климактерических плодов равнялись соответственно 10 и 8 мкМ, значения Км для НАДФ+ также были близки и составили 2,3 и 1,8 мкМ (рис. 3). По данным литературы, НАДФ-ИДГ из различных растительных объектов характеризуется значением Км для изоцитрата — в основном в пределах 11-80 мкМ, для НАДФ+ — 4-16 мкМ (11).
| 3. Активность НАДФ-изоцитратдегидрогеназы из субэпидермальной ткани предклимактерических и климактерических плодов яблони сорта Ренет Симиренко под влиянием различных нуклеотидов | |||||||
Mg2+, мМ |
Концентрация |
Активность, нмоль НАДФН·(мин·мг белка)-1 |
|||||
АТФ |
УТФ |
ГТФ |
АДФ |
УДФ |
ГДФ |
||
П р е д к л и м а к т е р и ч е с к и е п л о д ы |
|||||||
0,5 |
0,2 |
58±1,2 |
73±1,7 |
68±1,9 |
79±1,4 |
81±1,7 |
77±1,1 |
0,4 |
47±1,7 |
70±1,3 |
51±1,6 |
84±1,7 |
82±1,6 |
79±1,3 |
|
0,8 |
31±1,3 |
69±1,3 |
47±1,8 |
100±2,1 |
85±2,0 |
83±1,2 |
|
1,0 |
23±1,4 |
68±1,3 |
32±2,0 |
107±2,3 |
90±2,2 |
91±1,6 |
|
2,5 |
0,2 |
149±1,2 |
159±1,2 |
141±2,1 |
169±1,9 |
168±1,9 |
163±2,1 |
0,4 |
135±1,1 |
155±1,1 |
123±2,2 |
172±2,2 |
169±1,7 |
166±1,9 |
|
0,8 |
121±1,2 |
151±1,3 |
97±1,6 |
184±1,7 |
174±1,8 |
171±1,9 |
|
1,0 |
115±1,3 |
151±1,2 |
70±1,7 |
188±1,8 |
177±2,0 |
174±2,0 |
|
К л и м а к т е р и ч е с к и е п л о д ы |
|||||||
2,5 |
1,0 |
199±1,6 |
222±1,4 |
151±1,8 |
252±1,8 |
243±2,3 |
238±1,7 |
Эксперименты по оценке изменения активности НАДФ-ИДГ под влиянием различных нуклеотидов проводили с использованием двух концентраций ионов магния, одна из которых оптимальная, другая — в 5 раз ниже оптимальной. В предклимактерических плодах при оптимальной концентрации ионов Mg (2,5 мМ) АТФ и ГТФ ингибировали активность фермента соответственно на 28 и 56 % (табл. 3). Ингибирующее действие УТФ было незначительным. При низких концентрациях Mg2+ наблюдаемое подавление активности оказалось сильнее (в присутствии АТФ — на 72 %, ГТФ — на 58 % и УТФ — на 10 %). В более зрелых плодах ингибирование АТФ и ГТФ в концентрации 1 мМ при оптимальной концентрации ионов Mg2+ было относительно невелико (соответственно 12 и 33 %). Присутствие нуклеозиддифосфатов стимулировало активность фермента (в целом эффект оказался выраженнее у климактерических плодов), причем действие у ГДФ и УДФ было слабее, нежели у АДФ (табл. 3).
Итак, процесс созревания плодов у яблони сопровождается повышением активности НАДФ-изоцитратдегидрогеназы (НАДФ-ИДГ), а также незначительным увеличением сродства НАДФ-ИДГ к ионам Mg2+, субстрату и коферменту, что указывает на вовлечение фермента в метаболизм С6-органических кислот, который играет важную роль при созревании. Установлено, что НАДФ-ИДГ, выделенная из плодов яблони, обладает большим сродством к НАДФ+ и изоцитрату, чем НАДФ-ИДГ из других растительных объектов, и проявляет типичную кинетику Михаэлиса-Ментена в отношении как изоцитрата, так и НАДФ+. Фермент из субэпидермальной ткани плодов яблони может функционировать с обоими протестированными двухвалентными катионами, однако Mg2+ при этом предпочтительнее. Нуклеотидтрифосфаты ингибируют НАДФ-ИДГ (однако эффект по мере созревания ослабевает), тогда как нуклеозиддифосфаты активируют фермент (особенно на более поздних стадиях созревания, по-видимому, вследствие общего повышения активности в процессе созревания). Сравнение полученных результатов и данных литературы свидетельствует о сложности биохимических механизмов созревания и старения у сочных плодов и вовлечении в эти события различных метаболических процессов в растительной клетке, в которых участвует НАДФ-ИДГ.
Л И Т Е Р А Т У Р А
1. P o p o v a O.V., P o p o v a T.N., I z m a i l o v S.F. NAD- and NADP-isocitrate dehydrogenases and glutamate decarboxylase of peaseedlings as affected by salinity stress. Russian Journal of Plant Physiology, 1999, 46: 684-688.
2. B a i Ch., F e r n a n d e z E., Y a n g H., C h e n R. Purification and stabilization of a monomeric isocitrate dehydrogenase from Corynebacterium glutamicum. Protein Expression and Purification, 1999, 15(3): 344-348.
3. Y o o n J.J., H a t t o r i T., S h i m a d a M. Purification and characterization of NADP-linked isocitrate dehydrogenase from the copper-tolerant wood-rotting basidiomycete Fomitopsis palustris. Biosci., Biotechnol. Biochem., 2003, 67(1): 114-120.
4. H u a n g Y.Ch., C o l m a n R.F. Location of the coenzyme binding site in the porcine mitochondrial NADP-dependent isocitratedehydrogenase. J. Biol. Chem., 2005, 280(34): 30349-30353.
5. F e r r a r i o - M e r y S., H o d g e s M., H i r e l B., F o y e r C.H. Photorespiration-dependent increases in phosphoenolpyruvate carboxylase, isocitrate dehydrogenase and glutamate dehydrogenase in transformed tobacco plants deficient in ferredoxin-dependent glutamine-a-ketoglutarate aminotransferase. Planta, 2002, 214(6): 877-886.
6. G a l v e z L., G o n z a l e z E.M., A r r e s e - I g o r C. Evidence for carbon flux shortage and strong carbon/nitrogen interactions in pea nodules at early stages of water stress. J. Exp. Bot., 2005, 56(419): 2551-2561.
7. P a l m a J.M., J i m e n e z A., S a n d a l i o L.M., C o r p a s F.J.,
L u n d q v i s t M., G o m e z M., S e v i l l a F., D e l R i o L.A. Antioxidative enzymes from chloroplasts, mitochondria, and peroxisomes during leaf senescence of nodulated pea plants. J. Exp. Bot., 2006, 57(8): 1747-1758.
8. C a n i n o S., N i e r i B., P i s t e l l i L., A l p i A., D e B e l l i s L. NADP+-isocitrate dehydrogenase in germinating cucumber cotyledons: Purification and characterization of a cytosolic isoenzyme. Physiol. Plant., 1996, 98(1): 13-19.
9. G a l v e z S., G a d a l P. On the function of the NADP-dependent dehydrogenase isoenzymes in living organisms. Plant Sci., 1995, 105(1): 1-14.
10. V a l d e r r a m a R., C o r p a s F.J., C a r r e r a s A.,
G o m e z - R o d r o g u e z M.V., C h a k i M., P e d r a j a s J.R.,
F e r n a n d e z - O c a n a A., D e l R i o L.A., B a r
r o s o J.B. The dehydrogenase-mediated recycling of NADPH is a key antioxidant system against salt-induced oxidative stress in olive plants. Plant, Cell & Environment, 2006, 29(7): 1449-1459.
11. H o d g e s M. Enzyme redundancy and the importance of 2-oxoglutarate in plant ammonium assimilation. J. Exp. Bot., 2002, 53(370): 905-916.
12. S a d k a A., D a h a n E., O r E., C o h e n L. NADP(+)-isocitrate dehydrogenase gene expression and isozyme activity during citrus fruit development. Plant Sci., 2000, 158(1-2): 173-181.
13. L i u S., Y a n g Y., M u r a y a m a H., S a t o s h i T., T a d a a k i F. Changes in NADP-linked isocitrate dehydrogenase activity during postharvest ripening of banana fruit. J. Japanese Soc. for Horticultural Sci., 2003, 72(4): 352-356.
14. G a l l a r d o F., G a l v e z S., G a d a l P., C a n o v a s F.M. Changes in NADP+-linked isocitrate dehydrogenase during tomato fruit ripening. Planta, 1995, 196: 148-154.
15. N i e r i B., D e B e l l i s L., B i a g i P., A l p i A. NADP+-isocitrate dehydrogenase in germinating and senescing pumpkin cotyledons. Physiol. Plant., 1995, 94(2): 351-355.
16. B r a d f o r d M.M.A rapid sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem., 1976, 72: 248-254.
17. Л а к и н Г.Ф. Биометрия. М., 1990.
18. C h e n R., L e M a r e c h a l P., V i d a l J., J a c q u o t J., G a d a l P. Purification and comparative properties of the cytosolic isocitrate dehydrogenase (NADP) from pea (Pisum sativum) roots and green leaves. Europ. J. Biochem., 1988, 175: 565-572.
DYNAMICS VARIATIONS OF KINETIC PROPERTIES OF NADF-DEPENDENT ISOCITRATE DEHYDROGENASE DURING APPLE FRUITS RIPENING
Sabina Novruz Omarova, Yashar Adil’ Omarov, Ziyaddin Makhmud Mamedov, Akif Alekper Kuliev
The authors studied the changes in activity and kinetic properties of NADP-dependent isocitrate dehydrogenase (NADP-IDG) from subepidermal tissue of apple fruits during afterripening. It was revealed, that the increasing of enzyme activity by 28 % accompanies the fruits ripening. The ions of Mn2+ and Mg2+ activate, however, an enzyme affinity to Mg2+ and therefore the degree of its activation in the presence this cation was higher. The enzyme manifests the Michaelis-Menten kinetics. The value of Km for enzyme from preclimacteric and climacteric fruits for NADP, isocitrate and Mg2+ differ negligible. GTP, ATP and UTP in the complex with Mg2+ inhibit the activity of NADP-IDG at both stages of ripening, but in process of ripening their inhibitory action decline. The appropriate nucleotide diphosphates activate the NADP-IDG and their effect intensified on later stages of ripening.
Keywords: NADP+-isocitratedehydrogenase, fruit ripening, apples, bivalent cations, nucleoside phosphates.
Бакинский государственный университет, |
Поступила в редакцию |