УДК 635.21:581.143.6:57.086.83
ОБРАЗОВАНИЕ И МОРФОМЕТРИЧЕСКИЕ ПОКАЗАТЕЛИ МИКРОКЛУБНЕЙ КАРТОФЕЛЯ in vitro ПРИ РАЗНОМ СОСТАВЕ САХАРОВ В СРЕДЕ
А.Н. ДЕРЯБИН, Н.О. ЮРЬЕВА
На асептической культуре столонов картофеля сортов Жуковский ранний и Луговской, полученной в роллере в условиях полной темноты, изучали влияние глюкозы, сахарозы и фруктозы, добавленных в питательную среду Мурасиге-Скуга (МС-среда), на столоно- и клубнеобразование. При индуцировании клубнеобразования МС-средой с 8 % сахарозы наблюдали формирование только пазушных микроклубней (40 % находились в пазухе листа стеблевого экспланта и 60 % — в пазухе листа первого междоузлия столона). Для повышения эффективности клубнеобразования и улучшения морфометрических характеристик микроклубней предлагается МС-среду с 8 % сахарозы, которая используется для индукции клубнеобразования на 7-е сут культивирования, полностью заменять на аналогичную через 15-20 сут после индукции.
Ключевые слова: Solanum tuberosum L., микроклубни, столонообразование, клубнеобразование, сахароза, глюкоза, фруктоза.
Наиболее распространенные современные приемы получения микроклубней картофеля (клубни диаметром до 10 мм, образующиеся в условиях in vitro) предполагают использование пробирок с агаризованными (1) или колб с жидкими (стационарное культивирование и/или применение шейкера) питательными средами (2-4). Реже процедуру выполняют в биореакторах разных типов (5-8). При этом во всех сообщениях описан сходный процесс, включающий выращивание растений на свету из эксплантов (черенков с одной или несколькими почками) в течение 4-5 нед на питательной среде, содержащей 2-3 % сахарозы, индукцию клубнеобразования (в условиях темноты либо рассеянного света) внесением в среду регуляторов роста и/или повышением содержания сахарозы до 6-9 % и выращивание микроклубней до стадии созревания в течение 5-8 нед.
Известно, что у картофеля характер клубнеобразования in vitro зависит прежде всего от генотипических особенностей сорта, фотопериода, температуры и состава питательных сред (9). Переход столонов к клубнеобразованию сопровождается анатомическими, гормональными и биохимическими изменениями в субапикальной зоне. В клетках формирующихся микроклубней биохимические изменения связаны с накоплением крахмала и запасных белков. При этом изменяется активность ключевых ферментов углеводного метаболизма — инвертазы и сахарозосинтазы: у первой этот показатель очень высок в начале клубнеобразования и снижается по мере созревания микроклубней, у второй он, наоборот, пропорционально возрастает (10).
Влияние углеводного компонента питательной среды, тип, вид и содержание которого определяют начало, продолжительность образования микроклубней и скорость их роста, тщательно изучается на протяжении многих десятилетий. Так, с середины XX века проводятся работы по оптимизации состава (сахароза, глюкоза, фруктоза и др.) и количества (2-10 %) сахаров в среде для повышения эффективности клубнеобразования in vitroу различных генотипов картофеля (11-14), причем наибольшее число работ проведено с дисахаридом сахарозой. Известно, что по сравнению с моносахарами (глюкоза, фруктоза) сахароза имеет более низкое осмотическое давление при одинаковой «нагруженности» углеродом (7, 15). Автоклавирование приводит к частичному гидролизу сахарозы до глюкозы и фруктозы (6, 7, 16), увеличивая осмотический потенциал питательной среды (14). Для повышения эффективности клубнеобразования В.Н. Овчинникова (17) рекомендует добавлять в среды для индукции микроклубней, помимо сахарозы, моносахара, с целью оптимизации содержания углеводов. Другие авторы считают, что высокое осмотическое давления питательной среды, в которой присутствует смесь 4 % глюкозы + 4 % фруктозы, вызывает развитие более мелких микроклубней по сравнению с вариантом, когда в среде содержится 8 % сахарозы (7). В настоящее время общепризнано, что наличие 6-8 % сахарозы оптимально для индукции и роста микроклубней in vitro у растений картофеля (14, 18), а более высокие или низкие концентрации замедляют клубнеобразование и приводят к формированию меньшего числа и/или мелких микроклубней. Высказано предположение, что в условиях in vitro сахароза служит не только триггером клубнеобразования и источником энергии, необходимой для роста растений и микроклубней, но и оптимальным осмотическим компонентом питательной среды (9).
Известно, что in vivoклубнеобразование у каждого растения картофеля (и даже столона) характеризуется определенной иерархией и обусловлено не только генотипом, но и факторами окружающей среды (19). Индукция клубнеобразования in vitro показала, что число микроклубней положительно коррелирует с числом столонов, при этом доля клубнеобразующих столонов зависит от генотипа (20). Ранее мы обнаружили (21), что процесс образования микроклубней в культуре столонов у картофеля сортов Жуковский ранний и Луговской продолжался в течение первых 3 нед после индукции и имел периодический характер. При этом динамика суточного прироста числа микроклубней у обоих сортов описывалась затухающей кривой, близкой к синусоиде, с двумя четко выраженными пиками. Установлено, что клубнеобразование у картофеля in vitro носит дискретный характер (21) и для увеличения его эффективности важно обеспечить регулярное поступление питательной среды (в первую очередь сахарозы) к микроклубням (7).
Целью нашей работы было изучение влияния углеводного компонента, а также повторной замены питательной среды на эффективность клубнеобразования и морфометрические характеристики микроклубней in vitro.
Методика. Материалом для исследования служили стеблевые экспланты с одной пазушной почкой и листом, вычлененные из средней части 4-недельных асептических растений картофеля (Solanum tuberosum L.) сортов Жуковский ранний (раннеспелый) и Луговской (среднеспелый). Оздоровленные растения были получены во Всероссийском НИИ картофельного хозяйства им. А.Г. Лорха (Московская обл.) методом культуры апикальных меристем.
Для инициации и роста столонов использовали модифицированную жидкую безгормональную питательную среду Мурасиге-Скуга (МС) (22), дополненную в зависимости от варианта опыта 2 % сахарозы, глюкозы или фруктозы. Экспланты (20 шт.) помещали в сосуды цилиндрической формы объемом 300 мл, содержащие по 6 мл среды МС. Оптимальное для роста столонов соотношение объема культурального сосуда, питательной среды и числа эксплантов подбирали ранее (23). Прототипом используемых культуральных сосудов служил биореактор роллерного типа (5). Сосуды закрепляли на роллерном аппарате (лабораторная опытная установка) перпендикулярно дискам, которые насажены на металлическую полуось, наклоненную к горизонту под углом 3°, что гарантировало равномерное перетекание жидкой питательной среды; скорость вращения дисков — 4 об/мин. Аппарат размещали в камере, где все этапы клубнеобразования (от инициации роста столонов до получения микроклубней) осуществлялись в условиях непрерывной темноты при температуре 20±1 °С. Исходя из установленного ранее оптимального срока индукции клубнеобразования (23), ее осуществляли на 7-е сут, когда более 80 % столонов имеют по два метамера (21), заменяя МС-среду на аналогичную по составу, но содержавшую 8 % соответственно сахарозы, глюкозы или фруктозы. Через 10 нед учитывали эффективность клубнеобразования как процентное отношение числа микроклубней к числу эксплантов в культуральных сосудах (24), измеряли диаметр микроклубней (мм), отмечали место их формирования (в пазухе листа или на конце столона) и определяли массу (мг) по фракциям (с диаметром < и ≥ 5 мм).
Статистическую обработку результатов проводили в программе «t-test» (MS DOS) с применением t-критерия Стьюдента (Р = 0,05).
Результаты. Для сокращения процедуры получения микроклубней из типовой схемы был исключен первый этап — выращивание растений на свету из стеблевых эксплантов. Вместо этого для индукции столонообразования стеблевые экспланты культивировали в условиях непрерывной темноты (МС-среда с 2 % сахарозы, глюкозы или фруктозы) до формирования этиолированных побегов с двумя междоузлиями, которое отмечали на 7-е сут. По морфологическим признакам эти побеги соответствовали определению столона (9), но имели диатропную ориентацию роста, что можно объяснить нарушением геотропизма за счет периодической смены положения эксплантов в пространстве при вращении дисков роллера. Во всех вариантах (с использованием различных форм углеводов) отклонений по морфологическим признакам в развитии столонов мы не наблюдали.
| Иерархия формирования микроклубней in vitro у картофеля сорта Луговской через 10 нед после индукции клубнеобразованияв зависимости от углеводного состава среды Мурасиге-Скуга (МС) | |||||
Вариант опыта |
Доля сформированных микроклубней, % |
||||
в пазухе листа |
на конце столона |
||||
исходного стеблевого экспланта |
1-го междоузлия столона |
2-го междоузлия столона |
1-го |
2-го |
|
Сахароза, 2 % (столоно- |
|
|
|
|
|
сахароза, 8 % (клубне- |
40 |
60 |
0 |
0 |
0 |
глюкоза, 8 % (клубне- |
0 |
25 |
25 |
15 |
35 |
фруктоза, 8 % (клубне- |
30 |
60 |
0 |
0 |
10 |
Фруктоза, 2 % (столоно- |
|
|
|
|
|
сахароза, 8 % (клубне- |
55 |
20 |
0 |
0 |
25 |
глюкоза, 8 % (клубне- |
5 |
40 |
10 |
10 |
35 |
фруктоза, 8 % (клубне- |
15 |
35 |
10 |
10 |
30 |
Глюкоза, 2 % (столоно- |
|
|
|
|
|
сахароза, 8 % (клубне- |
50 |
20 |
5 |
5 |
20 |
глюкоза, 8 % (клубне- |
20 |
45 |
10 |
15 |
10 |
фруктоза, 8 % (клубне- |
15 |
30 |
15 |
10 |
30 |
П р и м е ч а н и е. Представлены данные по 5 биологическим и 25 аналитическим повторностям. |
|||||
Следует отметить, что в период клубнеобразования развитие столонов не ингибировалось — они продолжали расти и формировать новые метамеры. На иерархию образования микроклубней на столонах влиял углеводный компонент среды (табл.). Так, независимо от углевода, использованного на этапе столонообразования, при индуцировании клубнеобразования МС-средой, содержащей 8 % сахарозы, от 40 до 55 % микроклубней формировались в пазухе листа исходного экспланта. Использование сахарозы в качестве источника углерода на этапах столоно- и клубнеобразования также приводило к появлению пазушных микроклубней (в пазухе листа экспланта и 1-го междоузлия столона — соответственно 40 и 60 %). Наличие микроклубней только в пазухах листа исходного экспланта и 1-го междоузлия позволяет считать, что выбранная продолжительность периода столонообразования (7 сут) достаточна для последующей индукции клубнеобразования. В вариантах с 8 % моносахаров (глюкоза или фруктоза) микроклубни регистрировали как в пазухе листа экспланта, так и на конце столонов 1-го и 2-го порядка независимо от углеводного компонента, использованного на этапе столонообразования. В вариантах, когда для получения культуры столонов и последующей индукции клубнеобразования применялась среда, содержащая моносахара, иерархия выявлена не была (см. табл.). В вариантах с МС-средой, содержащей 8 % сахарозы, визуально микроклубни были крупнее, чем при использовании 8 % глюкозы или 8 % фруктозы.
По данным литературы, в условиях in vitro образование микроклубней на растениях картофеля продолжается в течение 2 нед после индукции (6). Ранее мы показали, что продолжительность формирования микроклубней напрямую зависит от сроков созревания сорта: у раннеспелого (Жуковский ранний) этот период не превышал 2 нед, у среднеспелого (Луговской) — составлял не более 3 нед после индукции МС-средой с 8 % сахарозы, причем сахара, которые служат основными субстратами для образования крахмала в микроклубнях, интенсивно поглощались из MС-среды (21).
 |
|
|
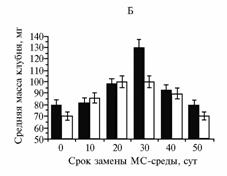
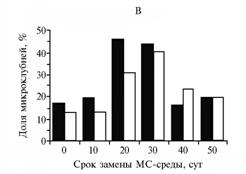
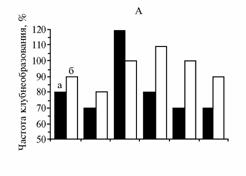
Эффективность клубнеобразования (А), средняя масса одного микроклубня (Б) и доля микроклубней с диаметром от 5 мм (В) через 10 нед в культуре столонов картофеля сортов Жуковский ранний (а) и Луговской (б) в зависимости от сроков замены среды Мурасиге-Скуга (МС) с 8 % сахарозы, использованной для индукции клубнеобразования, на аналогичную. Культивирование на аппарате роллерного типа в условиях непрерывной темноты при температуре 20±1 °С. |
Мы попытались не лимитировать углеводное питание столонов в период клубнеобразования, полностью заменяя используемую культуральную МС-среду с 8 % сахарозы на равный объем свежей на 10-е, 15-е, 20-е, 35-е или 45-е сут после индукции. Было выявлено существенное влияние этой процедуры на показатели клубнеобразования у обоих исследуемых сортов (рис.). У сорта Жуковский ранний эффективность клубнеобразования увеличилась на 50 % при замене МС-среды на 15-е сут, то есть в период активного формирования микроклубней в культуре столонов (21). У сорта Луговской наибольший рост этого показателя (более чем на 20 %) наблюдали при обновлении среды культивирования на 20-е сут, что сопровождалось увеличением (почти на 40 %) доли микроклубней с диаметром ³ 5 мм. Замена питательной среды на 15-20-е сут после индукции клубнеобразования способствовала увеличению средней массы микроклубней на 60 % у обоих сортов. Важно отметить, что при этом полученные микроклубни не имели морфологических отклонений. У обоих сортов замена МС-среды в более ранние (на 10-е сут) или поздние (на 35-е или 45-е сут) сроки практически не влияла на морфометрические показатели микроклубней. Однако у 5-10 % микроклубней наблюдали вторичное клубнеобразование, то есть процесс израстания. Таким образом, для повышения эффективности клубнеобразования и получения большего числа зрелых микроклубней необходимо, чтобы углеводный компонент (сахароза) в среде культивирования не был лимитирован. Поэтому следует проводить ее полное обновление в оптимальные сроки (для раннеспелого сорта Жуковский ранний — на 15-е, для среднеспелого сорта Луговской — на 20-е сут после индукции клубнеобразования).
Наши данные согласуются с результатами, полученными W.-C. Yu с соавт. (7) при массовом размножении микроклубней картофеля в биореакторе. Они показали, что концу 2-й нед после индукции клубнеобразования концентрация сахарозы в питательной среде снижалась почти до 0 %, глюкозы и фруктозы — была более 4 %. Авторы предположили, что из растворимых сахаров именно сахароза, представляющая собой дисахарид, предпочтительна для клубнеобразования. Видимо, сахароза служит не только оптимальным источником углерода для растений картофеля in vitro, но и обеспечивает (при концентрации 8 %) оптимальный осмотический потенциал для развития микроклубней (14). Известно также, что при культивировании растительных клеток, тканей и органов in vitro в жидкой питательной среде важным фактором изменения ее углеводного состава (наряду с автоклавированием, приводящим, как уже отмечалось, к частичному гидролизу сахарозы) выступает активность кислой нерастворимой (апопластной) инвертазы (7, 25). Поскольку культура столонов постоянно контактирует с питательной средой, есть основания полагать, что апопластная инвертаза активно участвует в гидролизе сахарозы до глюкозы и фруктозы, вследствие чего концентрация этого дисахарида в МС-среде снижается. Подобное обстоятельство необходимо учитывать при разработке схемы получения микроклубней картофеля на жидких питательных средах при аппаратном режиме культивирования.
Итак, исключение стадии «взрослого» пробирочного растения из общепринятой схемы получения оздоровленных микроклубней картофеля и индуцирование клубнеобразования средой Мурасиге-Скуга (МС) с 8 % сахарозы на 7-суточной культуре столонов, полученной в условиях непрерывной темноты на МС-среде с 2 % сахарозой, позволяет сократить время образования микроклубней на 3-4 нед. При такой схеме более 60 % микроклубней формируются на первых двух метамерах столонов. В качестве приема, позволяющего обеспечить культуру столонов достаточным количеством сахарозы и увеличить эффективность клубнеобразования, нами предложена полная замена питательной среды на аналогичную (МС-среда, содержащая 8 % сахарозы) на 15-20-е сут (в зависимости от сорта) после индукции клубнеобразования.
Л и т е р а т у р а
1. М е л и к - С а р к и с о в О.С., О в ч и н н и к о в а В.Н., У л ь я н о в Р.П. Получение безвирусного посадочного материала картофеля микроклубнями, индуцированными в культуре in vitro: Метод. реком. М., 1985.
2. T o v a r P., E s t r a d a R., S c h i l d e - R e n t s c h l e r L.,
D o d d s J.H. Induction and use of in vitro potato tuber. Circular International potato center (CIP), 1985, 13(4): 1-5.
3. E s t r a d a R., T o v a r P., D o d d s J.H. Induction of in vitro tubers in a broad range of potato genotypes. Plant Cell Tissue and Organ Cult., 1986, 7(1): 3-10.
4. M u m t a z N., Q u r a i s h i A. A study of two different methods for induction of in vitro tuberization in Solanum tuberosum L. Pak. J. Sc. Ind. Res., 1990, 33(1-2): 49-51.
5. M c C o w n B.H., J o y c e P.J. Automated propagation of microtubers of potato. In: Scale-up and automation in plant propagation /I.K. Vasil (ed.). San Diego, 1991: 95-110.
6. A k i t a M., T a k a y a m a S. Induction and development of potato-tubers in a jar fermenter. Plant Cell Tissue and Organ Cult., 1994, 36(2): 177-182.
7. Y u W.-C., J o y c e P.J., C a m e r o n D.C., M c C o w n B.H. Sucrose utilization during potato microtuber growth in bioreactors. Plant Cell Reports, 2000, 19: 407-413.
8. P a e k K.Y., C h a k r a b a r t y D., H a h n E.J. Application of bioreactor systems for large scale production of horticultural and medicinal plants. Plant Cell, Tissue and Organ Cult., 2005, 81(3): 287-300.
9. E w i n g E.E., S t r u i k P.C. Tuber formation in potato: induction, initiation and growth. In: Horticultural Reviews /J. Janick (ed.). N.Y., John Wiley & Sons, 1992, Vol. 14: 89-198.
10. H a j i r e z a e i M.R., T a k a h a t a Y., T r e t h e w e y R.N.,
W i l l m i t z e r L., S o n
n e w a l d U. Impact of elevated cytosolic and apoplastic invertase activity on carbon metabolism during potato tuber development. J. Exp. Bot., 2000, 51: 439-445.
11. B a r k e r W.G. A method for the in vitro culturing of potato tuber. Science, 1953, 118: 384.
12. G a r n e r N., B l a k e J. The induction and development of potato microtubers in vitro on media free of growth-regulating substances. Ann. Bot., 1989, 63(6): 663-674.
13. L e v y D., S e a b r o o k J.E.A., C o l e m a n S. Enhancement of tuberization of axillary shoot buds of potato (Solanum tuberosum L.) cultivars cultured in vitro. J. Exp. Bot., 1993, 44: 381-386.
14. K h u r i S., M o o r b y J. Investigations into the role of sucrose in potato cv. Estima microtuber productionin vitro. Ann. Bot., 1995, 75(3): 295-303.
15. Х о л о д о в а В.П. Рост и метаболизм углеводов в культуре ткани растений. В кн.: Культура клеток растений. М., 1981.
16. Т р о ф и м е ц Л.Н., Б о й к о В.В., З е й р у к Т.В., О с т а п е н к о Д.П. Биотехнологические методы получения и оценки оздоровленного картофеля (рекомендации). М., 1988.
17. О в ч и н н и к о в а В.Н. Влияние гормональных и углеводных компонентов культуральной среды на формообразовательные процессы в культуре картофеля in vitro. Автореф. канд. дис. М., 1992.
19. Ч а й л а х я н М.Х. Механизмы клубнеобразования у растений. В сб.: Регуляторы роста и развития картофеля. М., 1990.
20. S t r u i k P.C., V r e u g d e n h i l D., H a v e r k o r t A.J., B u s C.B., D a n k e r t R. Possible mechanisms of size hierarchy among tubers on one stem of a potato (Solanum tuberosum L.) plant. Potato Res., 1991, 34(3): 187-203.
21. Д е р я б и н А.Н., Ю р ь е в а Н.О. Периодичность этапов клубнеобразования у картофеля in vitro. Докл. РАСХН, 2001, 3: 6-8.
22. Х р о м о в а Л.М., Р а с с а д и н а Г.В., Ю р ь е в а Н.О.,
К и р с а н о в а С.Н. Методические указания по использованию биотических и абиотических стрессовых факторов для расширения сомаклональной вариабельности у картофеля и получения хозяйственно ценных фоpм. М., 1995.
23. Д е р я б и н А.Н., О р е ш н и к о в А.В., Ю р ь е в а Н.О.,
Б у т е н к о Р.Г. Рост столонов и индукция микроклубней картофеля in vitro при разных типах культивирования. ДАН, 1997, 355(6): 841-843.
24. L e n t i n i Z., E a r l e E.D. In vitro tuberization of potato clones from different maturity groups. Plant Cell Rep., 1991, 9(12): 691-695.
25. D a i e A., C h i n C.K., P i t c h e r L. Differential rates of sucrose and hexose transport by Asparagus cell cultures. Plant Sci., 1987, 53: 101-107.
A.N. Deryabin, N.O. Yur’eva
On aseptic culture of potato stolons of the Zhukovskii early and Lugovskoi varieties, isolated in roller in absolute darkness, the authors studied the effect of glucose, sucrose and fructose, supplemented to nutrient medium of Murashige-Skoog (MS-medium), on formation of stolons and tubers. The appearance of only axillary microtubers (40 % — in leaf axil of stem explants and 60 % — in leaf axil of first internode of stolon) the authors observed at the induction of tuber formation by MS-medium with 8 % of sucrose. For the raising of efficiency of tuber formation and the improvement of morphometric indices of microtubers the authors suggest MS-medium with 8 % sucrose, which induces the tuber formation at 7 day of cultivation, replace entirely on analogous in 15-20 days after induction.
Keywords: Solanum tuberosum L., microtubers, stolon development, tuberization, sucrose, glucose, fructose.
Учреждение Российской академии наук |
Поступила в редакцию |