УДК 633.16:57.086.83
СРАВНИТЕЛЬНАЯ ОЦЕНКА КАЛЛУСОГЕНЕЗА И РЕГЕНЕРАЦИИ У РАЗЛИЧНЫХ ВИДОВ ЯЧМЕНЯ
В.Е. ЧЕРНОВ, Г.И. ПЕНДИНЕН
Изучали особенности каллусогенеза и регенерации (число, масса, морфологические признаки и эффективность образования каллусов, морфологические признаки регенерантов и эффективность регенерации) у представителей видов различных секций рода Hordeum L. Для индукции каллусогенеза использовали три типа эксплантов (молодые соцветия, незрелые зародыши, зрелые зерновки), а также три различных по минеральному составу питательных среды (N6, B5L, Mурасиге-Скуга). Установлено, что формирование каллусной ткани у видов секции Hordeum отличалось от такового у видов других секций (Anisolepis, Critesion, Stenostachys). Тип каллусов не зависел от состава среды и используемого экспланта. Регенерацию растений из каллусов наблюдали не у всех изученных видов. Для видов, относящихся к секции Hordeum, был характерен единичный тип регенерации, для видов секций Anisolepis, Critesion, Stenostachys — множественный. Тип регенерации не зависел от выбора экспланта (молодые соцветия, незрелые зародыши или зрелые зерновки).
Ключевые слова: каллусогенез, регенерация, эксплант, культура in vitro, род Hordeum, ячмень дикорастущий.
Виды ячменя (род Hordeum L.) широко распространены в природе и произрастают в разнообразных климатических условиях, в связи с чем должны обладать неодинаковыми физиологическими характеристиками (1, 2). Однако до сих пор представителей этого рода в основном можно отнести к малоизученным объектам, причем меньше всего информации о физиологических функциях большинства дикорастущих форм, в частности об особенностях их культивирования in vitro. Культурный ячмень H. vulgare часто используется в экспериментах по культуре тканей и органов, для него разработаны системы культивирования, изучена специфика регенерации (3-6). Дикорастущие образцы включаются в подобные эксперименты очень ограниченно, незначительно и число изученных видов (7-12), однако как близкие сородичи культурного ячменя они могут служить источниками полезных признаков для интрогрессии в геном H. vulgare (13). Знание биологических особенностей культивирования тканей и органов дикорастущих видов ячменя представляется крайне актуальной задачей, поскольку использование их генофонда в селекционных целях возможно только с применением методов invitro.
Наиболее распространенные экспланты для получения эмбриогенной каллусной культуры ячменя — незрелые зародыши (14). Для микроклонального размножения отдельных уникальных растений, таких как стерильные межвидовые гибриды злаков, обычно используют соматические ткани молодых соцветий (15-17), для микроклонирования и получения пассируемой in vitro соматической ткани растений ячменя — также апикальные меристемы конусов нарастания побегов (18). Применение зрелых зародышей ячменя в качестве эксплантов позволяет получать первичный каллус без сезонных ограничений (19). При исследовании каллусогенеза и регенерации обычно выбирается тот тип экспланта, который наиболее удобен для проведения экспериментов и обеспечивает эффективное получение достоверных результатов. В то же время сравнительное изучение указанных процессов у одних и тех же генотипов с использованием разных эксплантов не проводилось.
Целью нашей работы было определение фенотипических особенностей каллусогенеза и регенерации у различных видов рода Hordeum L., оценка регенерационного потенциала видов и сравнение особенностей культивирования in vitro при использовании различных эксплантов.
Методика. В исследовании использовали виды ячменя различных секций рода Hordeum, сохраняемые в лаборатории биотехнологии Всероссийского НИИ растениеводства им. Н.И. Вавилова (ВИР). Секция Hordeum была представлена видами H. vulgare L. (2x: сорта Полярный 14, Ранний 1, Betzes, Roland — из коллекции ВИР), H. vulgaressp. spontaneum(C. Koch) Thell. (2x: W 31 и W 485 — из коллекции ВИР, И 0118914 — из отдела интродукции ВИР), H. vulgare ssp. agreochrithon (Äberg) Bowd (2x: И 0118914 — из отдела интродукции ВИР), H. bulbosum L. (2x: W 510 — из коллекции ВИР; 4x: W 4, W 121 р1, W 121 р2, W 121 р3 — из коллекции ВИР), H. murinum L. (2½: W 20 — из коллекции ВИР; 4x: И 0118916, И 0118919 — из отдела интродукции ВИР, Г 1 — экспедиционный сбор в районе г. Геленджик; 6x: W 277, W 278 — из коллекции ВИР, И 491045 — из отдела интродукции ВИР). Набор образцов секции Anisolepis включал только диплоидные (2x) виды: H. pusillum Nutt. (И 491050), H. intercedens Nevski (H 1940, the Swedish University of Agricultural Sciencis — SUAS, Svalov), H. lexuosum Steud. (H 1110, H 1112, H 1116, SUAS, Svalov), H. muticum Pres. (H 958, H 1784, SUAS, Svalov), H. cordobense Bothmeret al. (H1702, SUAS, Svalov). По секции Critesion в число изучаемых вошли виды H. jubatumL. (4x: К 1 — сбор на территории Красноярского края, Ш 2 и Ш 5 — сбор на территории поселка Шортанды, Казахстан, Я 1 — сбор на территории Якутии), H. procerum Nevski (6x: W 356 — из коллекции ВИР, И 491049 — из отдела интродукции ВИР), H. lechlery (Steud) Schenck (6x: H 1496, SUAS, Svalov). В секции Stenostachys изучали виды H. marinumHuds. (2½: H 299, SUAS, Svalov; 4x: И 0118920 — из отдела интродукции ВИР, W 493 — из коллекции ВИР), H. depressum(Scribn. & Sm.) Rybd. (4x: И-538814 — из отдела интродукции ВИР, W 309 — из коллекции ВИР), H.brachyantherumssp. californicum (Covas&Stebbins) Bothmer et al. (2x: H 559970 — из отдела интродукции ВИР), H. parodii Covas (6x: H 1269, SUAS, Svalov), H. patagonicum (Haumann) Covas (2x: H 1468, SUAS, Svalov).
Каллусную ткань получали из трех типов эксплантов — молодых соцветий (сегментов развивающегося колоса, не достигших стадии мейоза), незрелых зародышей (через 14-16 сут после опыления) и зрелых зерновок (через 6 мес после полного созревания, нормально сформированы в естественных условиях). Использовали различные режимы стерилизации. Побеги с молодыми соцветиями стерилизовали в 70 % растворе этанола в течение 5 мин. Зерновки перед вычленением незрелых зародышей последовательно стерилизовали в 70 % этаноле в течение 4 мин, затем в 10 % растворе перекиси водорода в течение 15 мин и трижды промывали стерильной водой (по 1 мин в каждой смене). Зрелые зерновки стерилизовали таким же способом, увеличив время обработки перекисью водорода до 20 мин. Перед стерилизацией зерновок покровные чешуи удаляли. Зрелые простерилизованные зерновки эксплантировали на питательную среду бороздкой вверх без вычленения зародыша.
В зависимости от задачи эксперимента экспланты всех типов высаживали в культуральные сосуды на среды для каллусообразования с разным минеральным составом: B5L (20), N6 (21), Мурасиге-Скуга (МС) (22). В качестве гормона ауксинового типа использовали только 2,4-дихлорфенокси-уксусную кислоту (2,4-Д), ее концентрация во всех средах для индукции и роста каллусов была постоянной и составляла 2 мг/л. Для органогенеза применяли только среду N6, содержащую кинетин в концентрации 1 мг/л.
Для индукции каллусогенеза эксплантированные зародыши и зрелые зерновки культивировали в термостате в темноте при 27 °С. После пассирования каллусов на среду для регенерации культуральные сосуды помещали в светоустановку в условия 16-часового фотопериода при комнатной температуре. В экспериментах с молодыми соцветиями использовали светоустановку с 16-часовым фотопериодом на этапах как каллусо-, так и органогенеза.
Проводили учет показателей каллусогенеза (через 15 и 30 сут после эксплантации) и регенерации (через 30 сут после реэксплантации сформировавшихся каллусов на среду для регенерации). Каллусогенез у всех исследуемых образцов оценивали по числу образовавшихся каллусов и приросту их сырой массы к концу пассажа. Устанавливали эффективность каллусогенеза, вычисляя процент каллусов от числа высаженных эксплантов. Относительную интенсивность роста определяли сравнением с сырой биомассой после 1-го пассажа, принимая во внимание, что у экспланта величина этого показателя находится за пределами чувствительности взвешивания (весы Sartorius L 610D, Sartorius GmbH, Германия). Регистрировали внешние морфологические признаки образовавшихся каллусов. На этапе регенерации отмечали нормально сформированные растения, имеющие побеги и корневую систему. Эффективность регенерации рассчитывали как процент каллусов, дающих только нормально развитые растения, от общего числа высаженных на органогенную среду. Отмечали также морфологические признаки каллусов после развития регенерантов.
Эффективность регенерации из каллусов, полученных из различных типов эксплантов, сравнивали с использованием критерия c2 для четырехпольной таблицы 2x2 (23). Достоверность доли (%) при альтернативном разделении вариант (наличие/отсутствие каллусогенеза и регенерации) оценивали по ее ошибке (23).
Результаты. Разнообразие питательных сред, применяемых в опытах по получению культуры тканей у ячменя, заставило провести ревизию их состава для упрощения и оптимизации условий экспериментов in vitro. Для сравнения показателей каллусогенеза и регенерации у разных видов рода Hordeum были выбраны наиболее распространенные и простые по составу питательные среды: Мурасиге-Скуга (МС), N6 (среда Чу) и модификация среды Гамборга B5 — среда B5L. Эти среды, имея одинаковый качественный состав макроэлементов, различаются их концентрацией в питательном растворе и соотношением ионов NO3– и NH4+.
При изучении особенностей индукции и развития каллусов у разных видов ячменя в зависимости от минерального состава питательной среды в качестве эксплантов использовали незрелые зародыши. Выбор такого экспланта был обусловлен высокой интенсивностью пролиферации и компетентностью всех тканей зародыша при культивировании in vitro (8, 24, 25), что позволяет исключить влияние снижения пролиферативной функции клеток, характерного для специализированных тканей, на результаты экспериментов. Эксплантация незрелых зародышей у разных видов рода Hordeum выявила межвидовые различия как по эффективности индукции процесса каллусообразования, так и по интенсивности роста каллусных тканей.
Помещая на питательные среды незрелые зародыши всех образцов ячменя культурного, инициацию образования каллусной ткани с высокой частотой отмечали на 2-3-и сут после эксплантации, активный видимый рост каллусов — на 4-7-е сут. Незначительное варьирование по срокам начала индукции каллусов и образования видимой каллусной ткани наблюдали у разных сортов культурного ячменя и дикорастущих видов. Выявленные различия не зависели от минерального состава среды и скорее были видоспецифичными. Существенных колебаний по продолжительности периода индукции каллусогенеза в зависимости от состава среды не зафиксировали ни у одного из исследованных видов. Для удобства представления данные по эффективности каллусогенеза сгруппированы в соответствии с делением рода Hordeum на виды и секции, которое предложили R. Bothmer с соавт. (2). Так, при эксплантации незрелых зародышей H. vulgare каллусогенез происходил с высокой частотой, эффективность образования каллусов у разных сортов культурного ячменя была высокой — от 53,4 до 96,4 %. Внешние морфологические признаки каллусов, выросших на используемых средах, оказались в целом одинаковыми: на всех трех средах из незрелых зародышей развивались крупные, полупрозрачные, рыхлые каллусы, то есть каллусы I типа (по классификации С.S. Goldstein и W.E. Kronstadt, 1986) (25). К концу 1-го этапа культивирования in vitro часть ткани каллуса уплотнялась и утрачивала прозрачность, трансформируясь в каллус II типа (компактный) согласно той же классификации (25). Известно, что каллусы II типа в большей степени предрасположены к регенерации, поскольку уплотнение каллусной ткани связано с формированием меристематических зон de novo (25).
При эксплантации незрелых зародышей у дикорастущих подвидов H. vulgare ssp. spontaneum и ssp. agreochrithon формировались каллусы такого же типа и морфологического строения, как у культурного ячменя. Другие виды секции Hordeum — H. bulbosum (2x, 4x) и H. murinum (2x, 4x, 6x) образовывали каллусы аналогичного типа, но по размеру они были меньше, чем у культурного ячменя. У видов из этой секции в процессе роста и развития каллусов в основном сохранялась ткань I типа. Состав среды в наших экспериментах не оказывал влияния на формирование преобладающего типа каллусной ткани у видов секции Hordeum (табл. 1). В этой секции различия по эффективности каллусогенеза в зависимости от состава среды проявлялись только для вида H. vulgare и его дикорастущих подвидов, а также у H. bulbosum (как у диплоидного, так и у тетраплоидного цитотипа). Для вида H. murinum ди-, тетра- и гексаплоидного цитотипов достоверного влияния состава питательной среды на эффективность каллусогенеза не установили.
У изученных видов секции Hordeum каллусы при пересадке на органогенную среду регенерировали побеги и корни. Довольно высокой частотой практически у всех исследованных видов характеризовалась регенерация корней корончатого типа (без формирования побега). Чаще эффект развития корончатых корней в отсутствие побега наблюдали в вариантах с пассированием на органогенную среду каллусов, образовавшихся на среде B5L. Перенос каллусов со среды MС с большей вероятностью приводил к некрозу ткани, чем реэксплантация с двух других сред. У представителей секции Hordeum при пересадке каллусов на органогенную среду отмечали неодинаковую эффективность регенерации. Отсутствие регенерации побегов наблюдали у диплоидных цитотипов видов H. bulbosum и H. murinum. Побеги формировались только у каллусов, полученных из незрелых зародышей тетраплоидных и гексаплоидных цитотипов H. murinum, которые были пересажены на органогенную среду N6 с каллусогенных сред B5L и N6. Эффективность регенерации при этом варьировала от 3,8-10,0 % у тетраплоидного цитотипа до 10,6-63,0 % у гексаплоидного.
Оценка процессов каллусогенеза и регенерации для видов секции Anisolepisпроводилась на H. flexuosum и H. pusillum, незрелые зародыши которых помещали на каллусогенные среды B5L, N6 и MС. На всех трех средах после эксплантации зародышей довольно быстро формировались каллусы II типа. Наблюдаемая эффективность каллусогенеза составляла 44,4-84,3 % для H. flexuosum и 42,5-56,4 % для H. pusillum, максимальный показатель отмечали на калусогенной среде N6. Регенерацию побегов регистрировали только у вида H. flexuosum при пересадке на органогенную среду N6 с каллусогенных сред B5L и N6.
| 1. Характеристика каллусогенеза и регенерации in vitro у растений разных видов Hordeumв зависимости от состава питательной среды | |||||
Вид (сорт, образец) |
Каллусогенез |
Регенерация |
|||
среда |
тип |
эффективность, % |
эффективность, % |
тип |
|
H. vulgare (2x, Rolan, Betzes, Полярный 14) |
B5L |
I |
81,2±3,07 |
54,3±12,95 |
Единичная |
H. spontaneum (2x, W 31, |
B5L |
I |
88,8±2,94 |
40,1±6,30 |
Единичная |
H. bulbosum (2x, W 510) |
B5L |
I |
33,3±12,20 |
0 |
|
H. bulbosum (4x, W 4, W 121) |
B5L |
I |
66,7±10,28 |
10,2±3,24 |
Единичная |
H. murinum (2x, W 20) |
B5L |
I |
25,0±6,45 |
0 |
|
H. murinum (4x) |
B5L |
I |
71,4±7,64 |
3,8±3,01 |
Единичная |
H. murinum (6x, W 277, W 278) |
B5L |
I |
25,0±2,17 |
10,6±3,24 |
Единичная |
H. flexuosum (2x, H 1110, |
B5L |
II |
44,4±8,78 |
51,0±8,84 |
Множественная |
H. pusillum (2x, И 491050) |
B5L |
II |
42,5±7,82 |
0 |
|
H. jubatum (4x, К 1) |
B5L |
II |
98,6±1,40 |
86,7±6,20 |
Множественная |
H. procerum (6x, W 356, |
B5L |
II |
77,5±6,36 |
41,7±6,37 |
Множественная |
H. lechlery (6x, H 1496) |
B5L |
II |
96,0±3,92 |
40,1±8,94 |
Множественная с |
H. marinum (4x, W 436, W 439) |
B5L |
II |
97,8±2,17 |
20,0±8,94 |
Множественная |
H. depressum (4x, W 309, |
B5L |
II |
60,6±6,16 |
0 |
Множественная с |
П р и м е ч а н и е. Во всех вариантах среду N6 без гормонов использовали в качестве регенерационной. Для показателей эффективности приведены значения X±x (доля и ошибка доли, выраженные в процентах; см. раздел «Методика»). |
|||||
Для видов, относящихся к секции Critesion(H. jubatum, H. procerum, H. lechlery), характерна высокая эффективность каллусогенеза — от 98,6 % у H. jubatum на среде B5L до 58,8 % у H. lechlery на среде MС (см. табл. 1). На всех каллусогенных средах, используемых в эксперименте, формировался рыхлый, белый, непрозрачный каллус, быстро развивающийся в каллус II типа с выраженной узловатой структурой. Наибольшую эффективность регенерации наблюдали у вида H. jubatum, промежуточную позицию занимал вид H. procerum, у вида H. lechlery показатели были ниже.
Реакцию видов секции Stenostachys на среды разного состава оценивали на двух тетраплоидных видах — H. marinum и H. depressum. Для них была характерна высокая эффективность каллусогенеза на всех используемых каллусогенных средах (из незрелых зародышей развивался каллус II типа). Процесс регенерации проходил с относительно низкой эффективностью — от 20,0-27,8 % для H. marinum до 8,6-23,9 % для H. depressum.
У различных видов Hordeum при культивировании каллусов на разных каллусогенных средах и переносе на единую органогенную отмечаются общие признаки — типы каллуса и типы регенерации, характерные для определенных групп видов. Так, I тип каллуса с наибольшей частотой встречался у видов, относящихся к секции Hordeum, II — был характерен для видов секций Anisolepis, Critesion и Stenostachys; основные типы регенерации — единичная (в основном присуща видам секции Hordeum) и множественная (свойственна для большинства видов секций Anisolepis,Critesion и Stenostachys). При регенерации каллусов у вида H. lechlery наблюдали множественную регенерацию с доминированием одного побега, а для H. depressum была характерна множественная регенерация с некрозом каллусной ткани. Одинаковый специфичный для образца тип регенерации проявлялся при использовании всех трех сред. Эффект состава среды для культивирования каллусов на регенерацию растений оказался невелик, однако при использовании среды B5L после пересадки на органогенную среду чаще наблюдался ризогенез корончатого типа, а каллусогенез на среде MС в дальнейшем обычно приводил к некрозу каллуса.
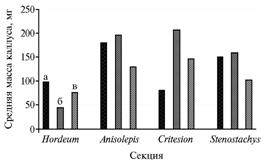 |
Интенсивность роста каллусов у видов разных секций рода Hordeum в зависимости от состава питательных сред: а, б и в — соответственно среда B5L, N6 и MC. Описание сред см. в разделе «Методика». |
От минерального состава питательной среды зависела интенсивность роста биомассы каллуса. Определение суммарной массы каллусов как интегральной характеристики их роста у видов, относящихся к разным секциям рода Hordeum, показало, что для образцов секции Hordeum более интенсивным был рост на средах MС и B5L, менее интенсивным — на среде N6. В других секциях (Anisolepis, Critesion и Stenostachys) на среде N6 каллусы росли лучше, чем на остальных (рис.). На среде N6 формировались каллусы с большим числом меристематических зон, чем на средах B5L и MС, причем это оказалось характерно как для дикорастущих форм, так и для культурного ячменя. На среде N6 также регистрировали повышение эффективности регенерации у большинства дикорастущих видов и наименьшее число некрозов каллусной ткани. В связи с этим среда N6 была выбрана как оптимальная для культивирования in vitro для всех видов рода Hordeum и межвидовых гибридов, поэтому при сравнительной оценке эффективности микроклонального размножения с применением эксплантов разного типа (молодые соцветия, незрелые зародыши и зрелые зерновки) использовали только среду N6.
У образцов секции Hordeum каллусообразование наблюдали у эксплантов всех типов (табл. 2). Первичные каллусы имели сходную морфологию (рыхлые водянистые, то есть соответствующие I типу), которая не зависела от типа экспланта. Для образцов разных подвидов H. vulgare и цитотипов H. bulbosum не отмечали регенерацию из молодых соцветий. У изученных образцов тетраплоидного цитотипа H. murinumрегенерация происходила, причем у одного из них (H. murinum И 0118916) при формировании каллусов из незрелых зародышей ее эффективность оказалась значительно ниже, чем в варианте с молодыми соцветиями (Рχ2 = 0,015), тогда как с зерновками получили величины того же порядка. Следует отметить, что для всех использованных образцов секции Hordeum, несмотря на различия в частоте регенерации, характерна единичная регенерация из каллусов разного происхождения. Лишь у одного тетраплоидного образца H. murinum Г 1 была зарегистрирована множественная регенерация с преобладанием развития одного побега.
| 2. Характеристика каллусогенеза и регенерации in vitro у растений разных видов секции Hordeumв зависимости от типа эксплантов | ||||
Вид, сорт, образец |
Тип |
Эффективность, % |
Тип регенерации |
|
каллусогенеза |
регенерации |
|||
H. vulgare: |
|
|
|
|
Roland |
ЗД |
71,7±5,81 |
16,7±3,40 |
Единичная |
Betzes |
ЗД |
85,0±4,61 |
70,0±6,42 |
Единичная
|
Полярный 14 |
ЗД |
83,6±3,13 |
0 |
Единичная |
Ранний 1 |
ЗД |
73,9±5,29 |
2,0±1,96 |
Единичная |
ssp.spontaneum W 31 |
ЗД |
59,5±8,07 |
0 |
|
ssp.spontaneum И 0118914 |
ЗД |
58,3±8,22 |
20,0±8,94 |
Единичная |
ssp. agriocrithon И 0118914 |
ЗД |
70,0±5,92 |
33,8±9,28 |
Единичная |
H. bulbosum (2x): |
|
|
|
|
W 510 |
ЗД |
6,3±6,07 |
0 |
|
H. bulbosum (4x): |
|
|
|
|
W 4 |
ЗД |
37,5±8,56 |
46,2±9,78 |
Единичная |
W 121 р1 |
С |
81,0±6,05 |
0 |
|
W 121 р2 |
С |
29,4±5,52 |
0 |
|
W 121 р3 |
С |
38,1±7,49 |
0 |
|
H. murinum (2x) W 20 |
ЗД |
11,2±2,93 |
0 |
Единичная |
H. murinum (4x) И 0118916 |
ЗД |
62,5±7,65 |
2,1±2,05 |
Единичная |
H. murinum (4x) И 0118919 |
С |
88,2±5,53 |
22,7±8,93 |
Единичная |
H. murinum (4x) Г 1 |
С |
71,4±9,22 |
13,3±8,77 |
Множественная с доминированием одного побега |
H. murinum (6x): |
|
|
|
|
W 278 |
ЗД |
84,4±6,41 |
63,0±9,29 |
Единичная |
И 491045 |
С |
61,5±7,79 |
0 |
|
П р и м е ч а н и е. ЗД, ЗН и С — соответственно незрелые зародыши, зрелые зерновки и молодые соцветия. Для показателей эффективности приведены значения X±x (доля и ошибка доли, выраженные в процентах; см. раздел «Методика»). |
||||
Для видов секции Anisolepis каллусогенез отмечали с эксплантами всех типов (табл. 3), при этом формировался плотный узловатый каллус (II тип). Регенерация происходила не у всех изученных образцов. Так, у H. pusillum И 491050 регенерация из каллусов отсутствовала (независимо от происхождения эксплантов). У H. flexuosum Н 1116 частота регенерации из соцветий была значительно ниже, чем из зародышей и зерновок. При сравнении по критерию χ2 оказалось, что эти различия статистически достоверны: для каллусов из соцветий и зародышей — при p = 0,001 (χ2 = 30,07), из зрелых зерновок и соцветий — при р = 0,01 (Рχ2= 0,002). У H. muticum H 958 эффективность регенерации в каллусах из зерновок была значительно выше, чем в каллусах, полученных из двух других типов эксплантов. Несмотря на разную эффективность регенерации из каллусов различного происхождения, ее тип у образцов секции Anisolepis (H. muticumH 958, H. flexuosum H 1116, см. табл. 3) не зависел от использованного экспланта. Для видов этой секции отмечали следующие типы регенерации: единичная (H. cordobense H 1702), множественная (H. interсedens H 1940), множественная с доминированием одного побега (H. muticum H 958, H 1784) и множественная с некрозом каллуса (H. flexuosum H 1116, H 1112;H. chilense И 559966).
3. Характеристика каллусогенеза и регенерации in vitro у растений разных видов Hordeum из секций Anisolepis,Stenostachys и Critesion в зависимости от типа экспланта |
||||
Вид, сорт, образец |
Тип |
Эффективность, % |
Тип регенерации |
|
каллусогенеза |
регенерации |
|||
С е к ц и я A n i s o l e p i s |
||||
H. pusillum И 491050 |
ЗД |
56,4±5,61 |
0 |
|
H. muticum: |
|
|
|
|
H 958 |
ЗД |
83,6±4,53 |
6,8±3,80 |
Множественная с до- |
H 1784 |
ЗД. |
61,5±9,54 |
26,7±11,42 |
Множественная с доминированием одного побега |
H. interсedens H 1940 |
ЗД. |
86,4±4,22 |
54,5±10,61 |
Множественная |
H. flexuosum: |
|
|
|
|
H 1116 |
ЗД |
80,0±5,16 |
77,5±6,60 |
Множественная с |
H 1112 |
С |
35,7±7,39 |
6,4±3,57 |
Множественная с некрозом |
H 1110 |
С |
55,2±9,23 |
0 |
|
H. cordobense H 1702 |
ЗД |
83,3±5,38 |
5,3±5,14 |
Единичная |
H. chilense И 559966 |
С |
87,7±3,79 |
16,4±3,13 |
Множественная с некрозом |
С е к ц и я C r i t e s i o n |
||||
H. jubatum: |
|
|
|
|
К 1 |
ЗД |
98,6±1,40 |
38,9±8,13 |
Множественная |
Ш 2 |
С |
93,7±3,06 |
96,8±1,82 |
Множественная |
Ш 5 |
С |
92,5±13,09 |
89,7±3,69 |
Множественная |
Я 1 |
С |
100 |
0 |
|
H. procerum: |
|
|
|
|
И 491049 |
ЗД |
64,7±6,71 |
45,5±3,69 |
Множественная |
W 356 |
С |
71,9±4,09 |
47,6±4,92 |
Множественная |
H. lechlery Н 1496 |
ЗД |
93,8±4,26 |
2,8±2,75 |
Множественная с доминированием одного побега |
H. arizonicum H 2313 |
С |
42,8±9,35 |
33,3±19,24 |
Множественная |
С е к ц и я S t e n o s t a c h y s |
||||
H. marinum (2x) H 299 |
С |
45,8±10,17 |
40,0±12,65 |
Единичная |
H. marinum (4x): |
|
|
|
|
И 0118920 |
ЗД |
82,3±3,35 |
33,9±6,33 |
Множественная |
И 0118921 |
С |
42,6±3,59 |
4,8±3,30 |
Множественная |
W 493 |
С |
28,2±3,93 |
28,2±7,21 |
Множественная |
H.depressum: |
|
|
|
|
W 309 |
ЗД |
100 |
23,3±6,57 |
Множественная с некрозом |
И 538814 |
С |
100 |
61,1±11,49 |
|
H.parodii H 1269 |
ЗД |
66,7±6,12 |
16,7±7,61 |
Множественная |
H. patagonicum H 1468 |
ЗД |
92,5±3,73 |
21,4±5,48 |
Множественная |
H. californicum И 559970 |
ЗД |
80,0±8,94 |
52,9±12,48 |
Множественная |
H. secalinum W 418 |
С |
81,0±5,04 |
0 |
|
П р и м е ч а н и е. То же, что в таблице 2. Прочерки означают, что образовавшиеся каллусы были нежизнеспособными и в экспериментах по регенерации не использовались. |
||||
Для всех изученных образцов видов секции Critesion было характерно образование компактного узловатого каллуса. Исключение составлял образец H. jubatum Я 1, который формировал рыхлый водянистый каллус, не дающий регенерации. У остальных отмечали множественную регенерацию, у образца H. lechlery Н 1496 на ее фоне — доминирование развития одного побега. Тип регенерации для образцов этой секции также не зависел от типа экспланта (см. табл. 3). Следует отметить, что в секции Сritesionу каллусов из соцветий регенерация оказалась выше, чем у полученных с использованием эксплантов других типов. У образцов H. jubatum K 1 и H. procerum И 491049 наблюдали регенерацию в 100 % каллусов, образованных из соцветий, тогда как в вариантах с эксплантацией незрелых зародышей и зрелых зерновок этот показатель находилась в пределах 30,0-45,5 % (различия во всех случаях достоверны при р = 0,001). У H. lechlery H 1496 эффективность регенерации была несколько ниже выявленной для H. jubatum K 1 и H. procerum И 491049, но и у этого образца частота регенерации в каллусах, происходящих из соцветий, достоверно превышала (р = 0,001) соответствующий показатель в варианте с незрелыми зародышами.
Виды секции Stenostachys, как правило, формировали плотный узловатый каллус (II тип) из эксплантов разного типа, независимо от эффективности каллусообразования (см. табл. 3), при этом имелась тенденция к более низкой эффективности регенерации в каллусах из молодых соцветий, чем при использовании зародышей (см. табл. 3). Так, у H. depressum W 309 показатель при экплантировании незрелых зародышей достоверно превышал таковой в варианте с соцветиями (χ2 = 5,183, р < 0,05). Характер регенерации в каллусах, полученных из различных эксплантов, оказался одинаковым в пределах образца (см. табл. 3). Для большинства изученных форм была типична множественная регенерация (H. marinum4½ — И 0118920, И 0118921, W 493, H. parodii H 1269, H. patagonicumH 1468, H. californicum И 559970). У обоих изученных образцов H. depressumрегистрировали множественную регенерацию, которая сопровождалась некрозом каллусов. Единичную регенерацию в этой секции отмечали только у диплоида H. marinum (см. табл. 3).
Эффективность регенерации из различных типов эксплантов зависит от того, на какой стадии развития (оптимальной или неоптимальной) они были отобраны для получения первичных каллусов (23, 25). Поскольку обычно ориентиром в подобных случаях служит размер экспланта, эффективность регенерации может варьировать от эксперимента к эксперименту. Качественная же характеристика регенерации не зависит от типа экспланта.
Таким образом, у рода Hordeum выявлено три типа регенерации: единичная — у видов секции Hordeum, а также у изученных образцов H. cordobense и H. californicum, множественная — у образцов из секции Critesion и у большинства изученных видов секции Stenostachys, множественная с некрозом каллуса — у H. depressum и H. chilense. Тип регенерации, характерный для образца, не меняется в зависимости от экспланта и среды, используемой для получения первичных каллусов.
Л И Т Е Р А Т У Р А
1. Н е в с к и й С.А. Материалы к познанию дикорастущих ячменей в связи с происхождением Hordeum vulgare и Hordeum distichum L. (опыт монографии рода Hordeum L.). В кн.: Флора и систематика высших растений. Вып. 5. М.-Л., 1941: 64-255.
2. B o t h m e r R., J a k c o b s e n N., B a d e n C., J o r g e n s e n R.B., L i n d e - L a
u r s e n I. An ecogeographical study of the genus Hordeum. IPGR, Rome, 1991.
3. L u h r s R., L ö r z H. Plant regeneration in vitro from embryogenic cultures of spring and winter type barley (Hordeum vulgare L.) varieties. Theor. Appl. Genet., 1987, 75: 16-25.
4. Z i a u d d i n A., S i m o n E., K a s h a K.J. Improved plant regeneration from shed microspore culture in barley (Hordeum vulgare L.) cv. Igri. Plant Cell Reports, 1990, 90: 69-72.
5. R i k i i s h i K., M a t s u u r a T., M a e k a w a M., T a k e d a K. Light control of shoot regeneration in callus cultures derived from barley (Hordeum vulgare L.) immature embryos. Breeding Sci., 2008, 58: 129-135.
6. P o w e l l W., D u n w e l l J.M. In vitro genetics of barley (Hordeum vulgare L.): Response of immature embryos to 2,4-dichlorophenoxyacetic acid. Heredity, 1987, 8: 75-80.
7. И с а е в а Н.А., Ш у м н ы й В.К., П е р ш и н а Л.А. Изучение особенностей каллусогенеза у разных видов ячменя. Изв. Сибирского отделения АН СССР, Сер. Биологические науки, 1980, 1(5): 70-74.
8. R o t e m - A b a r b a n e l l D., B r e i m a n n A. Plant regeneration from immature and mature embryo derived calli of Hordeum marinum. Plant Cell Tissue and Organ Cult., 1989, 16: 273-276.
9. B r e i m a n A. Plant regeneration from Hotdeum spontaneum and Hordeum bulbosum immature embryo derived calli. Plant Cell Rep., 1985, 2: 70-73.
10. O r t o n T.J. A quantitative analysis of growth and regeneration from tissue cultures of Hordeum vulgare, H. jubatum and their interspecific hybrid. Environ. Exp. Botany, 1979, l: 319-335.
11. Ч е р н о в В.Е., П е н д и н е н Г.И. Каллусогенез и регенерация в культуре незрелых зародышей дикорастущих видов рода Hordeum. Науч.-техн. бюл. ВИР, 1990, 204: 20-23.
12. Ч е р н о в В.Е., П е н д и н е н Г.И. Возможности использования в декоративных целях и особенности микроклонального размножения дикорастущих видов Hordeum. Sci. Works of the Lithuanian Institute of Horticulture and Lithuanian University of Agriculture, 2001, 20(4/2): 124-131.
13. E l l i s R.P., F o r s t e r B.P., R o b i n s o n D., H a n d l e y L.L.,
G o r d o n D.C., R u s s e l J.R., P o w e l l W. Wild barley: a source of genes for crop improvement in the 21st century? J. Exp. Botany, 2000, 51(342): 9-17.
14. К а р т е л ь Н.А., М а н е ш и н а Т.В. Каллусообразование у разных по генотипу растений ячменя (Hordeum vulgare L.). Цитология и генетика, 1977, 11: 486-490.
15. П е н д и н е н Г.И. Особенности микроразмножения in vitro ячменно-пшеничных и пшенично-ржаных гибридов. Сб. науч. тр. по прикл. бот., ген и сел. (Л.), 1989, 128: 39-45.
16. N a k a m u r a C., K e l l e r W., F e d a k G. In vitro propagation and chromosome doubling of Triticum crassum x Hordeum vulgare hybrid. Theor. Appl. Genet., 1984, 60: 80-96.
17. Ч е р н о в В.Е., П е н д и н е н Г.И. Особенности микроразмножения in vitro межвидовых гибридов ячменя. Сб. науч. тр. по прикл. бот., ген и сел. (СПб), 1992, 148: 53-57.
18. И с а е в а Н.А., П е р ш и н а Л.А., Ш у м н ы й В.К. Особенности органогенеза в каллусных тканях разных видов и межвидовых гибридов ячменя. Изв. Сибирского отделения АН СССР: Сер. Биологические науки, 1983, 5: 76-81.
19. L u p o t t o Е. Callus induction and plant regeneration from barley mature embrios. Annals of Botany, 1984, 54: 523-529.
20. S e g u i n - S w a r t z G., K o t t L., K a s h a K.J. Development of haploid cell lines from immature barley, Hordeum vulgare, embryos. Plant Cell Rep., 1984, 3: 95-97.
21. C h u C.C., W a n g C.C., S u n C.S., H s u C., J i n K.C., C h u C.Y., B i F.Y. Establishment of an efficient medium for anther culture of rice trough comparative experiments of the nitrogen sources. Scientia Sinika, 1975, 65: 559-568.
22. M u r a s h i g e T., S k o o g F.A. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiologia Plantarum, 1962, 15: 473-497.
23. З а й ц е в Г.Н. Математическая статистикав экспериментальной ботанике. М., 1984.
24. D a l e P.J., D e a m b r o g i o E.A. Comparison of callus induction and plant regeneration from different explants of Hordeum vulgare. Z. Pflanzenpphysiol., 1979, 94: 65-77.
25. G o l d s t e i n C.S., K r o n s t a d t W.E. Tissue culture and plant regeneration from immature embryo explants of barley Hordeum vulgare. Teor. Appl. Genet., 1986, 71: 631-636.
26. Д у н а е в а С.Е., К о в а л е в а О.Н., Г о л у б е в а Е.А.,
М о с к а л е в а Г.И., К о
з ы р е в а О.Г. Способность незрелых зародышей к образованию растений-регенерантов в культуре in vitro у ранне- и позднеспелых сортов ячменя. 2. Морфологическая дифференциации зародышей как показатель компетентности их клеток к регенерации растений. Физиология растений, 2000, 47: 58-64.
COMPARATIVE EVALUATION CALLUSOGENESIS AND REGENERATION IN DIFFERENT BARLEY VARIETIES
V.E. Chernov, G.I. Pendinen
The authors studied the features of callusogenesis and regeneration (number, mass, morphological characteristics and efficiency of callus formation, morphological characteristics of regenerants and regeneration efficiency) in the species from different section of Hordeum L. genus. For induction of callusogenesis the three explants types were used (young blossom cluster, immature corcule, ripe corn seeds), and also the three nutrient media differed on mineral content (N6, B5L, Murashige-Skoog). It was established, that a formation of callus tissue in species of Hordeum section differs from the same in species of different section (Anisolepis, Critesion, Stenostachys). The callus type do not depends on medium content and used explants. Some of studied species didn’t revealed the regeneration of plants from callus. The single regeneration type was specific for species from Hordeum section, but the multiple type — for species from Anisolepis, Critesion, Stenostachys sections. The type regeneration didn’t depend on selected explants (young blossom cluster, immature corcule, and ripe corn seed).
Keywords: callusogenesis, regeneration, explants, in vitro culture, genus Hordeum, wild barley.
ГНУ Всероссийский НИИ растениеводства |
Поступила в редакцию |













