УДК 633.358:631.461.5
ВЛИЯНИЕ АЗОТСОДЕРЖАЩИХ СОЕДИНЕНИЙ НА РОСТ КЛУБЕНЬКОВЫХ БАКТЕРИЙ В КУЛЬТУРЕ И ИХ ВЗАИМОДЕЙСТВИЕ С КОРНЯМИ ПРОРОСТКОВ ГОРОХА
А.К. ГЛЯНЬКО, Н.Б. МИТАНОВА, Л.Е. МАКАРОВА, Г.Г. ВАСИЛЬЕВА
Изучали влияние азотсодержащих соединений KNO3, KNO2, (NH4)2SO4 и нитропруссида натрия на рост клубеньковых бактерий (Rhizobium leguminosarum bv. viceae) в культуре, а также адгезию и проникновение ризобий в ткани корня этиолированных проростков гороха сорта Марат. Установлено негативное влияние нитропруссида натрия и KNO2 на взаимодействие ризобий с корневой системой бобового растения. Экзогенный гемоглобин уменьшал отрицательное действие этих соединений на бактерии и проростки.
Ключевые слова: азотсодержащие соединения, нитропруссид натрия, гемоглобин, клубеньковые бактерии, проростки гороха, адгезия и проникновение бактерий, световая микроскопия.
Известно, что образование и функционирование бобово-ризобиаль-ных структур (клубеньков) — процесс многоэтапный, сложный и подверженный действию различных экзо- и эндогенных факторов (1-3). Так, высокое содержание минерального азота в почве негативно влияет на формирование клубеньков и их последующую активность (4). В то же время показано, что KNO3, (NH4)2SO4, NH4NO3 в концентрациях до 60-80 мM не препятствуют росту и размножению клубеньковых бактерий в культуре (5, 6).
Кроме минерального азота, в почве присутствуют другие его соединения, в частности газообразные — закись азота (N2O) и оксид азота (NO), которые выделяются как промежуточные продукты при нитрификации и денитрификации минерального азота (7, 8). Установлено, что при внесении в почву (NH4)2SO4 в дозе 100 кг азота/га эмиссия NO увеличивается с 2,4 до 46,9, N2O — с 0,95 до 7,4 нг•м-2•c-1 (7).
Оксид азота — полифункциональная сигнальная молекула, управляющая внутриклеточными и межклеточными процессами в растительных, животных и бактериальных клетках (9, 10). Разными авторами обсуждается отрицательное влияние NO на функционирование клубеньков при высоком содержании нитратного азота в почве (11-13). По мнению одних (11), нитратный азот в бактероидах восстанавливается до NO, который связывается с леггемоглобином с образованием нитрозиллеггемоглобина, что приводит к ингибированию переноса кислорода в бактероиды, снижению активности нитрогеназы и деградации клубеньков. В других опытах показано, что функционирующие клубеньки люцерны в норме содержат NO, который образуется из аргинина в реакции, катализируемой синтазой оксида азота, но без участия нитрат- или нитритредуктаз (12). Авторы считают, что при оптимальных условиях NO может выполнять функции, не связанные с включением защитных реакций или апоптозом. В более ранней работе (13) они предположили, что на начальных стадиях формирования симбиоза NO участвует также в регуляции числа клубеньков на корнях при экстремальных воздействиях.
Нашей целью была оценка влияния соединений азота на рост клубеньковых бактерий в культуре, адгезию и проникновение ризобий в ткани корня при инокуляции проростков гороха и морфологические особенности корневых волосков на начальном этапе бобово-ризобиального взаимодействия.
Методика. Штамм CIAM 1026 клубеньковых бактерий (Rhizobiumleguminosarum bv. viceae) был получен из Всероссийского НИИ сельскохозяйственной микробиологии. Клубеньковые бактерии выращивали на агаризованной среде с добавлением отвара из семян гороха (14) и использовали для инокуляции растений или для получения культуры на жидкой минимальной среде с минеральными и органическими добавками (15, 16).
Действие азотсодержащих соединений и гемоглобина на размножение бактерий оценивали по изменению оптической плотности суспензий (А590) с помощью ФЭК КФК-2 (Загорский оптико-механический завод, СССР) через 8 ч после внесения указанных соединений в среду при культивировании бактерий в темноте при температуре 22 ºС. Варианты опыта были следующими: контроль (Н2О); KNO3 (60 мМ); (NH4)2SO4 (60 мМ); KNO2 (3,3 мМ); KNO2 (3,3 мМ) + гемоглобин из эритроцитов лошади (0,67 мкМ) («MP Biome-dicals», CША); нитропруссид натрия Na2[Fe(CN)5NO] («Sigma», США) (0,019; 0,19; 0,67 мМ); Na2[Fe(CN)5NO] (0,67 мМ) + гемоглобин (0,67 мкМ).
Семена гороха (Pisumsativum L.) сорта Марат промывали теплой мыльной водой, поверхностно стерилизовали 3 % раствором пероксида водорода в течение 15 мин и промывали дистиллированной водой. Затем их проращивали в течение 2 сут на фильтровальной бумаге, смоченной дистиллированной водой, при температуре 22 ºС в темноте. Для опытов отбирали проростки с длиной корня 2,4-3,0 см, которые помещали в кюветы на фильтровальную бумагу, смоченную дистиллированной водой (контроль) или растворами гемоглобина (2 мкМ); KNO3 (20 мМ); KNO2 (20 мМ); (NH4)2SO4 (20 мМ); Na2[Fe(CN)5NO] (2 мМ); KNO2 (20 мМ) и гемоглобина (2 мкМ); Na2[Fe(CN)5NO] (2 мМ) и гемоглобина (2 мкМ). Одновременно проводили инокуляцию проростков суспензией бактерий (2x108 клеток/мл, по 1 мл суспензии на корень).
Проростки выдерживали в термостате при температуре 22 ºС в темноте в течение 1-2 сут, после чего оценивали интенсивность адгезии и проникновения клубеньковых бактерий (17). Для удаления слабосвязанных ризобий корни гороха отмывали натрий-фосфатным буфером (рН 7,4) в течение 15 мин с использованием лабораторного встряхивателя («Elpan», Польша), затем тщательно отмывали в струе водопроводной и стерильной воды, после чего корни гомогенизировали в стерильной дистиллированной воде. Гомогенат (разведение 1:1000) высевали на твердую агаризованную среду (по 0,05 мл на чашку Петри). Об интенсивности адгезии и проникновения бактерий в корень судили по числу образовавшихся колоний (одна колония условно соответствовала одной бактерии). Рост проростков оценивали по накоплению корневой биомассы.
В опытах со световой микроскопией растения выращивали на фоне Н2О (контроль); KNO3 (60 мМ); KNO2 (20 мМ); (NH4)2SO4(60 мМ); Na2[Fe(CN)5NO] (2 мМ) и при добавлении к каждому из азотсодержащих соединений гемоглобина (2 мкМ). Микроскопирование образцов осуществляли через 1 сут после инокуляции: целые корни, обработанные витальным красителем крезиловым голубым («Merck», Германия) (18), изучали под световым микроскопом Peraval Interphako («Carl Zeiss», ГДР). Снимки получали с помощью цифрового фотоаппарата «Sony» (Япония).
Средние значения показателей и их стандартные ошибки вычисляли на основании результатов 3-5 независимых экспериментов. Достоверность различий оценивали по t-критерию Стьюдента. `
Результаты. Добавление в суспензию клубеньковых бактерий нитропруссида натрия, служащего донором NO в биологических средах, в концентрациях 0,019; 0,19 и 0,67 мМ ингибировало их рост соответственно на 23, 37 и 58 % (табл. 1), причем наличие гемоглобина полностью снимало этот отрицательный эффект. Внесение в культуральную среду KNO3 и
(NH4)2SO4 в концентрации 60 мМ не влияло на рост ризобий, что согласуется с данными литературы (5, 6). Действие KNO2 на рост бактерий было аналогично действию нитропруссида натрия с той разницей, что с добавлением гемоглобина негативное влияние KNO2 усиливалось, а не устранялось.
| 1. Рост клубеньковых бактерий Rhizobium leguminosarum bv. viceae в жидкой культуре при разных концентрациях азотсодержащих соединений и на фоне гемоглобина | |||
Соединение |
Концентрация |
Оптическая плотность образца, А590 |
|
в опыте, M±m |
относительно |
||
Контроль (Н2О) |
|
0,120±0,006 |
100 |
KNO3 |
60 мМ |
0,120±0,001 |
100 |
KNO2 |
3,3 мМ |
0,070±0,002 |
58 |
KNO2 + гемоглобин |
3,3 мМ + 0,67 мкМ |
0,047±0,002 |
39 |
(NH4)2SO |
60 мМ |
0,120±0,001 |
100 |
Na2[Fe(CN)5NO] |
0,019 мМ |
0,092±0,002 |
77 |
Na2[Fe(CN)5NO]+ гемоглобин |
0,67 мМ + 0,67 мкМ |
0,120±0,002 |
100 |
Соли KNO2 и (NH4)2SO (20 мМ) стимулировали связывание и проникновение клубеньковых бактерий в ткани корней проростков гороха (P > 0,95; ν = 4). В варианте с KNO3 достоверных различий по сравнению с контролем не выявили (табл. 2), с нитропруссидом натрия (2 мМ) — наблюдали уменьшение числа адсорбированных на поверхности корней ризобий в 4,6 раза (P = 0,99; ν = 4). Присутствие в среде для выращивания одновременно гемоглобина и нитропруссида частично (в 1,5 раза) снимало отрицательный эффект последнего (P > 0,99; ν = 4), только гемоглобина — стимулировало процессы адгезии и проникновения бактерий в ткани корня в 1,4 раза (P > 0,99; ν = 4). Рост корней проростков сильно ингибировался (на 45 %) в вариантах с нитропруссидом натрия и KNO2. Гемоглобин (2 мкМ) полностью снимал отрицательное действие нитропруссида натрия на рост корней (P > 0,99, ν = 4), частично — отрицательное влияние KNO2. Однако в последнем случае различие между вариантами было недостоверным (Р < 0,95, ν = 4). Добавление в среду только гемоглобина не оказывало влияния на рост корней.
| 2. Численность клубеньковых бактерий Rhizobium leguminosarum bv. viceae в тканях и биомасса корней у этиолированных проростков гороха сорта Марат, выращиваемых на растворах азотсодержащих соединений и гемоглобина | ||
Вариант выращивания |
Число ризобий, |
Сырая масса корня, мг |
Контроль (Н2О) |
106,00±6,07 |
130±9 |
KNO3 (20 мМ) |
116,50±5,92 |
130±14 |
KNO2 (20 мМ) |
138,00±4,37 |
55±14 |
KNO2 + гемоглобин (20 мМ + 2 мкМ) |
– |
78±5 |
(NH4)2SO (20 мМ) |
149,40±5,57 |
105±13 |
Na2[Fe(CN)5NO] (2 мМ) |
23,10±1,51 |
55±1 |
Na2[Fe(CN)5NO] + гемоглобин (2 мМ + 2 мкМ) |
36,10±1,84 |
125±4 |
Гемоглобин (2 мкМ) |
151,80±8,40 |
120±23 |
П р и м е ч а н и е. Прочерк означает отсутствие данных. |
||
Известно, что начальные этапы взаимодействия клубеньковых бактерий с корнями бобового растения характеризуются искривлением корневых волосков и образованием в них инфекционных нитей. Мы попытались оценить влияние изучаемых соединений на эти процессы с помощью световой микроскопии.
В контрольном варианте (рис., А) корневые волоски были длинными (до 300-430 мкм), с хорошо выраженными искривлениями и инфекционными нитями. Добавление в среду нитропруссида натрия вызывало образование коротких (до 90 мкм) корневых волосков с булавовидными утолщениями на концах (см. рис., Б). Их искривление было выражено слабо, инфекционные нити встречались намного реже, что свидетельствовало о нарушении процессов взаимодействия симбионтов. Наличие гемоглобина в среде с нитропруссидом способствовало увеличению длины инфекционных нитей и корневых волосков (до 120-490 мкм), а также их более заметному искривлению (см. рис., В).
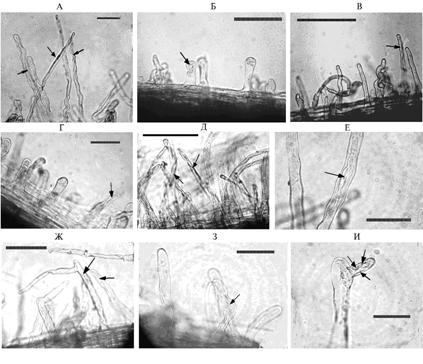 |
Развитие корневых волосков у этиолированных проростков гороха сорта Марат через 24 ч после инокуляции Rhizobium leguminosarum bv. viceae при выращивании на воде (контроль), растворах азотсодержащих соединений и дополнительном фоне гемоглобина: А — контроль; Б — нитропруссид натрия (2 мМ); В — нитропруссид натрия (2 мМ) + гемоглобин (2 мкМ); Г — KNO2 (20 мМ); Д — KNO2 (20 мМ) + гемоглобин (2 мкМ); Е — KNO3 (60 мМ); Ж — KNO3 (60 мМ) + гемоглобин (2 мкМ); З — (NH4)2SO (60 мМ); И — (NH4)2SO (60 мМ) + гемоглобин (2 мкМ). Стрелки указывают на инфекционные нити внутри корневых волосков. Отрезки прямых линий в углах снимков соответствуют 100 мкм. Снимки получены на расстоянии от кончика корня (мм): А — 25, Б — 21, В — 35, Г — 17, Д — 20, Е — 25, Ж — 23, З —18, И — 20. Длина корней в разных вариантах при отборе проб колебалась от 40 до 70 мм. |
При добавлении KNO2, как и в случае с нитропруссидом, корневые волоски были короткими (до 90-200 мкм), булавовидными, слабо искривленными, инфекционные нити встречались редко (в корневых волосках, достигших длины 180-200 мкм) (см. рис., Г). Дополнительное внесение в эту среду гемоглобина способствовало увеличению длины инфекционных нитей и корневых волосков (до 310 мкм), а также усилению их искривления (см. рис., Д).
Содержание в среде KNO3 и (NH4)2SO не оказывало резко отрицательного влияния на первичные этапы взаимодействия симбионтов (см. рис., Е, З). При добавлении гемоглобина в среду с сульфатом аммония на корневых волосках образовывались необычные выросты (см. рис., Ж, И).
Резюмируя полученные результаты, следует отметить, что нитропруссид натрия, выступающий в роли донора NO, негативно влиял на рост и размножение ризобий в культуре, их адгезию и проникновение в ткани корня, а также на рост корневых волосков и корней проростков гороха. Токсический эффект NO на рост клубеньковых бактерий, по-види-мому, обусловлен легким поглощением этого вещества бактериями и включением его в метаболизм бактериальной клетки, что ведет к замедлению роста ризобий и полной или частичной потере способности взаимодействовать с бобовым растением. Положительное влияние гемоглобина, вероятно, объясняется его ролью детоксикатора, связывающего NO с образованием нитрозилгемоглобина (19).
В варианте с нитритом калия гемоглобин не снимал негативный эффект этого соединения на рост ризобий в культуре. Возможно, токсическое действие нитритов в этом случае проявляется после их поглощения бактериальными клетками. Доступность гемоглобина для поглощения ризобиями нами не исследовалась. Однако в опыте с проростками гороха гемоглобин частично ослаблял отрицательный эффект нитритов на рост макросимбионта (см. табл. 2). В отличие от нитропруссида натрия нитритная соль не лимитировала адгезию и проникновение клубеньковых бактерий в корень, но, как показало микроскопирование, взаимодействие ризобий и бобового растения нарушалось. Вопрос о механизмах действия KNO2 требует углубленных исследований. Можно предположить, что при этом токсический эффект также обусловлен действием оксида азота, образующегося в бактериальных и растительных клетках.
Нитрат калия и сульфат аммония даже в очень высокой концентрации (20-60 мМ) не оказывали отрицательного влияния на рост ризобий в культуре, их адгезию, проникновение в корень и рост проростков. Негативное действие этих соединений на симбиоз, по-видимому, проявляется после биохимических превращений минерального азота в растительных клетках. Возможный продукт этих превращений — оксид азота. По данным литературы, в образовании NO в растительных клетках участвуют нитрат- и нитритредуктазы, восстанавливающие NO3 и NO2 до оксида азота (20, 21). В настоящее время важное значение придается изучению роли несимбиотического гемоглобина в растениях (22, 23). Исследователи считают, что cинтез несимбиотического растительного гемоглобина связан с действием абиотических и биотических факторов и детоксикацией NO (23).
Таким образом, оксид азота, образующийся как продукт микробиологических превращений минерального азота в почве, оказывает негативное влияние на ризобии и бобовое растение на начальных этапах их взаимодействия. На последующих этапах бобово-ризобиального симбиоза, связанных с образованием клубеньков и их функциональной активностью, оксид азота может образовываться в растительных клетках при восстановлении нитратов и нитритов.
Л И Т Е Р А Т У Р А
1. Н а з а р ю к В.М., Я к у т и н а О.П., К л е н о в а М.И. Роль почвенных ресурсов, минерального питания и симбиотической азотфиксации в повышении продуктивности растений. С.-х. биол., 2004, 5: 13-21.
2. В о р о б ь е в В.А. Симбиотическая азотфиксация. Новосибирск, 1998.
3. S t r e e t e r J.G. Effects of drought on nitrogen fixation in soybean root nodules. Plant Cell Environ., 2003, 26(8): 1199-1204.
4. Г л я н ь к о А.К., М и т а н о в а Н.Б. Физиологические механизмы отрицательного влияния высоких доз минерального азота на бобово-ризобиальный симбиоз. Вест. Харьковского аграрного ун-та. Сер. Биология. 2008, 2(14): 26-41.
5. К и р и ч е н к о Е.В., М а л и ч е н к о С.М., С т а р ч е н к о в Е.П. Влияние различных концентраций минерального азота на жизнеспособность Bradyrhizobium в чистой культуре. Физиол. биохим. культ. раст., 1993, 25(1): 24-27.
6. Связывание молекулярного азота клубеньковыми бактериями в симбиотических и культуральных условиях /Под ред. Е.П. Старченкова. Киев, 1984.
7. S c i b e U., S m i t h K.A., F o w l e r D. Nitrification and denitrification as sources of nitric oxide and nitrous oxide in a sandy loam soil. Soil Biol. Biochem., 1993, 25(11): 1527-1536.
8. A n d e r s o n I.C., L e v i n e J.S. Relative rates of nitric oxide and nitrous oxide production by nitrifiers, denitrifiers, and nitrate respirers. Appl. Environ. Microbiol., 1986, 51(5): 938-945.
9. B e l i g n i M.V., L a m a t t i n a L. Nitric oxide: a non traditional regulator of growth. Trends Plant Sci., 2001, 6(11): 508-509.
10. N e i l l S.J., D e s i k a n R., H a n c o c k J.T. Nitric oxide signalling in plants. New Phytol., 2003, 159(1): 11-35.
11. K a n a y a m a Y., Y a m a m o t o Y. Inhibition of nitrogen fixation in soybean plants suplied with nitrate. II. Accumulation and properties of nitrosylleghaemoglobin in nodules. Plant Cell Physiol., 1990, 31(2): 207-214.
12. B a u d o u i n E., P i e u c h o t L., E n g l e r G. е.а Nitric oxide is formed in Medicago truncutula-Sinorhizobium meliloti functional nodules. Mol. Plant-Microbe Interac., 2006, 19(9): 970-975.
13. H e r o u a r t D., B a u d o u i n E., F r e n d o P. е.а. Reactive oxygen species, nitric oxide and glutathione: a key role in the establishment of the legume — Rhizobium symbiosis? Plant Physiol. Biochem., 2002, 40(6-8): 619-624.
14. М а к а р о в а Л.Е., Л у з о в а Г.Б., Л о м о в а т с к а я Л.А. Роль эндогенных ФС в инфицировании Rhizobium leguminosarum корней гороха при низкой температуре. Физиол. раст., 1998, 45: 824-832.
15. Б е р е с т е ц к и й М.Н. Методические рекомендации по получению новых штаммов Rhizobiumleguminosarumи оценки их эффективности. Л., 1976.
16. H a r t w i n g U.A., J o s e f C.M., P h i l l i p s D.A. Flavonoid released naturally from alfalfa seeds enhance growth rate of Rhizobium meliloti. Plant Physiol., 1991, 95: 797-803.
17. H o L-C., W a n g J.L., S h e n d l e r M. e.a. Carbogidrate binding activities of Bradyrhizobium japonicum. III. Lectin expression, bacterial binding and nodulation efficiency. Plant J., 1994, 5(6): 873-884.
18. М а к а р о в а Л.Е., Н у р м и н с к и й В.Н. Влияние температуры на локализацию «свободных» ФС в тканях корней и деформацию корневых волосков у инокулированных Rhizobiumпроростков гороха. Цитология, 2005, 47(6): 519-525.
19. D o r d a s C., R i v o a l J., H i l l R.D. Plant haemoglobins, nitric oxide and hypoxis stress. Ann. Bot., 2003, 91(2): 173-178.
20. Y a m a s a k i H., S a k i h a m a Y. Simultaneous production of nitric oxide and peroxynitrite by plant nitrate reductase: in vitro evidence for the NR-dependent formation of active nitrogen species. FEBS Letters, 2000, 468(1): 89-92.
21. M o d o l o L.V., A u g u s t o O., A l m e i d a I.M.G. e.a. Nitrite as the major source of nitric oxide production by Arabidopsis thaliana in response to Pseudomonas syringae. FEBS Letters, 2005, 579(17): 3814-3820.
22. S a s a k u r a F., U c h i u m i T., S u z u k i A. e.a. A class 1 hemoglobin gene from Alnus firma functions in symbiotic and nonsymbiotic tissue to detoxity nitric oxide. Mol. Plant-Microbe Interact., 2006, 19(4): 441-450.
23. P e r a z z o l l i M., D o m i n i c i P., R o m e r o - P u e r t a s M.C. e.a. Arabidopsis nonsymbiotic haemoglobin AHb1 nodulates nitric oxide bioactivity. Plant Cell, 2004, 16(10): 2785-2794.
EFFECT OF NITROGEN-CONTAINING COMPOUNDS ON THE GROWTH OF ROOT NODULE BACTERIA IN CULTURE AND THEIR INTERACTION WITH ROOTS OF PEAS SEEDLINGS
A.K. Glyan’ko, N.B. Mitanova, L.E. Makarova, G.G. Vasil’eva
The authors investigated the effect of nitrogen-containing compound: KNO3, KNO2, (NH4)2SO4 and sodium nitroprusside on the growth of root nodule bacteria (Rhizobium leguminosarum bv. viceae) in culture and also on adhesion and penetration of rhizobia to root tissues of bleached-out peas seedlings of the Marat variety. The negative influence was established for KNO2 and sodium nitroprusside on interaction of rhizobia with root system, functional activity of nodules and legume plant. The exogenous haemoglobin has protective action on bacteria and seedlings.
Key words: compounds containing nitrogen, nitroprusside sodium, nodule bacteria, hemoglobin, pea seedlings, adhesion and penetration of bacteria, light microscopy.
Сибирский институт физиологии |
Поступила в редакцию |













